曲妥珠单抗、吉西他滨和紫杉醇联合治疗老年女性乳腺癌人表皮生长因子受体2阳性伴肺转移患者的临床研究
石晶晶,王宗宝,李长江,宋晓霞
1.青岛市中心医院(青岛大学第二临床医学院)急救中心,山东青岛266042;2.青岛市中医院急诊外科,山东青岛266033
乳腺癌是妇科发生率较高的一种恶性肿瘤,而患者中约30%具有人表皮生长因子受体2(HER2)阳性情况[1]。乳腺癌患者一旦出现HER2 阳性时,恶性程度升高,更容易发生转移,且预后不佳[2]。近年来临床推出了多种基因特异性治疗手段和各类抗肿瘤药物,其中曲妥珠单抗主要是通过重组DNA 衍生而成的1 种人源化单克隆抗体,可以组织HER2 的传导,抑制肿瘤细胞生长[3]。吉西他滨属于1 种细胞周期特异性药物,可以降低核苷酸还原酶含量,减少脱氧核糖苷酸产生,加快肿瘤细胞死亡。紫杉醇是常见的抗肿瘤药物,属于1 种抗微管类药物,主要应用于联合治疗中。本研究观察在老年乳腺癌人表皮生长因子受体2(HER2)阳性伴肺转移患者中应用曲妥珠单抗、吉西他滨、紫杉醇联合治疗的效果,为治疗乳腺癌提供有效方法。
1 资料与方法
1.1 一般资料 选择2009年1月—2019年12月期间在青岛市中心医院治疗的200 例老年女性乳腺癌HER2 阳性伴肺转移的患者,根据数字随机表法随机分为观察组和对照组,每组100 例。观察组年龄为60~71 岁,平均年龄为(65.9±2.6)岁;TNM 分期:66 例为Ⅱ期,34 例为Ⅲ期。对照组年龄为61~72 岁,平均年龄为(66.2±2.5)岁;TNM 分期:64 例为Ⅱ期,36 例为Ⅲ期。2 组患者年龄和TNM 分期差异均无统计学意义(>0.05)。本研究得到青岛市中心医院医学伦理委员会审批通过。
1.2 纳入和排除标准 纳入标准:(1)年龄≥60 岁;(2)经影像学和病理组织学检查确诊为乳腺癌伴肺转移;(3)经免疫组化和病理检查证实HER2 阳性;(4)卡氏评分70 分以上;(5)美国东部肿瘤协作组(ECOG)评分2 分及以下;(6)签署本研究知情同意书。符合上述全部项目的患者纳入本研究。排除标准:(1)存在严重心、肝、肾器官功能障碍;(2)治疗前接受相关放疗和化疗;(3)合并其他恶性肿瘤;(4)严重感染性疾病;(5)对本研究药物过敏;(6)左室射血分数60%以下;(7)预计生存时间少于6 个月;(8)伴有精神异常;(9)不配合治疗中途退出者。符合上述任意1 项的患者不纳入本研究。
1.3 治疗方法 对照组采取曲妥珠单抗(国药准字:J20160033;生产厂家:上海罗氏制药有限公司)和吉西他滨(国药准字:H20030104;生产厂家:江苏豪森药业集团有限公司)联合治疗,将5%的葡萄糖溶液(国药准字:H51020636;生产厂家:四川科伦药业股份有限公司)或者生理盐水(国药准字:H20103632;生产厂家:山东华鲁制药有限公司)与吉西他滨进行稀释,在治疗第1 天和第8 天静脉滴注1 h,剂量为1 000 mg/m2,每3 周为1 个周期,连续治疗6 个周期。静脉滴注曲妥珠单抗,每周1 次,第1 周剂量为4 mg/kg,然后每周剂量调整为2 mg/kg,每3 周为1 个周期,连续治疗6 个周期。观察组采取曲妥珠单抗、吉西他滨和紫杉醇(国药准字:H20043598;生产厂家:桂林辉昂生化药业有限责任公司)联合治疗,其中妥珠单抗、吉西他滨的用法用量与对照组一致。将175 mg/m2的紫杉醇和5%葡萄糖溶液或者0.9%生理盐水进行稀释,稀释液浓度保持在0.3 至1.2 mg/mL,然后静脉滴注。每3 周为1 个周期,连续治疗6 个周期。
1.4 观察指标与方法
(1)血清肿瘤标志物和免疫功能检测:在第1 次化疗前和最后1 次化疗结束后抽取患者空腹外周静脉血3 mL,通过3 000 r/min 离心10 min,分离血清,置入冰箱保存待测。通过酶联免疫吸附法[4]检测血清肿瘤标志物指标,包括糖蛋白153(CA153)、癌胚抗原(CEA)、多肽特异性抗原(TPS)和糖蛋白125(CA125)。试剂盒购自美国罗氏公司,严格按照试剂盒说明书进行操作。通过购自美国赛默飞公司的流式细胞仪和配套试剂盒检测免疫功能指标,包括T 淋巴细胞亚群(CD3+、CD4+、CD8+)和自然杀伤细胞(NK)。
(2)疗效评价:根据WHO 制定的实体瘤疗效评价标准[5]评价治疗效果。进展(PD):治疗后CT 检查显示,最大的肿瘤直径增加20%以上或出现新病灶;稳定(SD):治疗后CT 检查显示,最大的肿瘤直径减少30%以下或增加20%以下;部分缓解(PR):治疗后CT 检查显示,最大的肿瘤直径减少30%以上;完全缓解(CR):治疗后CT 检查显示,最大的肿瘤病灶消失。客观缓解率=(CR 例数+PR 例数)/总病例数×100%;临床收益率=(CR 例数+PR 例数+SD例数)/总病例数×100%。(3)不良反应:统计患者治疗期间不良反应情况,包括肝损伤(外周血嗜酸性粒细胞≥6%、白细胞上升和淋巴母细胞转化试验阳性等);肾功能异常(肌酐清除率下降,血清肌酐≥133mol/L 和尿素氮≥7.9 mmol/L 等);骨髓抑制(白细胞<4.0×109/L、血红蛋白<110 g/L 和血小板<100×109/L 等)。
1.5 统计学分析 采用统计学软件SPSS 21.0 对数据进行分析。符合正态分布的计量资料以均数±标准差(±s)表示,采用独立样本 检验;计数资料以例数和百分率表示,采用2检验。<0.05 为差异有统计学意义。
2 结果
2.1 2 组患者治疗前后血清肿瘤标志物指标检测值比较治疗前2 组各项血清肿瘤标志物指标值差异均无统计学差异(>0.05);治疗后2 组CEA、CA125、CA153和TPS 水平均明显低于同组治疗前(<0.05),而观察组CEA、CA125、CA153 和TPS 水平均明显低于对照组(<0.05)。见表1。
2.2 2 组患者治疗前后免疫功能指标值比较 治疗前2组各项免疫功能指标值差异均无统计学意义(>0.05);治疗后2 组CD3+、CD4+、CD4+/CD8+以及NK 指标值均明显高于同组治疗前,而CD8+指标值低于同组治疗前,差异均有统计学意义(<0.05);治疗后观察组CD3+、CD4+、CD4+/CD8+以及NK 指标值高于对照组,而CD8+指标值低于对照组,差异均有统计学意义(<0.05)。见表2。
2.3 2 组患者治疗效果比较 在临床治疗客观缓解率和临床收益率上,观察组均明显高于对照组,差异均具有统计学意义(<0.05)。见表3。
2.4 2 组患者不良反应比较 在不良反应发生率上,观察组均高于对照组,差异有统计学意义(<0.05)。见表4。
3 讨论
随着社会的发展和生活方式的改变,乳腺癌患病人数逐渐增多,乳腺癌严重威胁患者的健康和生命,同时给家庭和社会带来极大经济负担。HER2 基因会分泌出细胞表面蛋白HER2,在所有乳腺癌患者中约30%的HER2 基因水平较高,HER2 蛋白呈高表达状态[6]。HER2 阳性是导致乳腺癌患者淋巴结转移、病灶过大以及组织学分级差等预后不佳的影响因素之一[7]。现阶段化疗在治疗乳腺癌中发挥了重要作用,可以在手术治疗后进行辅助治疗,或者患者无法耐受手术时起到代替手术的作用。乳腺癌患者在接受辅助化疗后,能够明显减少肿瘤灶期,增加局部乳腺癌手术的切除率[8]。近年来新辅助化疗得到广泛应用,患者在手术前接受全身化疗后能够提高的治疗癌症效果,延长患者的生存时间。
曲妥珠单抗属于人源化单克隆抗体,主要是针对HER2 受体的。曲妥珠单抗可以结合HER2 进入肿瘤细胞核,切断HER2 循环通路,防止其进入肿瘤细胞膜,促进HER2 蛋白降解,继而避免肿瘤细胞转导为恶性表型[9]。同时,曲妥珠单抗还能够在人体免疫细胞发挥作用,形成抗体依赖性细胞毒效应,加快免疫细胞的聚集并消灭肿瘤细胞。曲妥珠单抗作为新型靶向治疗药物,疗效明显,毒性较低,并且选择性较强,有效弥补了HER2 过表达的乳腺癌细胞耐受化疗和放疗,进一步提高辅助治疗效果[10]。吉西他滨是1 种抗代谢类药物,具有周期特异性,具有和阿糖胞苷相似的化学结构。吉西他滨主要在肿瘤细胞S期发挥作用,能够切断组织G1 期向S 期的进展过程,对于较多实体瘤存在显著的细胞毒效应,属于广谱抗代谢药物[11]。紫杉醇是常见的抗肿瘤药物,属于抗微管类的一种,能够加快纺锤体在管蛋白亚单位内的聚集,促进微管装配。即便在正常微管装配过程中缺少所需介质也可以发挥相应作用,最终形成无功能,稳定性较高的微管[12]。本研究显示,观察组客观缓解率和临床收益率均高于对照组。表明曲妥珠单抗、吉西他滨和紫杉醇联合治疗对老年乳腺癌HER2 阳性伴肺转移患者具有良好疗效。但本研究显示,观察组不良反应发生率高于对照组,这可能与观察组加用紫杉醇有关,进一步增加了相关毒性,同时可能与本研究均为老年患者有关,由于老年患者的机体功能出现随龄性下降,出现不良反应的风险更高。
表1 2 组患者治疗前后血清肿瘤标志物指标检测值比较(±s)

表1 2 组患者治疗前后血清肿瘤标志物指标检测值比较(±s)
注:与同组治疗前比较,△<0.05;与对照组治疗后比较,▲<0.05
组别 CEA(ng/mL)治疗前 治疗后CA125(IU/mL)治疗前 治疗后CA153(IU/mL)治疗前 治疗后TPS(IU/mL)治疗前 治疗后对照组(images/BZ_69_2006_1171_2030_1193.png=100)观察组(images/BZ_69_2006_1171_2030_1193.png=100)11.25±1.23 11.18±1.30 7.41±0.95△5.14±0.62△▲73.28±5.69 73.35±5.64 43.58±4.62△26.95±3.68△▲68.32±5.74 68.29±5.63 48.36±4.26△29.47±3.39△▲422.56±114.28 423.48±113.87 345.63±55.36△225.96±52.78△▲
表2 2 组患者治疗前后免疫功能指标值比较(±s)
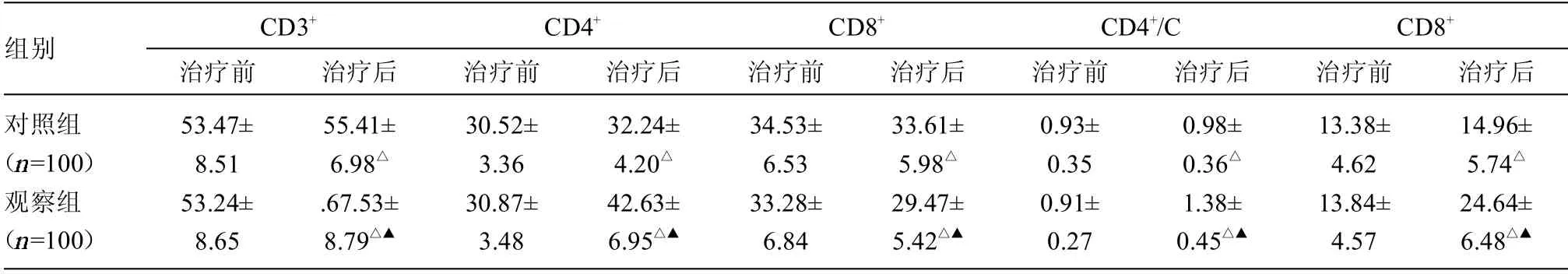
表2 2 组患者治疗前后免疫功能指标值比较(±s)
注:与同组治疗前比较,△<0.05;与对照组治疗后比较,▲<0.05
组别 CD3+治疗前 治疗后CD4+治疗前 治疗后CD8+治疗前 治疗后CD4+/C治疗前 治疗后CD8+治疗前 治疗后对照组(images/BZ_69_2006_1171_2030_1193.png=100)观察组(images/BZ_69_2006_1171_2030_1193.png=100)53.47±8.51 53.24±8.65 55.41±6.98△.67.53±8.79△▲30.52±3.36 30.87±3.48 32.24±4.20△42.63±6.95△▲34.53±6.53 33.28±6.84 33.61±5.98△29.47±5.42△▲0.93±0.35 0.91±0.27 0.98±0.36△1.38±0.45△▲13.38±4.62 13.84±4.57 14.96±5.74△24.64±6.48△▲

表3 2 组患者治疗效果比较[例(%)]

表4 2 组患者不良反应发生比较[例(%)]
肿瘤细胞异常所产生的物质就是肿瘤标志物,在健康人体中水平呈低表达,肿瘤标志物的表达水平和疾病发展和预后密切相关。CEA 在胃、乳腺和肺等肿瘤细胞中广泛表达,CA125 是反映卵巢癌的标志物之一,具有较高的特异性。在约44%的乳腺癌和部分卵巢癌患者中,CA153 水平呈高表达状态。TPS 是反映肿瘤生物学行为的有常见标志物之一,在肿瘤细胞快速增长时期呈高表达状态。本研究显示,观察组治疗后CEA、CA125、CA153 和TPS 水平均低于对照组,表明曲妥珠单抗、吉西他滨和紫杉醇联合治疗可有效抑制肿瘤标志物分泌,减少肿瘤生长。人体的免疫功能状态与肿瘤细胞的发生和转移存在密切联系,由于免疫功能具有明显的抗肿瘤及抗感染效应,因此临床也将免疫功能指标作为评价治疗效果的关键指标。细胞免疫在机体发挥抗肿瘤作用的主要是T淋巴细胞介导的,因此外周血T 淋巴细胞亚群水平能够良好反映机体免疫状态。免疫抑制在乳腺癌患者比较常见,其免疫功能比健康人群大幅降低,外周血T 淋巴细胞亚群中CD3+、CD4+、CD4+/CD8+显著表达于健康人群,NK 细胞呈低表达,而CD8+明显上升。本研究结果显示,观察组治疗后CD3+、CD4+、CD4+/CD8+及NK 水平高于对照组,CD8+低于对照组,体现了曲妥珠单抗、吉西他滨和紫杉醇联合治疗有利于改善患者免疫功能,减轻免疫抑制,对抑制肿瘤细胞生长具有积极作用。
综上所述,曲妥珠单抗、吉西他滨和紫杉醇联合治疗老年乳腺癌HER2 阳性伴肺转移患者,有利于改善机体免疫功能,促进肿瘤标志物水平的下降,具有良好的治疗效果。本次研究的特色在于分析了曲妥珠单抗、吉西他滨、紫杉醇联合疗法对老年乳腺癌HER2阳性伴肺转移患者免疫功能和血清肿瘤标志物的影响。但不足之处是观察的样本量有限,且缺乏远疗效观察,后续研究中应扩大样本量,延长观察病例的时间,完善本研究,为临床广泛应用曲妥珠单抗、吉西他滨和紫杉醇联合治疗老年乳腺癌HER2 阳性伴肺转移提供依据。

