低分子肝素对实验兔PICC相关性血栓抑制作用的研究
黄利全梁淑霞陈 黎陈桂园胡 波褚晓峰
(1.金华职业技术学院,浙江金华 321017; 2.金华市中心医院,浙江 金华 321000;3.金华市人民医院,浙江金华3210002; 4.浙江省医学科学院,杭州 310013)
PICC(经外周穿刺中心静脉置管术)在临床应用广泛,尤其是输注刺激性药物,如化疗药物,可有效避免药物对外周静脉的刺激,预防相关并发症的发生[1-2]。但随着留置时间的延长,其血栓发生的概率在递升,即PICC 相关性血栓(catheter-related thrombosis,CRT)。所谓 CRT 是指 PICC 置管后由于穿刺或导管直接损伤血管内膜以及自身状态等多因素作用使PICC 所在血管内壁及导管附壁形成血凝块的过程[3]。CRT 是PICC 患者最常见也是最严重的并发症之一,文献[4-6]报道,有症状的CRT 发生率为2.0%~19.5%,无症状的发生率为25.2%~66.0%,甚至高达75.0%[7]。因导管留置体内,无法在临床患者身上实时检测并确定血栓形成,导致目前对CRT 的研究多为回顾性研究,许多无症状血栓易被忽略,以至于一旦出现临床症状,极易导致机体重要部位栓塞而危及生命。故为能尽早预警、尽早防治CRT 的发生,本研究借助动物模拟临床患者建立PICC 实验兔模型,并于不同浓度的低分子肝素进行干预,经留置1 周后轻取PICC 留置管,截取静脉的起始端(耳缘静脉)与终末端(前腔静脉),监测血管损伤情况及导管内血栓形成情况,并抽取血标本监测凝血指标变化,观察不同浓度低分子肝素对CRT 的预防作用,为临床护理开展前瞻性研究奠定坚实基础,现报告如下。
1 材料和方法
1.1 实验动物
本课题选用普通级新西兰大白兔40 只,体重1.2~2.5 kg,雌兔 20 只,雄兔 20 只,雌兔未孕,由金华市实验动物中心提供[SCXK(浙)2017-0004],动物实验在金华市食品药品检验检测研究院[SYXK(浙)2016-0008]进行,实验经金华职业技术学院动物伦理审批(IACUC:20190173)。实验兔单笼饲养,随机编号,兔笼按编号排列。实验遵循3R 原则。
1.2 主要试剂与仪器
选用优力捷公司生产的1.9 Fr×50 cm 的单腔PICC 导管(批号:1901002);四川科伦药业股份有限公司生产的0.9%氯化钠溶液(批次:A18122701-1);江苏万邦生化医药集团有限责任公司生产的低分子肝素钠溶液(批次:41901405)。采用全自动凝血分析仪RAC-030(深圳雷杜生命科技)检测凝血3项: PT ( R01001,20181225 )、APTT ( R01101,20181226)、TT(R01201,20181206);运用武汉云克隆科技股份有限公司的ELISA 试剂盒(SEA193Ra,批次L190319150;CEA506Rb,批次 L190318750)分别检测FIB、D-D 二聚体的含量变化。
1.3 实验方法
1.3.1 分组方法
先对实验兔耳缘静脉进行编号、打印,再按随机数字表法将其分为对照组(A 组)、低浓度低分子肝素组(B 组)、中浓度低分子肝素组(C 组)、高浓度低分子肝素组(D 组)共四组。每组各10 只,分别用0.9%氯化钠溶液、低分子肝素钠溶液50 μ/(mL·d)、低分子肝素钠溶液 100 μ/(mL·d)、低分子肝素钠溶液200 μ/(mL·d)皮下注射,每日1 次,连续7 d。
1.3.2 建模方法
先使用15 mL 普通生理盐水润洗1.9 Fr×50 cm单腔PICC 导管内腔及外壁,另用5 mL 生理盐水再次冲洗导管去除气泡后备用。再使用3%戊巴比妥钠1 mL/kg(终浓度为30 mg/kg)对实验兔行腹腔麻醉。待麻醉成功后,测量实验兔PICC 导管插入长度。测量方法为:实验兔仰卧位,双耳直立与身体平行呈180°,从穿刺点开始至心脏搏动最明显处止,大约 21 ~26 cm。然后备皮、消毒、穿刺,送管至预定长度后检查通畅度并初步固定,并带鞘注射约0.5 mL 进口碘油后在X 光透视下确定到达前腔静脉后,采集血样1.8 mL,最后用10 mL 生理盐水冲管后封闭导管,用3 M 敷贴固定。为防兔耳导管意外拔管,外置小动物伊丽莎白圈,以不影响血液循环,不影响兔子摄食为度。
1.3.3 模型评价方法
评判成功建立PICC 动物模型的方法为一次穿刺成功,局部无损伤、渗血,X 光透视下确定导管末端无扭曲、折叠,留置在实验兔前腔静脉。
1.3.4 标本提取方法
每组每只实验兔在使用0.9%氯化钠溶液以及不同浓度低分子肝素钠溶液皮下注射1 周后,拔除PICC 留置管并用外科手术法分别在导管前、中、后部位切除三段,平均每段长约5 cm;同时截取耳缘静脉与前腔静脉,每段长约3 cm,共5 个活体标本,分别在10%甲醛中固定,四组40 只实验兔共计200 个标本。
1.3.5 血栓形成评价方法
本研究所指CRT 为置管1 周拔管时,截取的耳缘静脉、前腔静脉,以及PICC 导管在光镜下可见的血栓形成。
1.3.6 凝血功能监测方法
四组于置管时和置管后一周拔管时分别采集实验兔PICC 管内静脉血,采用全自动血凝仪检测凝血功能,监测凝血酶原时间(PT)、活化部分凝血酶时间(APTT)、凝血酶时间(TT)的含量。采用 ELISA 法检测纤维蛋白原(FIB)、D-D二聚体的含量。
1.4 统计学方法
运用SPSS 21.0 进行数据统计分析,数值采用平均数±标准差( ¯x ± s) 表示,组间比较采用ANOVA 分 析,方 差 齐 则用 LSD 检 验,否 则 用Dunnett’s T3 检验,血栓发生百分率组间比较采用卡方检验。
2 结果
2.1 各组实验兔CRT 发生率
采用0.9%氯化钠溶液和不同浓度低分子肝素钠溶液对留置PICC 的实验兔进行皮下注射,A 组血栓的发生率最高占80%,其次为B 组占48%,C组为20%,D 组无血栓形成,各组间比较结果有统计学意义,χ2值为 290.898,P<0.001。
2.2 各组实验兔不同部位CRT 发生率
2.2.1 各组实验兔留置PICC 静脉血管血栓发生率比较
截取的耳缘静脉与前腔静脉每段长约3 cm,每组20 个标本,共计80 个标本。每个标本经打蜡、包埋、切片后行HE 染色,并在光镜下观察四组实验兔CRT 发生率,A 组、B 组、C 组耳缘静脉血栓的发生率均为100%,前腔静脉无血栓发生,D 组两根静脉均无血栓形成,χ2值为60.222,P<0.001,比较有显著的统计学意义。
2.2.2 各组实验兔留置 PICC 导管血栓发生率比较
每只实验兔PICC 导管分别在前、中、后截取3段(以靠近耳缘静脉端为前段、靠近前腔静脉端为后段,导管正中端为中段),每段长约5 cm,每组30个标本,共120 个标本。每个标本经HE 染色后在光镜下观察并比较四组实验兔CRT 的发生率,具体见表1。
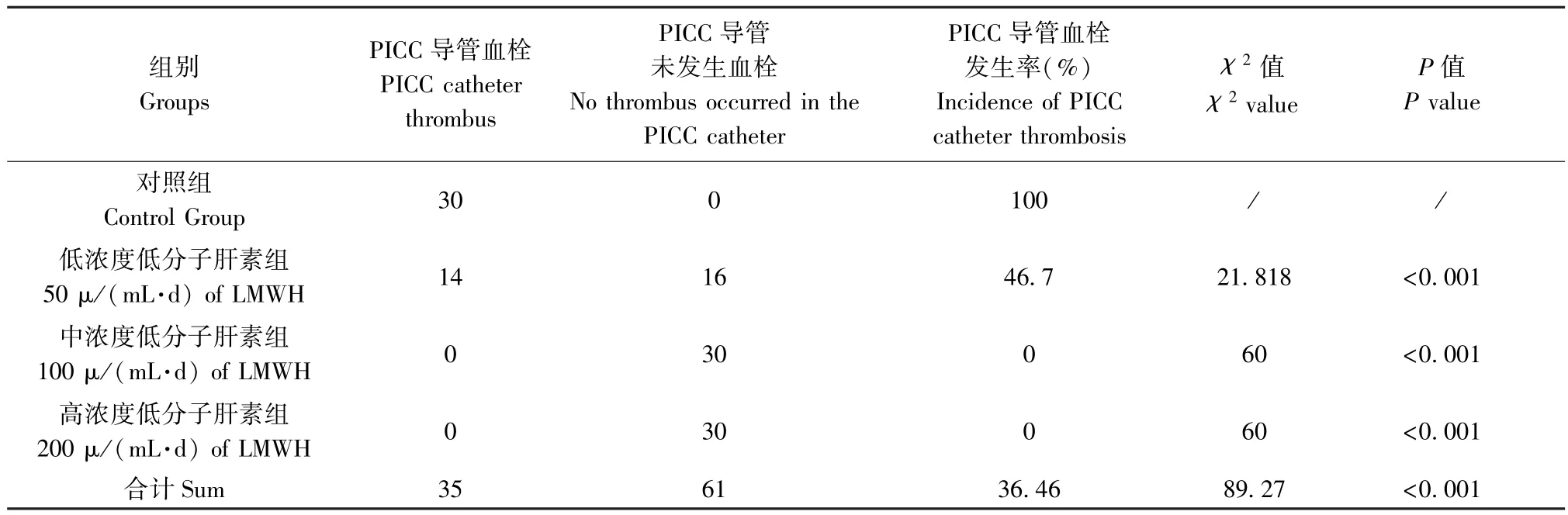
表1 各组实验兔留置PICC 导管血栓发生率比较(n=30)Table 1 Comparison of incidence of PICC catheter thrombosis in rabbits of each group
2.3 各组实验兔留置 PICC 标本 HE 染色检测结果
2.3.1 各组实验兔留置PICC 静脉血管HE 染色检测结果
对照组耳缘静脉血管内膜不规则破溃,内膜纤维性增生,瘢痕形成,管腔几乎闭塞,伴少量出血。前腔静脉血管内膜不规则破溃,管壁增厚,伴有较多的炎性细胞浸润。低浓度低分子肝素钠组中,耳缘静脉血管腔内形成瘢痕,中膜、外膜无明显病变,管腔未完全闭塞。前腔静脉血管内膜较完整,管壁略增厚,伴有少量的炎性细胞浸润。中浓度低分子肝素钠组可见耳缘静脉血管壁轻微破溃,管腔混有瘢痕和血栓,管腔未完全闭塞。前腔静脉血管内膜较完整,管壁正常,伴有少量的炎性细胞浸润。高浓度低分子肝素钠组耳缘静脉血管较完整,管腔内无明显瘢痕,无明显血栓形成,管腔通畅。前腔静脉血管内膜较完整,管壁正常,伴有少量的炎性细胞浸润,见图1、图2。
2.3.2 各组实验兔留置PICC 导管HE 染色检测结果
模型对照组中,可见导管内有血栓,充满管腔。低浓度低分子肝素钠组,导管内部分形成血栓。中、高浓度低分子肝素钠组,导管内均无血栓形成,见图3。

图1 各组实验兔PICC 留置耳缘静脉HE 染色检测结果Figure 1 Results of HE staining in PICC auricular vein vein of rabbits in each group
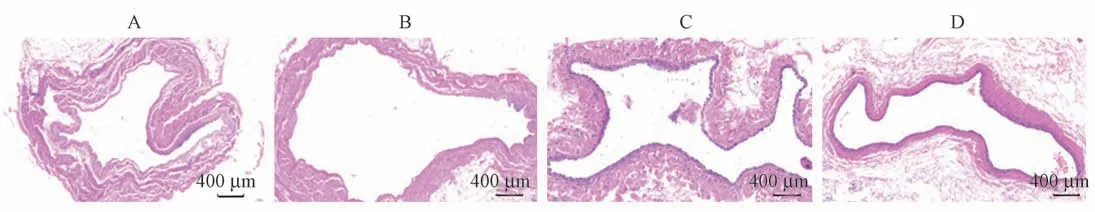
图2 各组实验兔PICC 留置前腔静脉HE 染色检测结果Figure 2 Results of HE staining in PICC anterior vena cava of rabbits in each group

图3 各组实验兔PICC 留置导管HE 染色检测结果Figure 3 HE staining results of PICC catheters in each group
2.4 各组实验兔留置PICC 凝血功能监测结果
四组实验兔置管时血清中的凝血功能指标均在正常范围,置管一周后,血 PT、APTT、TT、FIB、D-D二聚体含量,各组间比较除PT、TT 中低浓度低分子肝素组与对照组外,其余各组与对照组比较差异有统计学意义,P<0.001。见表2。

表2 各组实验兔留置PICC 凝血功能情况比较(n=10)Table 2 Comparison of indwelling PICC coagulation function in rabbits in each group
3 讨论
CRT 是PICC 置管的严重并发症,主要症状有手臂发红、肿胀或疼痛,颈、臂、胸可见静脉扩张等[8]。因临床上无症状的CRT 发生率高,待通过超声检查才发现有血栓形成,易延误诊治,而致肺栓塞、再发性深静脉血栓、血栓后综合征等并发症的发生,且病死率高,故CRT 已成为全球疾病的主要负担[9]。CRT 不仅会导致患者治疗的中断,增加住院时间和医疗费用,还会影响患者预后,从而加重社会医疗负担[10]。早期诊断及有效预防CRT 对改善患者的疗效及预后具有积极意义。
为探讨CRT 的发生率及影响因素,本研究通过建立PICC 实验兔模型,经留置1 周后活体截取实验兔留置血管及导管进行实时监测,观察血栓发生情况。结果显示,对照组实验兔CRT 的发生率为80%,这与甘晓等[11]使用大鼠建模的血栓发生率较接近。低浓度低分子肝素组占48%,中浓度低分子肝素组的血栓发生率为20%,而高浓度低分子肝素组无血栓发生,提示高浓度低分子肝素钠溶液能有效预防血栓的形成,这与艾熙等[12]的研究发现相符。由于低分子肝素钠是一种带负电荷的氨基葡萄糖类药物,具有显著的抗凝血酶作用[13],并通过发挥抗纤溶作用,与血管内皮细胞发生结合反应,起到保护作用,使抗凝作用增强[14]。值得一提的是,研究发现急性期血栓需马上使用低分子肝素钠抗凝药物治疗,单独抗凝治疗优于溶栓[15]。这从表4 研究结果可见,低分子肝素钠随着浓度递增,其抗凝作用增强。由于正常人血液中D 二聚体含量极低,一旦浓度增高,凝血、纤溶系统被双重触发,导致血液发生凝集反应,体内出现高凝状态[16],故D二聚体检测可作为预测静脉血栓的一个敏感指标。而当纤维蛋白原升高时,血液黏稠度增加,促使红细胞聚集,最终导致静脉血栓形成[17]。低分子肝素能有效改善高凝状态,维持血液的正常流动,减少血栓的发生。
进一步研究发现,三组血栓发生的部位集中在耳缘静脉与导管前段(即靠近耳缘静脉端),且均为混合性血栓。据报道[18],留置血管的静脉内径是CRT 形成的独立危险因素,由于前腔静脉属于实验兔中心静脉,血管内径较粗、管径较直,其血流量及血流速度远大于外周的耳缘静脉,故未发生CRT。耳缘静脉作为实验兔PICC 导管穿刺静脉及外周留置端,其静脉壁受穿刺性损伤,血管内皮细胞受损,内皮下胶原暴露引起血小板黏附聚集,激活凝血因子XII,损伤的内皮释放组织因子,激活凝血因子VII,启动了内、外源性凝血过程[19],导致CRT 的发生概率高于其它部位。又因该处导管内血液流通空间更窄,血流速度更慢,使得血小板进入边流,极大增加了与内膜接触的机会及黏附内膜的可能性,易于导管内血栓的形成,故靠近耳缘静脉的导管前段血栓形成高。可见,如使用较大血管如颈静脉或许可避免血栓形成,有待深入研究。然而,各组前腔静脉血管HE 染色检测结果尽管无血栓形成,但有不同程度的炎症细胞浸润,对照组除浸润较多的炎症细胞外,尚有破溃及管壁增厚的表现,其余三组血管腔内也均存有少量炎性细胞。说明PICC 置管后对局部血管内膜的炎性反应[20]普遍存在,但引起炎症反应的程度与局部血管解剖、血流量以及药物干预等众多因素的影响而不一,这也与当前的研究[21]报道相符。随着PICC 导管留置时间的延长,炎症反应势必加重而致血栓的形成,故采取有效预防措施非常重要与必要。
综上所述,本研究显示PICC 导管留置1 周时间会导致CRT 形成,这与艾熙等经家兔右颈外静脉插入中心静脉导管形成CRT 以及甘晓等使用大鼠经中心静脉发生CRT 的时间一致。尽管使用动物不同或同为家兔但插入途径不同,但发生CRT 的时间一致,提示临床患者置管时间达1 周,如未采取干预措施必将导致CRT 的形成。研究发现,采用中浓度低分子肝素100 μ/(mL·d)可有效预防导管内血栓的形成,但不能预防静脉内血栓的形成。高浓度低分子肝素200 μ/(mL·d)可彻底预防导管内及静脉内血栓的形成。但浓度过高的肝素,可引起机体出现皮下出血等不良反应,故需加强观察,本项目无出血现象的发生,但在实际运用中,尚需考虑实际情况,如基础疾病、出凝血功能等。本项目通过模拟临床成功建立PICC 导管留置动物模型,成功截取动物血管进行CRT 的研究,并为临床抗凝药物的运用提供了有力的参考。但研究中尚未通过导管对家兔输注药物治疗,未能说明药物对CRT 的形成是否有促进作用,有待进一步研究。

