SCC、CEA在宫颈癌中的表达及意义
张 茜 吕文艳 朱 武 张 波
宫颈癌是当前女性常见的恶性肿瘤,严重威胁着广大妇女健康与生命,也是引发不孕的主要因素[1-2]。宫颈癌发病机制尚不清楚,涉及的因素包括早产、感染、性生活紊乱、吸烟、多产、性生活过早、免疫抑制及激素应用等,当前明确研究认为人类乳头瘤病毒(human papillomavirus,HPV)感染是宫颈癌的主要发病因素,其中在80%~90%以上的宫颈上皮内瘤变及宫颈癌组织中存在有发现高危型HPV感染[3-4]。现代研究表明肿瘤的发生发展由多因素、多阶段、多步骤共同参与[5],宫颈癌的早期诊断与检测有助于对宫颈病变高危人群进行普查、诊断,对病情判断与预测预后都有重要的价值[6-7]。随着分子生物学技术不断发展,通过检测肿瘤标志物来诊断恶性肿瘤与预测预后已成为了可能[8]。鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen,SCCA)、癌胚抗原(carcinoembryonic antigen,CEA)为当前应用最广泛的肿瘤标志物之一,两者在胃、结肠、子宫内膜、胰腺中呈现高表达状况,也可存在于宫颈组织中[9-10],但是对宫颈癌中的诊断价值还无相关报道。本文具体探讨了SCC、CEA在宫颈癌中的表达及意义,希望促进宫颈癌的早期检出。现总结报告如下。
1 材料与方法
1.1 研究对象
本研究通过了我院伦理委员会审查,两组入选者都签署知情同意书。
宫颈癌组:2018年1月至2019年10月选择在本院诊治的宫颈癌患者72例,纳入标准:均通过明确的影像学及病理学诊断确诊;年龄≥18周岁;入组检测前未行放疗、化疗。
对照组:同期选择在本院体检的健康人群72例作为对照组,纳入标准:平时身体素质较好,体检时未发现恶性肿瘤;年龄≥18周岁。
两组排除标准:合并严重心、脑、肾疾病或远处转移者;临床资料缺乏者;妊娠或哺乳期妇女;检查前行化疗、放疗等抗治疗者;不配合调查研究者。
宫颈癌组中年龄22~78岁,平均年龄(56.35±2.19)岁;平均体重指数(22.10±2.19)kg/m2;分化类型:高中分化48例,低分化24例;临床分期:Ⅰ期12例,Ⅱ期20例,Ⅲ期26例,Ⅳ期14例;肿瘤大小>5 cm 40例,≤5 cm 32例,平均肿瘤大小(6.39±1.22)cm;淋巴结转移:有46例,无26例。
对照组中男性42例,女性30例;年龄23~79岁,平均年龄(56.23±2.45)岁;平均体重指数(22.83±1.23)kg/m2。
两组一般资料对比无统计学意义(P>0.05)。
1.2 样本采集
采集清晨空腹状态下静脉采血3~5 ml,以3000 转/min离心10 min,取上层血清置Eppendorf 分装,-80 ℃保存备用。
1.3 检测方法
采用酶联免疫发法检测血清SCCA与CEA含量,试剂盒来自美国罗氏公司。3SCCA与CEA阳性界定值:SCCA:0~1.5 ng/ml;CEA:0~5.0 ng/ml。
1.4 统计方法
2 结果
2.1 SCCA与CEA水平对比
宫颈癌组的血清SCCA与CEA水平都显著高于对照组(P<0.05),见表1。

表1 两组血清SCCA与CEA水平对比
2.2 SCCA与CEA阳性表达对比
宫颈癌组SCCA与CEA阳性率分别为34.7%、38.9%,对照组为4.2%、6.9%,对比差异有统计学意义(P<0.05),见表2。

表2 两组SCCA与CEA阳性表达对比(例,%)
2.3 诊断价值
ROC曲线分析显示SCCA、CEA、联合检测诊断宫颈癌的敏感性、特异性都在60%~85%左右,见表3。
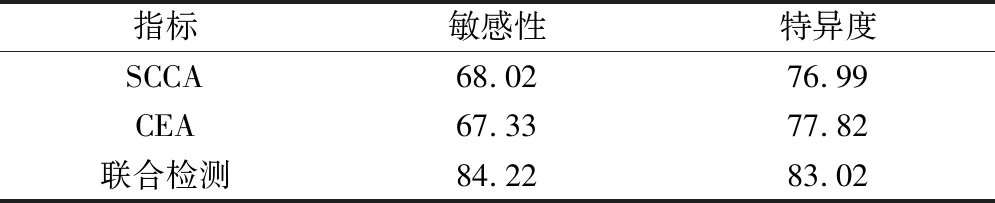
表3 SCC、CEA对宫颈癌的诊断价值/%
2.4 影响因素分析
在144例患者中,以宫颈癌作为因变量,Cox比例风险模型分析显示SCCA、CEA都为宫颈癌发生的主要独立危险因素(P<0.05),见表4。

表4 影响宫颈癌发生的影响因素
3 讨论
宫颈癌是1种世界上经常见到的妇科恶性肿瘤,随着医学技术的提高,及早发现并处理该病,不仅能够阻断疾病的进展,还可以将生殖能力保留下来,从而提高患者的预后生活质量[11]。不过当前依然有80%的宫颈癌患者在确诊时已处于中晚期,因此早期诊断是1项重要的手段[12-13]。目前临床上对于恶性肿瘤的诊断要求是特异性与灵敏性高,具有可靠的预测预后价值。肿瘤标志物具有简便、费用低等优势,并且其可在组织器官发生形态学改变之前就可在人体血液中呈现异常表达情况[14-15]。
鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen,SCCA)从子宫颈鳞状上皮中分离出来的鳞状上皮相关抗原亚单位糖蛋白,分子量为48 kD左右,可在血清中表达[16]。SCCA在正常的鳞状上皮细胞中可抑制细胞凋亡并参与鳞状上皮层的分化,不过机体癌细胞增多时,可释放更多的SCCA,也可参与肿瘤的淋巴结浸润[17-18]。CEA可广泛存在于内胚叶起源的消化系统癌,在大多数上皮来源的肿瘤中常呈高表达,是消化道肿瘤的特异肿瘤标志物[19]。本研究显示宫颈癌组的血清SCCA与CEA水平都显著高于对照组;宫颈癌组的SCCA与CEA阳性率分别为34.7%、38.9%,显著高于对照组(4.2%、6.9%),表明宫颈癌患者也伴随有SCCA与CEA的高表达。
当前宫颈癌在我国的发病人群日渐趋年轻化,与环境因素、遗传、吸烟、饮酒、饮食习惯等有关[20]。不过与其它肿瘤一样,宫颈癌的发生归因于基因一环境的相互作用,基因多态性或不同个体对环境因素作用的敏感性影响其发生与发展[21]。宫颈癌的影像学检查有一定的误差性,病理学检查也存在比较大的创伤性。SCCA在健康人血清中的含量比较低,恶性肿瘤患者的癌细胞可释放大量SCCA,且与恶性肿瘤的侵袭、转移、复发和预后有关,为此是1种特异性很好的肿瘤标志物[22-23]。CEA的表达也在机体的免疫、发育、正常生理反应中发挥重要作用,CEA的高表达可趋化肿瘤组织中的血管内皮细胞,通过促进血管形成来推进肿瘤的生长,并可诱导肿瘤转移[24-25]。ROC曲线分析显示SCCA、CEA、联合检测诊断宫颈癌的敏感性、特异性都在60%~85%左右;Cox比例风险模型分析显示SCCA、CEA都为宫颈癌发生的主要独立危险因素。特别是单个肿瘤标志物的特异度具有局限性,联合多种肿瘤标志物进行诊断具有更好的价值。不过在进行SCCA、CEA检测后,对患者的诊断还需要结合影像、临床、病理等资料进行综合判断,从而最大限度降低误诊率。
总之,SCCA、CEA在宫颈癌患者中呈现高表达状况,两者诊断宫颈癌的敏感性与特异性都比较高,且是宫颈癌发生的重要影响因素。

