TCT、HPV、SCC-Ag在宫颈癌放化疗后随访中的临床价值
陈 偲 罗喜平 涂开家 李隆玉
随着宫颈癌防癌筛查的宣传及普及,手术技术的不断精进,放疗设备的提高,以及化疗及免疫治疗的发展,宫颈癌能被早期发现并及时给予治疗,死亡率有效地降低了,但是仍有约1/3的患者在治疗后出现复发。复发往往在治疗后两年尤其是一年内,为提高生存率,早期筛查出复发患者并及时干预是关键[1]。本研究拟通过监测不同时间段HPV、TCT、SCC-Ag变化情况,分析宫颈癌放化疗后HPV转阴时间与复发的关系、TCT异常情况下如何界定是放化疗变化还是复发及SCC-Ag与宫颈癌复发的相关性,探索更合理有效的联合监测方案,早期发现复发,减少误诊所致过度及延迟治疗,为宫颈癌放化疗后随访监测提供科学合理、经济的随访方案。
1 材料与方法
1.1 一般资料
回顾江西省妇幼保健院2014年3月至2016年3月子宫颈癌患者共399例,均为接受了同步放化疗中晚期患者。患者年龄 28~76岁,平均(52.08±8.84)岁;其中Ⅱb期237例,Ⅲ期153例,Ⅳa期9例;鳞癌354例、非鳞癌45例(腺癌25例、腺鳞癌16例、神经内分泌癌2例、微偏腺癌2例)。
1.2 研究方法
1.2.1 标本采集 嘱受试者取材前禁性生活,TCT检测由杭州医国仁生物科技有限公司提供器材,严格按说明书取材,随后经过自动化的系统处理,制成薄层的涂片,显微镜下观察。HPV检测由美国 Digene 公司提供的第二代杂交捕获试验(hybridcapture,HC-Ⅱ),可对目前明确的13 种高危型 HPV DNA进行检测。SCC-Ag检测采用美国雅培公司的 IMX(全自动荧光酶标分析)检测仪,以微粒子酶免疫分析法(microparticle enzymeimmunoassay,MEIA)检测血清 SCC-Ag 滴度,以血清SCC-Ag>1.5 ng/ml为异常。
1.2.2 TBS分级标准 细胞学依据美国宫颈细胞学Bathesda报告系统(2001年)进行诊断TBS系统进行分级[2]:意义不能明确的非典型鳞状细胞(ASC-US),高级别鳞状上皮内病变不除外的非典型鳞状细胞(ASC-H),低度鳞状上皮内病变(LSIL),高度鳞状上皮内病变(HSIL),不典型腺细胞(AGC)、原位腺癌(AIS)、鳞状细胞癌(SCC)以及腺癌(AC)[3]。
1.3 随访方式
整理选取研究患者放疗后的HPV,TCT及SCC-Ag的检验结果,将三者与临床相关资料做统计分析。在随访期间出现连续2次HPV阳性(2次间隔时间3个月)、任何一次TCT结果>ASC-US、连续2次SCC-Ag阳性均进入阴道镜检查,阴道镜下宫颈表层泛白上皮、不典型血管、小结节状半透明之猪油样突起、为阴道镜异常,阴道镜异常者行宫颈活组织检查或颈管刮;另外,SCC-Ag持续性升高2次需加做影像学辅助检查,必要时增强MRI,CT及全身PET-CT等。
1.4 复发诊断标准
当怀疑中心性复发时可在直视或阴道镜下行肿瘤(多点)活检,或行宫颈管搔刮术送病理检查;当肺转移或骨转移等无法取得病理证据时以MRI、CT、或PET/CT等影像学检查为诊断标准。
宫颈癌放疗后复发指放疗结束3个月后出现盆腔或腹主动脉旁新发病灶(相同病理类型的肿瘤);而放疗后未控指3月内出现盆腔或腹主动脉旁新发病灶;转移指远处淋巴结转移及血道转移(肺,肝,骨等)。本文中复发组包括局部复发者、未控者、转移者。因本文后续研究就相关文献均提示HPV/TCT对远处转移的检测率不高,所以宫颈癌治疗后HPV病毒检出率及TCT异常细胞检查率只比较局部复发组与未复发组。
1.5 统计学处理
通过SPSS 22.0处理数据,计数资料以[例(%)]表示,行χ2检验或Fisher确切概率法,P<0.05 为差异有统计学意义。
2 结果
2.1 随访结果
399例患者中复发56例,其中20例为局部复发,36例为远处转移。本研究中宫颈癌患者随访至放化疗结束后2年或者出现复发,399例宫颈癌患者放化疗结束后0~3个月、3~6个月、6~9个月、9~12个月、12~18个月、18~24个月有随访HPV情况的患者病例数分别为394例、390例、362例、340例、230例、202例。至随访结束,各随访阶段TCT检测病例数分别为399例、383例、371例、363例、357例、349例。每个随访时间段均有检测患者SCC-Ag。
2.2 宫颈癌治疗后 HPV 病毒检出率在局部复发组与未复发组比较
在随访的各个阶段比较随访时已出现局部复发者与未复发者检测到的HPV情况比较。局部复发组在随访3~6、6~9、9~12、12~18、18~24个月均较未复发组更高(P<0.05),见表1。
2.3 在随访的各个阶段比较随访时已出现局部复发者与未复发者检测到的TCT情况比较
宫颈癌放化后0~3、3~6个月复发组与未复发组TCT异常细胞检出率差异不大,而 6~9、9~12、12~18、18~24 时间段复发组异常细胞学检出率均较未复发组高,差异有统计学意义(P<0.05),见表2。

表1 不同时间段复发组与未复发组HPV阳性检出情况/例

表2 宫颈癌放化后随访不同时间段复发组与未复发组TCT异常情况/例
2.4 2组患者SCC-Ag转阴率比较
治疗前SCC-Ag阳性率为72.43%(289/399),治疗结束后 SCC-Ag 转阴率为 53.63%(155/289)。复发组治疗前SCC-Ag阳性率89.29%(50/56);无复发组治疗前SCC-Ag阳性率69.68%(239/343),在治疗后 3 个月内阴转率差异不大(P=0.288),而其余随访时间段复发组的阴转率均低于未复发组,均有统计学差异(P<0.05),见表3。
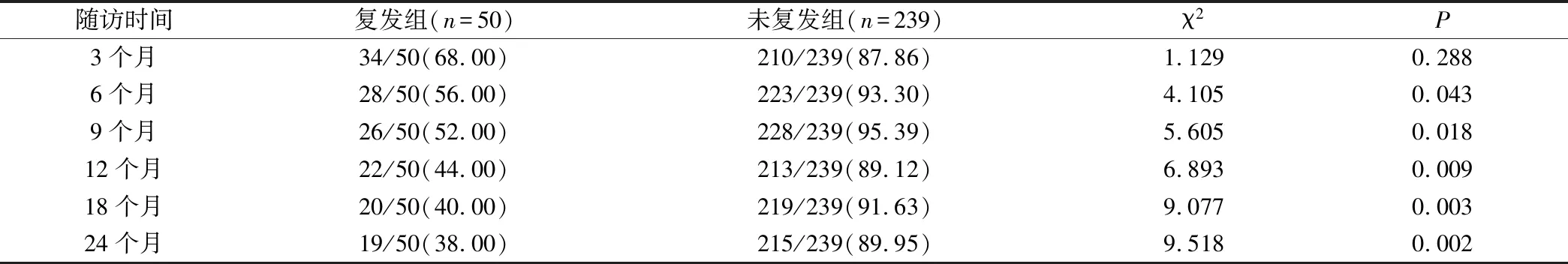
表3 复发组和未复发组治疗后转阴率(例,%)
2.5 SCC-Ag预测宫颈癌治疗后复发的最佳临界值
复发组如有SCC-Ag异常,以第1次SCC-Ag值异常的结果为准进行统计。SCC-Ag作为宫颈癌治疗后随访手段,检测未控及复发的ROC曲线下面积(AUC)为0.716[95%CI(0.623,0.809),P<0.001],最佳截断值为1.97 μg/l,灵敏度为55.4%,特异度为94.2%,Youden's指数为49.6,见图1。
2.6 3种检测方式单独与联合检测的效能
TCT、HPV、SCC-Ag、HPV+TCT、HPV+TCT+SCC-Ag 5种检测手段检测复发情况,绘制ROC曲线,曲线下面积分别为0.543[95%CI(0.469,0.618),P=0.038]、0.688[95%CI(0.615,0.761),P=0.037]、0.655[95%CI(0.580,0.729),P=0.038]、0.697[95%CI(0.627,0.767),P=0.036]、0.719[95%CI(0.654,0.784),P=0.033],见表4、图2。

图1 随访中血清SCC-Ag个值预测未控及复发的ROC曲线
2.7 各随访方案对宫颈癌放化疗后复发部位监测的价值评价
本研究20名患者出现局部复发,HPV检查及TCT检测出现异常结果的分别占95.0%、70.0%,而对于远处出现转移的患者结果异常所占比例分别只有47.2%及5.6%,均具有统计学差异(P<0.05)。另外,本研究中36例出现远处转移的患者中,SCC-Ag值高于正常者占55.4%,而局部复发者只有35.0%升高(P<0.05)。HPV、TCT二者结合对局部复发检测的灵敏度达95.0%,而对于远处出现转移的患者存在一定的漏诊率,其灵敏度度仅有 61.1%(P<0.05)。TCT、HPV、SCC-Ag三者预测对于远处及局部复发检测的灵敏度均高,分别为 86.1%、90.0%,无统计学差异(P>0.05),见表5。

表4 各随访方案对宫颈癌治疗后复发监测的价值
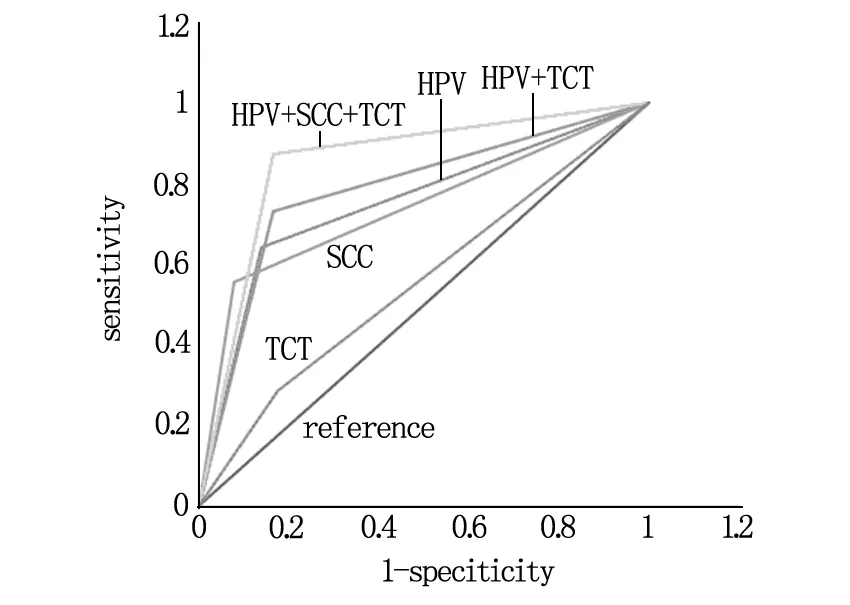
图2 各随访方案对宫颈癌治疗后检测未控及复发的ROC曲线
3 讨论
在宫颈癌治疗后随访中若能通过有效的检测手段早期发现复发,可以及时通过手术、放疗等治疗方式,提高患者生存率。虽然影像学检查对复发的检测敏感性较高,但宫颈癌的随访间隔较短,如频繁行影像学检查,费用太昂贵,不适合作为常规的随访项目。HPV、TCT检测不仅用于宫颈癌筛查,已被广泛应用于宫颈病变及宫颈癌治疗后的随访中。
本研究中宫颈癌放化疗后随访的2年内,复发组HPV检测感染者高于无复发组(P<0.05)。随访过程中无论哪个时间段HPV阳性,均应引起重视,严密随访或进一步检查。值得一提的是有一例宫颈神经内分泌小细胞癌局部复发者HPV阴性,此患者治疗前HPV亦为阴性,而复发组除此一例之外治疗前均为HPV阳性,治疗后持续性HPV阳性,宫颈神经内分泌小细胞癌可能HPV感染率低,且治疗后HPV对其病变的监测的手段有限。
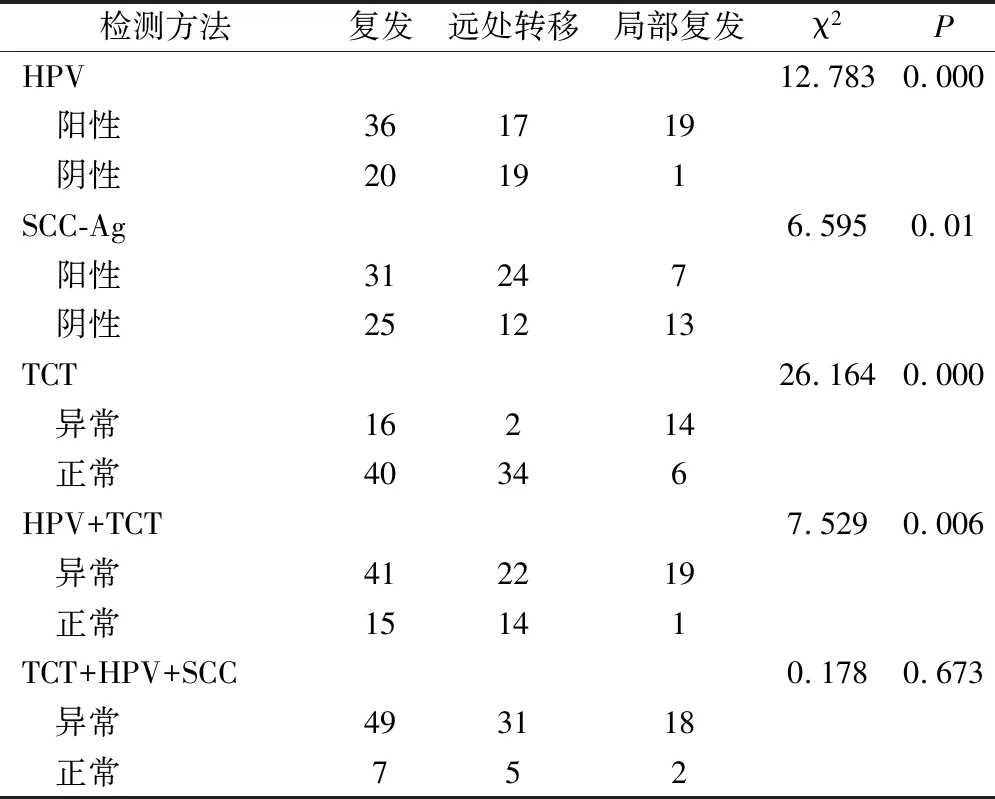
表5 各检测方法对宫颈癌治疗后复发监测的价值评价/例
本研究中,复发组0~3、3~6个月细胞学异常检出率较无复发组稍高,但无统计学差异,而在6~9个月、9~12个月、12~18个月、18~24个月复发组异常细胞学检出率均较未复发组高,差异有统计学意义,考虑可能放疗结束后6个月内宫颈上皮及阴道上皮受射线影响、炎症等易出现假阳性,而此时出现的细胞学阳性对预测复发的价值较小,可严密随访;放疗结束后6个月以上细胞开始修复,假阳性率下降,如此时细胞学提示异常,需进一步检查(阴道镜或颈管刮)。
HPV/TCT检测对于局部复发的患者准确性较高,对远处转移者难以检测到。本文研究中HPV、TCT二者结合对局部复发检测的灵敏度达95.0%,而对于远处出现转移的患者存在一定的漏诊率,其灵敏度度仅有 61.11%(P<0.05)。在免疫学、现代分子生物学不断发展的背景下,宫颈癌患者血清里面多种肿瘤标志物逐渐得以被发现。其中,SCC-Ag 为临床诊断宫颈癌相对可靠肿瘤标记物之一,已经广泛应用于宫颈磷癌早期诊断、治疗效果与预后判定、肿瘤复发转移监测中[4]。本文研究中,TCT、HPV、SCC-Ag三者检测对于远处及局部复发检测的灵敏度均高,分别为86.11%、90.0%。
本研究中,复发组的患者在放化疗后3个月SCC-Ag值下降至正常者的比例最多最高,而不是在治疗结束时,而在随后的2年内,SCC-Ag转阴率又呈现下坡趋势。分析原因考虑一方面与放疗后引起的生物学效应往往需持续一段时间,一般为3个月;在完成放化疗后半年及其后随访时间,阴转率又呈现下坡趋势,考虑可能随后有患者出现复发,导致SCC-Ag值再次上升。在完成治疗后6个月、9个月、12个月、18个月、24个月复发组与未复发组SCC-Ag转阴率有显著性差异,说明在治疗后6个月后患者SCC-Ag持续性阳性提示复发的可能性大。统计随访中SCC-Ag值,制作ROC曲线。SCC-Ag预测复发的最理想的临界值为取1.97 ng/l,1-特异度为55.4%,特异度为94.2%,Youden's指数为49.6。
SCC-Ag已被广泛用于以鳞状细胞癌为主的相关肿瘤例如:宫颈鳞癌癌、肺鳞癌、食管癌的病情监测以及预后判断的辅助性指标[5]。SCC-Ag升高与宫颈癌的病理分级及临床分期相关性,目前意见不一,还有待进一步探讨[6-8]。然而,由于临床不同的界值,SCC-Ag值用于诊断疾病的灵敏度波动幅度较大;另外,其特异度并不理想,在肺癌、乳腺癌、天疱疮等疾病、肝肾功能不全中亦有可能出现升高[9-10],以上均导致单一随访宫颈癌治疗后血清SCC-Ag值变化情况判断治疗后病情易出现假阳性。上述分析的随访方案有其各自的优势,但仍存在相应的局限性,为了尽早检测出复发的患者,从经济、方面、有效等方面考虑设计合理、规范的随访方案。随着治疗结束时间的延长,患者需做哪些检查来评估病情,并通过相关检查初步分析患者目前状况,对患者才能利益最大化。
本文研究的宫颈癌患者放化疗后均用HPV、TCT、SCC-Ag对其进行随访,回归并分析随访治疗三者单一检测对于宫颈癌治疗的预测其复发时灵敏度均较低,而三者结合检查灵敏度最高而假阳性率是最低,提示三者结合检查较单独检查更有效,对检测宫颈癌放化疗后的未控及复发的准确性更高,以期通过影像学、病理活组织检查等手段明确诊断,以减少复发的患者的漏诊率,早期检测出复发,及时给予相应治理,以望提高宫颈癌患者放化疗后的生存率以及生活质量。

