Gd-BOPTA增强MRI在原发性肝癌诊断中的应用
胡 琼 母青林 国凤高 黄文光 王兴久
全球每年新增肝癌病例约为75万,男性患者是女性患者的2~4倍[1]。MRI因其具有的极高组织分辨率而成为原发性肝癌的常用筛查技术[2-3]。对比剂是MRI检测的常用辅助药物,其中钆贝葡胺(gadobenate dimeglumine,Gd-BOPTA)是一种肝胆特异性对比剂,经静脉注射后可被正常肝细胞少量吸收,并由胆管排出肝脏,整个过程Gd-BOPTA化学结构并无改变,其辅助成像功能极高[4]。为探讨Gd-BOPTA增强MRI在原发性肝癌诊断中的应用价值,本文选取65例原发性肝癌患者进行了如下实验。
1 资料与方法
1.1 一般资料
选取2017年1月至2019年5月在我院治疗的原发性肝癌患者65例共计78个病灶,其中男性40例,女性25例;年龄28~65岁,平均年龄(40.52±8.94)岁;病灶最大径1.00~13.50 cm,平均(5.68±2.00)cm;其中高分化病灶13个,中分化病灶48个,低分化病灶17个。纳入标准:①均经穿刺或术后病理结果确诊;②在我院行Gd-BOPTA增强MRI检查,且图像资料清晰完整;③无MRI检查禁忌证及钆对比剂过敏史者。排除标准:①检查前有肝脏有手术、栓塞、放疗等治疗;②肝功能Child-Pugh C级;③肾小球滤过率<80 ml/min;④胆道有严重梗阻。
1.2 MRI检查
选用GE 1.5T Signa HDxt 医用磁共振成像设备,嘱患者术前禁食、饮水12 h,对患者进行呼吸训练,要求患者每次呼吸的深度一致。嘱患者平卧,对膈顶至肝下2 cm处进行平扫,扫描序列:轴位T2WI FSE序列TR 6500 ms,TE 80 ms,视野380 mm×380 mm,矩阵320×192,层厚5 mm;二维快速扰相梯度回波同反相位T1WI序列 TR 190 ms,TE 2.20或4.30 ms,视野380 mm×300 mm,矩阵 256×160,层厚5 mm;半傅立叶采集单次激发快速自旋回波T2WI冠状面序列 TR 3.2 ms,TE 1.4 ms,TI 200 ms,视野380 mm×380 mm,矩阵192×256,层厚5 mm;弥散加权成像(DWI)序列TR 7825 ms,TE 65 ms,b=600 s/mm2;经右肘正中静脉进行0.2 ml/kg Gd-BOPTA注射,速率为2 ml/s,注射完毕后给予20 ml生理盐水同速率注射,以清洗输液管道,于注射后的15 s、50 s以及120 s采用抑脂LAVA轴位进行动脉期、门脉期以及延迟期扫描,并于60~120 min后进行肝胆期横断面扫描。将图像导入工作站进行处理,计算病灶对比噪声比(CNR)。
1.3 病理分级
肝癌分化程度分级参照 Edmondson-Steiner 分级法:常规包埋病理样本后,选用二甲苯进行透明,并切片镜检:Ⅰ级:癌变细胞呈高分化状态,其胞质嗜伊红色,部分可见胆汁小滴;其核质比值与正常细胞相似,且核形状规则,分裂少;细胞排列如索状,索间可见清晰血窦。Ⅱ级:癌变细胞呈中分化程度,外形轻微异化,胞质内含明显颗粒,且核质比值高于正常细胞,核染色深度不一,分裂相对较多;细胞呈腺泡排列。Ⅲ级:癌变细胞呈较差分化,核质比较明显高于正常细胞,胞质嗜苏木精,核体积较大且形状不规则,核仁较多,且分裂较多;细胞排列不规则。Ⅳ级:癌变细胞呈极差分化,胞质少,核呈浓染色情况,且核仁不规则;细胞形状也不规则,排列松散,结构不一。Ⅰ级显示为高分化肝癌,Ⅱ、Ⅲ级显示为中分化,Ⅳ级显示为低分化。
1.4 统计学处理
数据统计分析采用SPSS 19.0软件,计量资料采用均数±标准差表示,多组间比较使用方差分析,两两比较采用LSD-t检验;预测价值采用受试者工作特征(ROC)曲线分析。检验水准α=0.05。
2 结果
2.1 Gd-BOPTA增强MRI病灶检出情况
Gd-BOPTA增强MRI共检出病灶72个,检出率为92.31%,漏检率为7.69%。
2.2 不同病理分化程度病灶CNR比较
低分化病灶T1WI动脉期CNR明显低于高分化和中分化病灶(P<0.05),中分化病灶T1WI动脉期CNR明显低于高分化病灶(P<0.05);不同病理分化病灶T1WI平扫期、T1WI肝胆期、T2WI平扫期CNR比较差异无统计学意义(P>0.05)。见表1。

表1 不同病理分化程度病灶CNR比较
2.3 T1WI动脉期CNR诊断病灶分化程度的价值
T1WI动脉期CNR鉴别诊断低分化和中高分化病灶的ROC曲线面积为0.867,95%CI为0.785~0.949,P<0.05,截断值为38.92,灵敏性和特异性分别为78.70%和88.24%,见图1。
3 讨论
Gd-BOPTA是顺磁性T1加权阳性钆对比剂,可通过肾脏、肝脏进行代谢,其中经肝脏代谢的Gd-BOPTA无化学结构变化,因此Gd-BOPTA静脉注射不但可以反映肝组织血供,还可提示患者近期肝功能[5-6]。Gd-BOPTA分子式除多1个苯环外,其余与Gd-DTPA相似,这导致Gd-BOPTA与Gd-DTPA具有相似的生物效应,通过团注Gd-BOPTA来辅助MRI增强动态成像,可有效反应病灶局部血管生成及灌注状态,为临床疾病诊断提供参考[7]。Gd-BOPTA带有的苯环可增强本品的亲脂性,并导致2%~4%的Gd-BOPTA被活性健康肝细胞吸收,诱使MRI对肝实质进行持续增强[8]。Gd-BOPTA静脉注射后,肝细胞摄入的Gd-BOPTA将在用药后40~120 min与细胞内蛋白质暂时性结合,这意味着Gd-BOPTA的信号最大增幅时间在用药后40~120 min内,并且其峰值约在60 min时[9],为此本组研究选择在Gd-BOPTA用药后60 min进行横断面扫描,以获取最佳的成像。
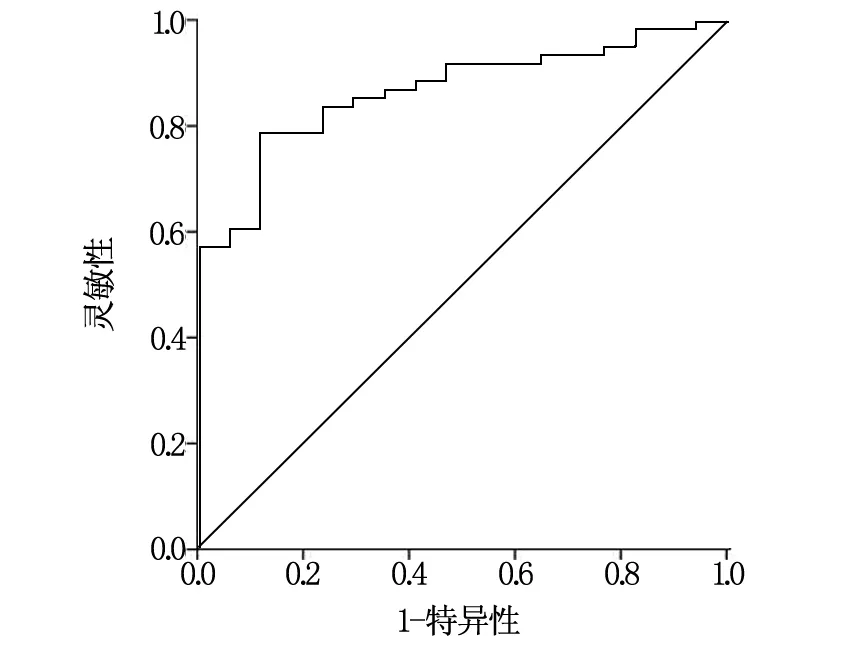
图1 ROC曲线
活性健康细胞摄入Gd-BOPTA后其肝实质信号将增强,而病灶内的肝细胞数量较少,其对比剂将被快速清除,因此病灶与健康肝脏间对比度增高,成像清晰度也随之上升。因此,多项研究表明Gd-BOPTA动态增强扫描可有效提高肝脏局灶性病变诊断精确度[10-11]。有研究发现[12],Gd-BOPTA对MRI肝胆期增强后,患者局灶性增生结节、肝硬化不典型增生结节及肝癌可被有效鉴定。本组研究中,Gd-BOPTA增强MRI共检出病灶72个,检出率为92.31%,漏检率为7.69%,提示Gd-BOPTA增强MRI是一种高效的原发性肝癌鉴定方案,这与前述结论相似。
原发性肝癌病理分化程度与患者预后及治疗方案密切相关[13]。当前主要的原发性肝癌分化程度主要通过有创性病理检测来实现,操作繁琐且患者接受度不高。而本组研究发现,低分化病灶T1WI动脉期对比噪声比(CNR)为(22.40±9.81),明显低于高分化和中分化病灶;中分化病灶T1WI动脉期CNR为(59.87±26.66),明显低于高分化病灶,表明临床或可根据Gd-BOPTA增强MRI T1WI、T1WI动脉期来鉴别诊断患者分化程度。有研究发现[14],肝癌病理分化程度越高,其MRI 动脉期CNR值越低,其机制可能与病理分化程度降低导致动脉期血供降低有关,这与本组研究结果相似。还有研究认为[15],高分化的肝癌细胞还留存一定的肝功能,并因此摄入一定量的Gd-BOPTA对比剂,导致病灶表现为等或高信号,而低分化肝癌细胞无法摄入Gd-BOPTA对比剂,并因此表现为低信号,这也可能是低分化病灶T1WI动脉期CNR低于中、高分化病灶的原因。但本组研究中,不同病理分化病灶T1WI平扫期、T1WI肝胆期、T2WI平扫期CNR比较差异无统计学意义,这可能与本组研究样本量不足有关。随后的ROC曲线结果显示,T1WI动脉期CNR鉴别低分化和中高分化病灶的ROC曲线面积为0.867,95%CI为0.785~0.949,P<0.05,截断值为38.92,灵敏性和特异性分别为78.70%和88.24%,表明Gd-BOPTA增强MRI T1WI动脉期扫描在诊断原发性肝癌分化程度中具有较高效能。
综上所述,Gd-BOPTA增强MRI可有效检出原发性肝癌病灶,并且其T1WI动脉期扫描还可提示原发性肝癌分化程度。但由于纳入的样本总数较少,研究还存在一定不足,需要随后进行大数据、大容积研究。

