骨碎补总黄酮对大鼠骨髓间充质干细胞倍增反应和分化的作用机制实验
王军松,李 佳,刘桂奇
解放军总医院第一医学中心 骨科,北京 100853
随着年龄增长,人体内各器官功能逐渐退化,骨量也逐渐减少,最终引起骨质疏松。目前骨质疏松性骨折(osteoporotic fracture,OPF)已成为危害老年人健康的常见疾病,有流行病学研究调查显示,2006年我国有将近7 000万人患有OPF,年龄大多在50岁以上[1]。OPF患者成骨能力差,骨折愈合难以达到理想状态,部分患者甚至因骨折愈合延迟而死亡,所以寻找能有效改善骨质疏松、促进骨愈合的药物十分必要[2-3]。骨碎补作为传统中药,是蕨类植物槲蕨的干燥根茎,有补肾强固、消风祛斑的功效[4]。骨碎补总黄酮(total flavonoids of rhizome drynariae,TFRD)是骨碎补的主要活性成分,近年来许多研究表明TFRD可有效提高骨质疏松症患者骨密度,促进OPF患者骨愈合,但其作用的具体分子机制尚不完全明确[5-6]。Wnt/β-catenin信号通路在骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分化为成骨细胞的过程中起重要作用[7]。本研究对BMSCs细胞进行TFRD干预,并观察TFRD对BMSCs细胞Wnt/β-catenin信号通路中相关蛋白表达的影响,初步探讨TFRD促进OPF患者骨愈合的作用机制。
材料与方法
1实验动物 SPF级SD大鼠10只,均为6月龄,平均体质量(92.14±8.53) g,购自中国科学院上海实验动物中心。
2主要仪器与试剂 倒置显微镜(Olympus公司,日本),酶标仪(Thermo公司,美国),CO2培养箱(上海力康发展有限公司),实时荧光定量PCR检测仪(ABI公司),流式细胞仪(BD FACSVERSE公司,美国),微量紫外可见光分光光度计(北京凯奥科技发展有限公司),凝胶成像仪(Bio-Rad公司,美国)。强骨胶囊 (北京岐黄医药股份有限公司,批号:20030007,规格:0.25 g;其有效成分为骨碎补总黄酮),胎牛血清(Hy-Clone公司),LDMEM培养基(Gibco公司),胰酶(Sigma公司),Trizol试剂(天根生化有限公司),反转录试剂盒(Takara公司),β-catenin、RunX2、PPARG一抗以及GAPDH一抗(优宁维生物科技有限公司),二抗(碧云天生物技术研究所)。
3BMSCs的培养和鉴定 10只SD大鼠处死后,将两侧股骨取出,采用DMEM培养液冲洗骨髓腔,调整骨髓腔冲洗液细胞密度至2×107/mL,然后接种于培养皿进行培养。24 h后更换培养基,后每2 d更换1次培养基。待细胞融合80%~90%时,采用胰酶消化传代,并继续培养。采用细胞流式法对第三代(P3)细胞表面抗原(CD29、CD44和CD45)的表达进行检测。
4实验分组 在含青链霉素、10%胎牛血清的LG-DMEM培养基中加入不同浓度的TFRD药物,根据TFRD浓度的不同分为低浓度组(TFRD 0.1mg/L)、中浓度组(TFRD1.0mg/L)、高浓度组(TFRD 10.0mg/L)。
5CCK8法检测细胞增殖 调整BMSCs细胞密度至1×104/孔,接种于已加入上述3个浓度的TFRD培养基和不含TFRD培养基的96孔板中,每组设置3个重复孔,在培养箱中分别培养3 d、5 d、7 d、9 d后取出96孔板,每孔加入CCK8试剂10µL,继续培养4 h后终止培养。采用酶标仪检测490nm波长下各孔吸光度值。
6成骨分化鉴定 将P3代BMSCs细胞浓度调整至5×104/孔后,接种于6孔板,每组设置3个重复孔,每3 d换液1次,持续培养21 d后取出6孔板,经95%乙醇固定后采用0.2%茜素红染色。在显微镜下随机选取10个视野观察矿化结节情况并计数,以平均数形式表示。
7mRNA检测 P3代BMSCs细胞培养至21 d后,采用Trizol试剂提取细胞总RNA,根据逆转录试剂盒说明书步骤进行逆转录,采用实时荧光PCR将获取到的cDNA进行扩增,计算各组2-ΔΔCT值,内参基因为β-actin。实时荧光PCR扩增条件:95℃5min,56℃30s,72℃40s,76℃ 2 s,共42个循环。各检测基因引物序列见表1。
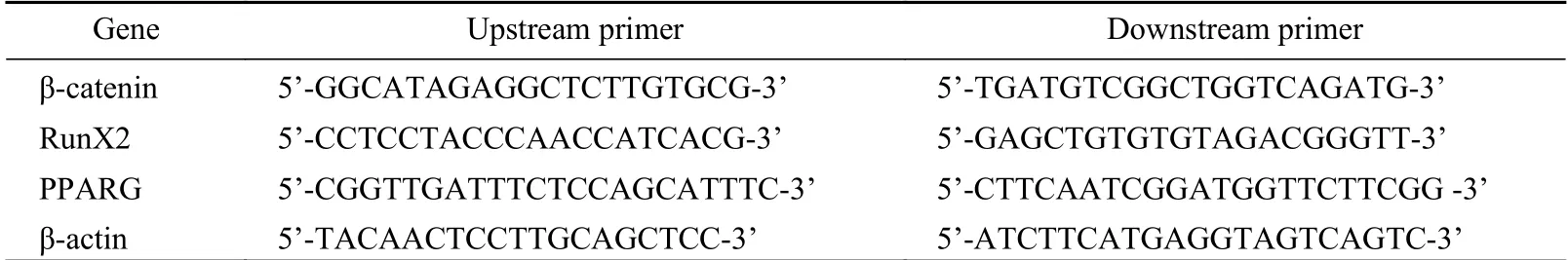
表1 各基因引物序列Tab. 1 Primer sequence of each gene
8Western blot法检测Wnt/β-catenin信号通路相关蛋白表达 提取BMSCs总蛋白后,采用BCA法进行Wnt/β-catenin信号通路相关蛋白定量。制作SDS-PAGE凝胶,每孔加入BMSCs总蛋白样品30µL进行电泳,电泳完毕后转膜,在常温下封闭2 h,加入一抗,低温孵育过夜,膜洗净后,加入二抗常温孵育1 h,膜洗净后在暗室滴加显影液显影并拍照,采用Quantityone软件分析条带灰度。
9数据分析 将数据录入Excel,应用SPSS20.0软件对数据进行统计分析。所有符合正态分布的计量资料以表示。依时间变化计量资料比较采用双因素重复测量方差分析,组间两两精细比较行LSD-t检验,时间两两精细比较行差值t检验。P<0.05为差异有统计学意义。
结 果
1BMSCs形态观察及鉴定 BMSCs接种培养24 h后贴壁生长,数量少,呈短纺锤状。3 d后,细胞数量增多,体积变大,呈多角形或梭形。7 d后,细胞开始相互融合。10d后,80%~90%细胞呈融合状态。传代接种12 h内细胞贴壁,呈纺锤形,5 d后密度达到80%以上(图1A)。P3代BMSCs细胞经流式细胞仪检测,CD29、CD44和CD45阳性细胞比例分别为78.56%、85.48%和1.29%(图1B)。

图1 大鼠BMSCs细胞形态和表面抗原鉴定A:5 d后P1细胞形态图(100×);B:流式细胞术检测P3细胞表面抗原Fig.1 Cell morphology and surface antigen identification of BMSCs in ratsA: Cell morphological image after 5 days of P1 (100×); B: Cell surface antigen of P3 by flow cytometry
2不同浓度TFRD对BMSCs增殖的影响 通过双因素重复测量方差分析显示,培养时间(P<0.01)和TFRD浓度(P<0.01)对BMSCs增殖均有显著影响,而二者之间无交互作用(P=0.27)。不同浓度的TFRD分组之间两两比较显示,中浓度组与高浓度组之间无统计学差异(P=0.31),其他各组之间均有统计学差异(P<0.01)。见图2。

图2 不同浓度TFRD对BMSCs增殖的影响(aP<0.01, vs对照组;bP<0.01, vs低浓度组)Fig.2 Effects of different concentrations of TFRD on proliferation of BMSCs (aP<0.01, vs control group; bP<0.01, vs low concentration group)
3不同浓度TFRD对BMSCs成骨分化的影响各组P3代细胞培养21 d后进行茜素红染色,低浓度组、中浓度组、高浓度组均可见边界清晰的橘红色矿化结节,对照组矿化结节则较少(图3)。统计各组矿化结节数,结果显示对照组(6.48±1.13)个、低浓度组(12.25±1.18)个、中浓度组(15.94±2.26)个、高浓度组(13.44±1.51)个,中浓度组矿化结节数高于其他三组(P<0.05)。

图3 BMSCs细胞诱导成骨分化后茜素红染色结果Fig.3 Induction of alizarin red staining after osteogenic differentiation of BMSCs cells
4TFRD对BMSCs中β-catenin、RunX2、PPARG表达的影响 中浓度组与对照组比较,β-catenin和RunX2表达明显升高,PPARG表达明显降低(P<0.05)。见表2,图4。
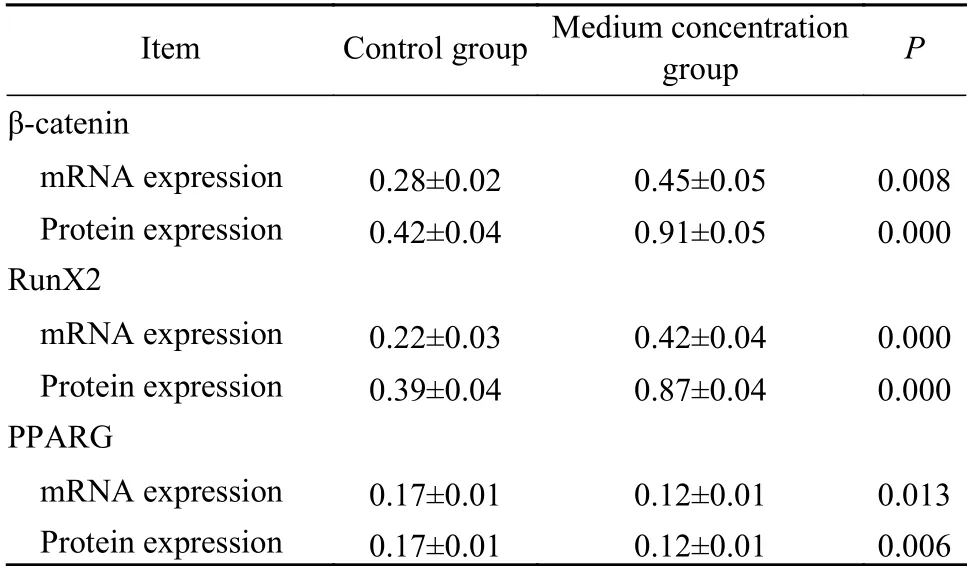
表2 TFRD对BMSCs中β-catenin、RunX2、PPARG表达的影响Tab. 2 Effect of TFRD on expression of β-catenin, RunX2 and PPARG in BMSCs
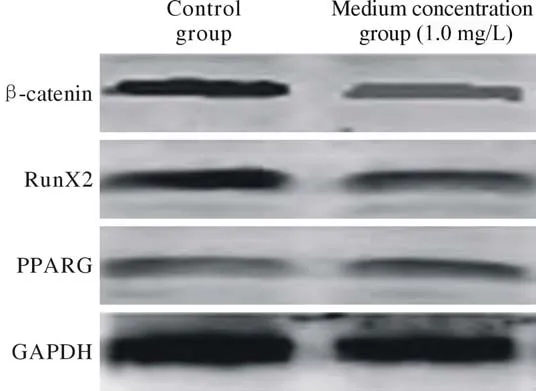
图4 两组BMSCs中各蛋白Western blot检测Fig.4 Western blot results of each protein in BMSCs of the control group and the medium concentration group
讨 论
祖国医学认为肾精的盛衰是决定骨生长发育的关键,肾精不足,则不能荣髓,髓不荣则不能生骨,故骨质疏松应以补肾壮骨为治疗原则[8]。骨碎补属于补肾壮骨类中药,其主要有效成分为TFRD,TFRD是一类二氢黄酮类化合物。现代药理研究显示,骨碎补能够有效促进骨的形成,在防治骨质疏松方面效果明显,特别是其有效活性成分总黄酮已成为研究热点[9]。临床实验证实,TFRD可提高老年骨质疏松患者血清骨钙素水平以及骨密度[10]。另有研究发现,TFRD可促进BMSCs细胞增殖,并影响成骨分化[11]。BMSCs是具有自我复制、多向分化能力的干细胞,在体外特定条件下可向成骨细胞、软骨细胞、脂肪细胞等细胞系定向分化。BMSCs成骨细胞分化能力降低、成脂分化能力增强与骨质疏松症的发生有关,而多种信号通路参与了BMSCs成骨细胞或成脂分化过程[12-14]。Wnt/β-catenin信号通路是BMSCs成骨细胞分化调控的经典路径,该通路调控机制如下:Wnt蛋白与LRP5/6和Frizzled受体结合后,激活细胞内散落蛋白,进而激活GSK-3β结合蛋白,而后者通过影响β-catenin的磷酸化以阻止其降解,使β-catenin在细胞质内不断增多,进入细胞核调控靶基因的转录与表达[15-16]。由此可见,β-catenin是Wnt/β-catenin信号通路的枢纽蛋白,在细胞增殖分化中扮演重要角色,其表达上调使BMSCs成骨细胞分化能力增强。RUNX2是成骨分化特异性转录因子,通过增强Ⅰ型胶原、骨钙素、骨桥蛋白等基因转录,达到促进成骨分化的目的[17]。PPARG是BMSCs成脂分化过程的关键因子,其通过促进骨细胞转化为脂肪细胞,使骨髓脂肪增多,骨形成减少[18]。
本研究采用CCK8法检测TFRD对SD大鼠BMSCs细胞增殖的影响,结果显示低浓度组、中浓度组、高浓度组在不同时间点吸光度值均明显高于对照组,提示TFRD可促进BMSCs细胞增殖。而中、高浓度组与低浓度组之间吸光度值也存在明显差异,而中、高浓度之间差异不明显,说明TFRD对BMSCs增殖作用存在一定的对数关系,在浓度较低时,随着TFRD浓度升高,对大鼠BMSCs增殖的促进作用会更强,当TFRD浓度达到一定浓度后,这种促增殖作用不会随浓度增加而增加。TFRD的这种作用在3 d和5 d时增殖最快,在7 d和9 d时增殖速度减慢。原因可能是细胞生长到一定密度后,生长空间受限,影响了其增殖。P3代细胞培养21 d后经茜素红染色,结果显示低浓度组、中浓度组、高浓度组矿化结节数明显多于对照组,且中浓度组矿化结节数最多。提示TFRD可促进BMSCs细胞成骨分化,且当TFRD浓度为1.0mg/L时,BMSCs细胞成骨分化能力最强,所以选择中浓度组进行后续研究。收集培养了21 d的P3代BMSCs细胞,经RT-PCR和Western blot分别检测细胞内β-catenin、RunX2、PPARG mRNA和蛋白表达,结果显示中浓度组β-catenin、RunX2 mRNA表达明显高于对照组,PPARG mRNA表达明显低于对照组,蛋白表达情况与mRNA表达情况一致。以上说明TFRD可激活Wnt/β-catenin通路,通过上调βcatenin、RunX2表达,抑制PPARG表达,减少成脂分化,促进成骨分化。
综上所述,TFRD促进OPF患者骨愈合的机制可能与上调β-catenin、RunX2表达,抑制PPARG表达有关。当然除了Wnt/β-catenin通路外,还有许多信号通路参与了BMSCs的成骨分化,TFRD是否可调节其他信号通路,还需进一步探索。

