黏液性卵巢癌诊断与治疗中国专家共识(2021年版)
中国研究型医院学会腹膜后与盆底疾病专业委员会
[内容提要]黏液性卵巢癌(mucinous ovarian cancer,MOC)是上皮性卵巢癌(epithelial ovarian carcinoma,EOC)的组织学亚型之一,占EOC 3%~5%,具有独特的临床、组织病理学和分子生物学特征,常见于中青年女性,多认为MOC 由交界性黏液性肿瘤恶变而来,典型表现为单侧卵巢巨大、单房或多房性囊肿,内充满黏液。早期MOC 预后较好,晚期MOC 对化疗不敏感,预后较差。手术是MOC 主要治疗手段,早期患者施行全面分期手术,晚期患者需要接受肿瘤细胞减灭术,力争达到无残留病灶(R0)。手术方式首选开腹手术,有生育要求的Ⅰ期MOC 可施行保留生育功能的分期手术。ⅠA~ⅠB 期患者术后可观察,ⅠC 期患者可选择化疗或观察;Ⅱ期及以上患者需辅助以铂类为基础联合化疗或参考胃肠型肿瘤化疗方案,腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)可提高缓解率。复发性MOC 的二次减瘤术存有争议。VEGF 抑制剂、EGFR单抗、抗HER2 治疗是未来探索的方向。
根据最新统计,全球每年新发卵巢癌313 959例,死亡207 252 例[1]。黏液性卵巢癌(mucinous ovarian cancer,MOC) 是上皮性卵巢癌(epithelial ovarian carcinoma,EOC)的组织学亚型之一,具有独特的临床、组织学和分子特征,患病率远低于浆液性卵巢癌(serous ovarian cancer,SOC)。MOC 诊断的难点在于不易与良性、交界性和转移性黏液癌(metastatic mucinous cancer,MMC)鉴别[2,3],这也是MOC 真实的患病率一直难以确定的根本原因。受组织病理学认识的限制,前期的研究可能高估了MOC 的患病率,文献[2~4]报道MOC 占EOC 的比例高达10%~15%。随着MOC 诊断标准的更新以及鉴别诊断水平的提高,最新数据显示MOC 的患病率约为3%[5,6]。Shimada 等[2]回顾分析1400 例EOC,对组织学分类重新核实,MOC 占比由初始的16%调整为4.9%,其余修正为黏液性上皮内瘤变、黏液性交界性肿瘤或其他部位黏液性肿瘤的卵巢转移。
MOC 的发病原因不清楚,由于发病率低,致使临床试验难以开展。近几十年来,MOC 的诊治多参考SOC 的相关指南。大多数EOC 临床试验,MOC占比不足3%。鉴于MOC 的生物学行为、分子标志物、化疗敏感性、预后与SOC 存有差异,以SOC 的相关循证依据指导MOC 的临床诊疗显然有失偏颇。为促进我国MOC 的规范化诊疗,制订小组检索国内外密切相关文献,按照推荐分级的评估、指定与评价(grading of recommendation assessment,development and evaluation,GRADE)标准评估证据质量和推荐强度(表1),兼收并蓄国际有关学术组织的学术观点,特制订本共识。

表1 GRADE 证据质量标准及推荐强度
1 临床表现
MOC 多见于20~50 岁女性,平均发病年龄低于SOC 患者[6]。80%诊断时为早期,通常表现为盆腔内巨大囊实性肿块,中位直径18 cm(5~48 cm)。包块较大者可出现尿频、尿急、排尿困难、尿潴留、排便困难及便秘等压迫症状,严重者表现为尿路梗阻及肠梗阻。晚期症状表现为下腹不适、腹胀、腹水、纳差等。
2 组织病理学特点
精确的组织病理学诊断是MOC 规范治疗的前提。既往认为黏液上皮包含3 种类型的黏液细胞,即胃型、宫颈内膜型和肠型。2014 年WHO 将宫颈内膜型的黏液性肿瘤归入浆-黏液性肿瘤,2020 年WHO 亦认为卵巢黏液性肿瘤的黏液上皮实际上仅由胃型、肠型上皮组成[7]。正常情况下,卵巢组织不含任何型别的黏液上皮细胞。目前普遍认为MOC 的发生是从良性到交界性再到恶性的连续变化过程,呈“阶梯进展模式”[5,8,9]。
MOC 大体检查多为单侧性,单房或多房的巨大囊肿,平均直径18 cm,较大者可充满盆腹腔,囊腔内充满黏液,黏液在室温下呈凝胶状[10]。显微镜下MOC 为异质性肿瘤即良性、交界性和黏液性癌共存,该病理学特征是“阶梯进展模式”的理论基础。因此,MOC 的诊断需要广泛、充分的组织取材,特别是快速病理诊断,因时间所限,难以达到充分取材,做到术中精确诊断有一定的局限性,需要临床医生与病理医师良好的沟通。
2020 年WHO 将显微镜下间质浸润灶最大径超过5 mm 者诊断为侵袭性黏液癌,不足上述标准则归类为交界性黏液性肿瘤的“微浸润”[7]。根据肿瘤的生长和侵袭模式,MOC 又分为膨胀型和浸润型两类[11]。膨胀型镜下表现为密集分布的互相融合或复杂的恶性腺体(背靠背现象),腺体之间几乎没有间质分隔。浸润型则以腺体、细胞簇或单细胞形式破坏侵犯间质,较膨胀型具有更强的侵袭性[11~13]。
80%的卵巢黏液癌为MMC,其中45%来源于胃肠道原发肿瘤,20%来源于胰腺,18%来源于子宫颈和(或)子宫内膜,8% 来源于乳腺癌[2]。MOC 与MMC 组织学特征非常相似,尤其是结直肠的卵巢转移癌,鉴别诊断有一定难度。MOC 常见多种成分及生长方式共存,如合并良性与交界性成分,膨胀型与浸润型共存,或与其他病理类型共存。MMC 促纤维增生反应明显,呈结节状或浸润性生长,在卵巢黄体或白体内可见簇状肿瘤细胞[14]。90%以上的MOC肿瘤细胞内含有大量的黏蛋白,MMC 则为细胞外黏液丰富,占肿瘤体积的50%以上[6]。
MOC 多为单侧,较MMC 肿瘤体积大(16~20 cm vs.11~12 cm)。但仅依据体积大小尚不足以诊断为原发性或转移性肿瘤,32%~48%的MMC肿瘤直径>10 cm[15]。Seidman 等[3]基于肿瘤大小和侧别建立鉴别MOC 和MMC 的模型:双侧肿瘤无论直径大小,90%以上为转移性;单侧肿瘤直径超过10 cm,82%为原发性;单侧肿瘤直径<10 cm,87%为转移性。由此提示,即使为单侧黏液性癌,也不能排除MMC 的可能。诊断MMC 的其他有价值的特征还包括:双侧卵巢受累、卵巢表面受累、黏蛋白存在于细胞外、破坏性的间质浸润、结节性生长、卵巢门受累、血管受侵、印戒细胞以及广泛坏死等[14,16]。
专家共识:MOC 多为单侧卵巢肿物,以囊性成分为主,体积较大,病理学分为膨胀型和浸润型2 种类型。基于肿瘤大小和侧别的Seidman 模型某种程度上可用以鉴别MOC 与MMC,但仍需与其他病理学特征相结合。
3 免疫组化与分子学特征
CK20、CEA、CA199 与CDX2 在MOC 和MMC中均呈阳性表达。CK7 在MOC 中呈阳性表达,在结直肠MMC 则无阳性表达。MOC 的标准免疫组化特征为CK7 +,CK20 +/ -,CDX2 +/ -,PAX8 -/ +,WT1 -,ER -,PR -,SATB2 -[7]。65%的MOC 存在CK20 与CDX2 表达,一般为局灶弱阳性,在结直肠MMC 中呈弥漫强阳性。MOC 与结直肠MMC 的免疫组化鉴别见表2。
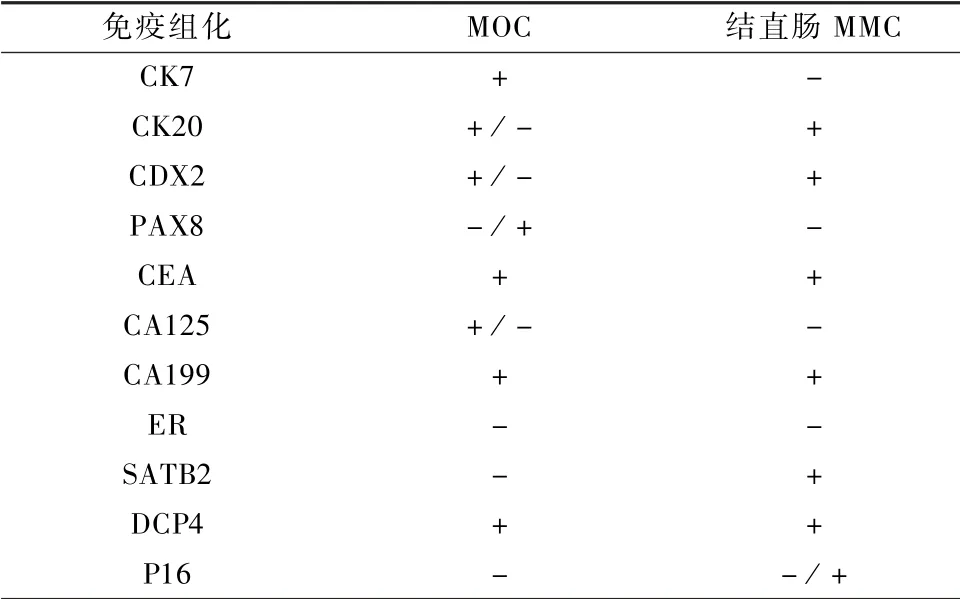
表2 MOC 与结直肠来源MMC 的免疫组化特征[17]
43.6% 和18.8% 的MOC 组织有KRAS 和HER2 突变,并且二者几乎不会共同表达。34% 的MOC 不伴KRAS 和HER2 突变,该类患者复发及死亡风险较有任一突变者升高[18]。在从良性到恶性连续变化的“阶梯进展模式”中,黏液性肿瘤中KRAS 突变常见,演变进展为MOC 时则表现为TP53和HER2 突变[19]。
专家共识:MOC 与结直肠MMC 鉴别的免疫组化标记物可以选择CK7,CK20,CDX2,PAX8,WT1,ER,PR,SATB2,其中CK7、SATB2、PAX8 最具有指导价值。
4 辅助检查
4.1 影像学检查
美国放射学院(The American College of Radiology,ACR)推荐经腹/经阴道超声作为附件包块的首选影像学检查手段[20]。MOC 的超声图像呈多种复杂的囊性肿块,肿瘤体积通常很大,多需要经腹超声多部位扫描方可明确肿块的全貌。囊肿为多房,大小不一或呈蜂窝状,囊壁较光滑。囊内液的回声根据成分的不同而有所差异,黏蛋白含量高者通常表现为低回声。囊壁破裂者,盆腹腔可见黏液回声,罕见有钙化征象[9,21,22]。
包块巨大以至于超声难以全面评估,或超声对包块内部结构难以精确判定时,建议进一步行MRI检查[9]。MRI 对包块内部结构显示更加清晰,强化后能够更好地显示囊肿壁和分隔的厚度以及内部实性成分或结节,T1 加权图像表现尤为典型[9]。囊内容物的成分不同,信号强度在T1 和T2 加权图像上有所不同[9]。黏蛋白越多,T1 加权信号越高,T2 加权信号越低[21]。
CT 不是MOC 首选的影像学检查方法[20]。CT扫描表现为大的、复杂的囊实性肿块,囊内容物密度呈多样性[9],罕见有囊内线状钙化。不规则增厚的囊壁和分隔,隔上乳头状突起,组织坏死通常提示为恶性[22]。对于晚期MOC,CT 有助于腹膜肿瘤负荷的评估;此外,CT 有助于发现回盲部占位,以排除阑尾肿瘤来源的可能。
4.2 胃肠镜检查
80%的卵巢黏液癌是MMC,最常见的原发部位来源于胃肠道[3]。胃肠镜检查对于协助MOC 的鉴别诊断至关重要,下列情况建议胃肠镜检查[8,23]:妇科检查或影像学结果等提示盆腔肿块非卵巢来源;晚期病变;CA125 (U/ml)与CEA (ng/ml)比值≤25;术后病理提示不排除胃肠道原发肿瘤。
4.3 血清肿瘤标志物
MOC 患者血清CA125、CEA 和CA19-9 通常有不同程度升高。CA125 水平较同期别SOC 低,CEA 与CA19-9 水平较原发性结直肠癌低[24]。CA19-9 在MOC 中有较高的阳性率,敏感度明显高于其他肿瘤标志物,是协助诊断MOC 较为敏感的标志物[25]。
血清CA125 (U/ml)与CEA (ng/mL)比值≤25,应进一步胃肠镜检查以排除胃肠道来源肿瘤[23]。MOC 中其他较常应用的肿瘤标志物还包括CA72-4、MMP-9、CD40L、IGF-1、MPO 和t-PA-1 等,但特异性均低于CA19-9[26]。
专家共识:MOC 的影像学评估首选超声,MRI是超声的有益补充,CT 有助于晚期MOC 腹膜肿瘤负荷的评估。CA19-9 是诊断MOC 的敏感指标,当血清CA125 (U/ml)与CEA (ng/ml)比值≤25,应进一步胃肠镜检查以排除胃肠道来源肿瘤。见图1。
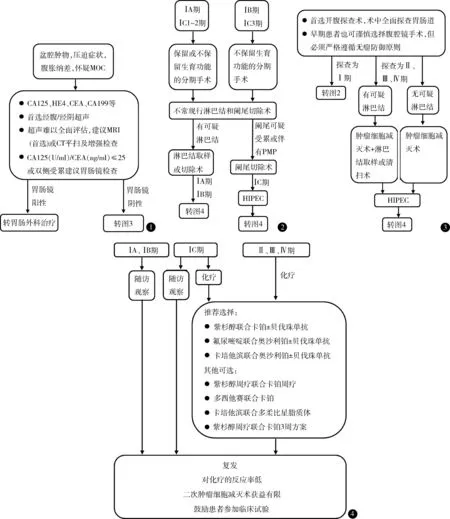
图1 可疑MOC 辅助检查 图2 早期MOC 手术治疗 图3 晚期MOC 手术治疗 图4 MOC 的辅助化疗及复发后治疗
5 分期
MOC 临床分期参照AJCC 第8 版卵巢、输卵管和原发性腹膜癌TNM 和FIGO 分期,见表3。
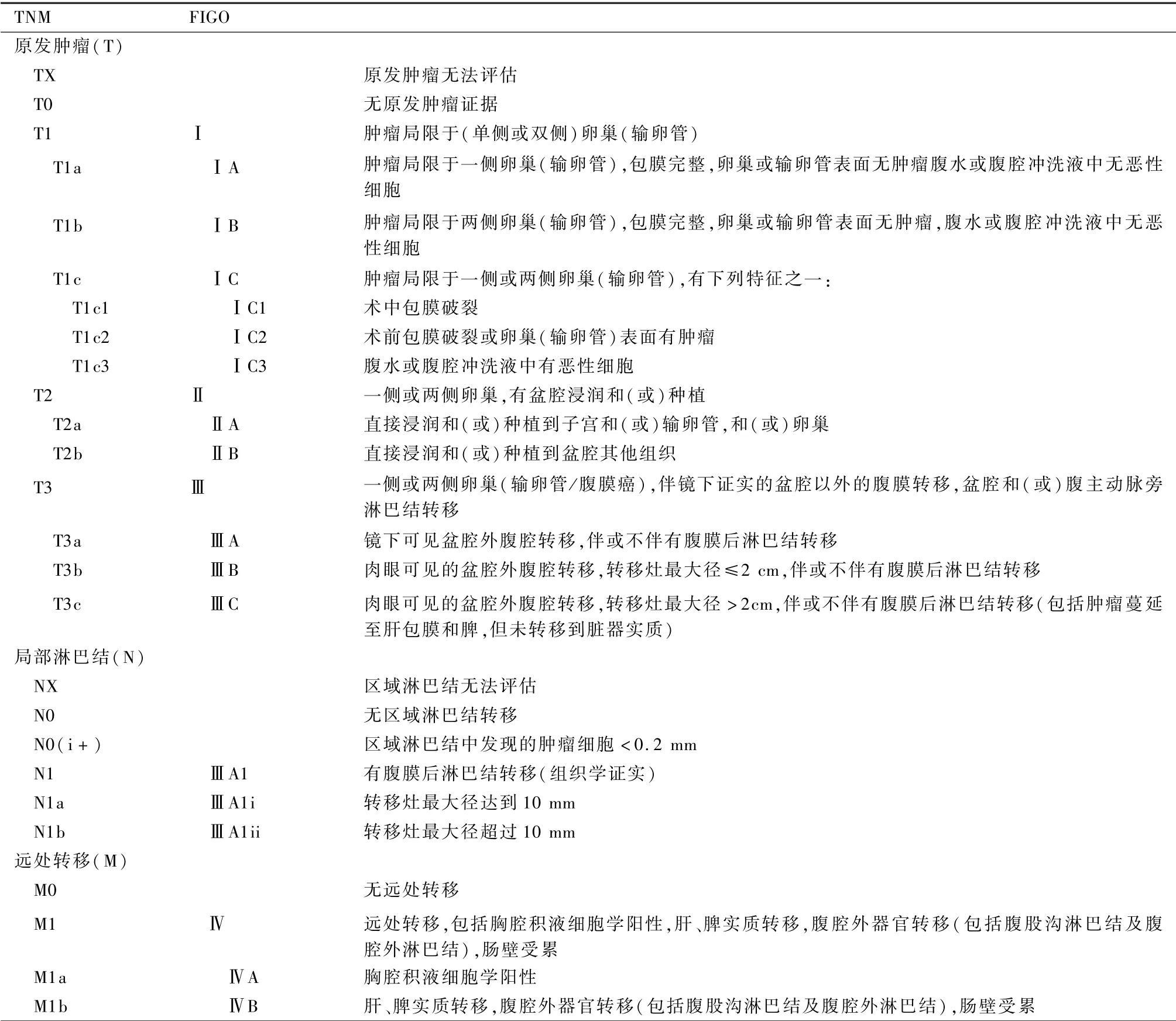
表3 AJCC 第8 版卵巢、输卵管和原发性腹膜癌TNM 和FIGO 分期
6 手术治疗
手术是MOC 的主要治疗手段,用以明确病理类型及临床-病理分期。手术治疗的总原则是早期患者接受全面分期手术,晚期患者实施肿瘤细胞减灭术。
6.1 早期患者的全面分期手术
6.1.1 手术步骤
结合病史、体格检查及有关辅助检查,当疑诊MOC 时,首选开腹探查术,开腹后进行全面探查,注意探查胃肠道(阑尾尤其重要)以排除消化道来源肿瘤。取腹水或腹腔冲洗液送细胞学检查。完整切除肿瘤,借助冰冻病理检查决定具体手术范围。
充分评估的早期患者谨慎选择腹腔镜手术,并严格遵循无瘤防御原则,完整切除肿瘤并将肿瘤置入取物袋内经穿刺孔取出(必要时扩大穿刺孔),禁忌在腹腔内或穿刺孔内碎瘤后取出,以免肿瘤污染腹腔、皮下组织和皮肤[27]。
专家共识:MOC 首选开腹探查术,术中全面探查胃肠道。早期患者也可谨慎选择腹腔镜手术,但必须严格遵循无瘤防御原则。见图2。
6.1.2 保留生育功能的手术(fertility-sparing surgery,FSS)
ESMO 与NCCN 指南均推荐对有生育要求的ⅠA期与ⅠC 期EOC 患者,可考虑实施保留生育功能手术[28]。NCCN 指南、韩国妇科肿瘤学会(Korean Society of Gynecologic Oncology,KSGO)专家共识和日本妇科肿瘤学会(Japanese Society of Gynecologic Oncology,JSGO)指南均强调FSS 需完整切除患侧附件及肿瘤,不可仅行卵巢肿瘤剥除术,同时行分期手术,以除外隐匿的更高期别病变[28,29]。JSGO 指南推荐对侧卵巢活检[29]。
Bentivegna 等[30]报道280 例MOC 保留生育功能术后的长期随访结果,其中绝大部分为ⅠA 期和ⅠC 期患者,中位随访时间186 个月。随访截止时仅19 例复发(6.8%),初步证实ⅠA 期与ⅠC 期MOC 保留生育功能手术的安全性。一系列研究回顾性比较ⅠA 和ⅠC 期MOC 患者选择行保留生育功能的分期手术与全面分期手术的生存结局,结果显示保留生育功能的分期手术与全面分期手术的患者预后及复发率均无统计学差异[31,32]。
一项回顾性研究旨在比较膨胀型与浸润型早期MOC 保留生育功能术后生存结局的差异,共纳入21例,其中12 例为膨胀型,9 例为浸润型。膨胀型组1例复发,4 例妊娠;浸润型组1 例复发,2 例妊娠。认为无论组织学亚型如何,ⅠA 期和ⅠC1~2 期MOC保留生育功能是可行的,并且肿瘤结局良好[33]。该研究未纳入ⅠC3 期MOC 患者,安全性未知,不推荐ⅠC3 期及以上的患者保留生育功能。
专家共识:有生育要求的ⅠA 期和ⅠC1~2 期MOC 可行保留生育功能的手术,肿瘤结局良好,不推荐ⅠC3 期及以上的患者保留生育功能(证据级别:低;推荐强度:弱)。保留生育功能手术需完整切除患侧附件及肿瘤,不可仅行卵巢囊肿剥除术,推荐对侧卵巢活检术(证据级别:低;推荐强度:强)。见图2。
6.1.3 系统性淋巴结切除术
系统性淋巴结切除是上皮性卵巢癌分期手术的重要组成部分。非黏液性上皮性卵巢癌淋巴结转移率为20%~30%。早期MOC 淋巴结转移率低于3%[34,35],因此,早期MOC 分期手术是否常规行系统淋巴结切除术存有争议。
一项回顾性研究纳入美国国家癌症数据库2004~2015年4379例早期MOC,其中3069(70.1%)接受淋巴结切除术[35]。ⅠA 期与ⅠC 期的淋巴结转移率分别为1.2% 和1.6%。病理学G1、G2 和G3 的淋巴结转移率分别为0.6%、1.1%和5.3%。肿瘤直径<10 cm 与>10 cm 者淋巴结转移率分别为0.9%和1.4%。一项meta 分析纳入8 项研究共155 例MOC,结果显示Ⅰ期和Ⅱ期MOC淋巴结转移率为2.6%[36]。另一项系统综述与meta 分析纳入11 项观察性研究共计278 例Ⅰ期或Ⅱ期MOC,Ⅰ期和Ⅱ期淋巴结转移风险分别为0.8%和1.2%,表明淋巴结切除术并未带来生存获益,不建议对探查为早期MOC 患者常规行淋巴结切除术[37]。
Schmeler 等[34]回顾性研究分析93 例早期MOC,其中51 例接受盆腔和腹主动脉旁淋巴结切除术,淋巴结全部阴性。切除与不切除淋巴结,2 组患者PFS 与OS 均无统计学差异。Nasioudis 等[38]对SEER 数据库中1983~2013 年肉眼评估为Ⅰ期的2855 例MOC 进行分析,1602 例(56.1%)行淋巴结切除,阳性率为1.7%,多因素分析表明,是否行淋巴切除术与肿瘤特异性死亡无关。Matsuo 等[39]回顾性分析淋巴结切除术对早期上皮性卵巢癌患者生存的影响,共纳入4066 例MOC,其中2210 例接受淋巴结切除术,结果表明淋巴结切除术并不改善早期MOC 的生存结局。Yoshihara 等[40]的多中心回顾性研究共纳入186 例MOC,其中55 例接受淋巴结切除术,结果显示切除淋巴结与否并不影响早期MOC的OS(P=0.696)和PFS(P=0.978)。上述研究未将膨胀型与浸润型这2 种病理亚型进行亚组分析。
MOC 不同组织亚型淋巴结转移率不同,一项纳入104 例的回顾性研究[13]显示,44 例肠型MOC 中,膨胀型主要为Ⅰ期(21/23),预后良好。浸润型患者Ⅰ期的比例相对较低(12/21)。Ⅰ期膨胀型患者未见淋巴结转移,但Ⅰ期浸润型患者中每10 例就有3 例存在淋巴结转移,因而认为浸润型MOC 的预后较差,与淋巴结转移有关。
专家共识:早期MOC 淋巴结转移率低,系统性淋巴结切除术不改善预后,不推荐常规系统性淋巴结切除术(证据级别:中;推荐强度:强)。浸润型MOC 预后较差,与淋巴结转移有关,初次手术时未行全面分期者,建议补充系统性淋巴结切除术(证据级别:低;推荐强度:强)。见图2。
6.1.4 阑尾切除术
Rosendahl 等[41]回顾性分析阑尾切除术在MOC手术分期中的作用。该研究从丹麦妇科癌症数据库检索269 例MOC 的临床资料,172 例接受阑尾切除手术,术后病理证实阑尾受累10 例(4%),其中2例阑尾外观正常,所有阑尾受累者均合并其他部位的转移,阑尾受累与否并不改变分期。该研究建议即使阑尾外观正常,所有疑诊MOC 的病例常规实施阑尾切除术。
Lin 等[42]回顾性分析阑尾切除术在MOC 手术治疗中的作用。共纳入309 例卵巢黏液肿瘤,155例行阑尾切除术,其中包括44 例MOC,仅1 例外观明显异常的阑尾病理证实受累,外观正常的阑尾无一例转移,该研究建议对外观异常阑尾应一并切除,外观正常者则无需常规切除阑尾。Cheng 等[43]回顾性分析64 例MOC,44 例行阑尾切除术,5 例阑尾外观明显异常病理证实受累,1 例外观正常阑尾发现镜下受累,建议必须仔细探查阑尾,但不应常规切除外观正常的阑尾。
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)患者合并黏液性腹水,腹腔内常见大量果酱样黏液性物质。组织形态学、免疫组织化学和分子遗传学研究证据表明,几乎所有的PMP 都起源于阑尾低级别黏液性肿瘤,卵巢为继发性受累[44]。罕见情况PMP 可起源于卵巢成熟性囊性畸胎瘤相关的黏液性肿瘤[44]。也有研究显示阑尾源性PMP 与卵巢源性PMP 的预后差异不大[45,46]。
专家共识:MOC 术中应仔细全面探查阑尾,外观异常者需一并切除(证据级别:中;推荐强度:强)。伴有PMP 的患者术中冰冻切片诊断为卵巢黏液性肿瘤时,需要常规行阑尾切除术,以用于手术后病理鉴别(证据级别:低;推荐强度:强)。见图2。
6.2 晚期肿瘤细胞减灭术
Ⅲ期或Ⅳ期MOC 较同期别的浆液性癌或子宫内膜样癌预后更差,与黏液性肿瘤对化疗不敏感有关[2,10,47~49]。肿瘤细胞减灭术是晚期MOC 或卵巢源性PMP 的标准外科治疗。手术入径应选择腹部正中纵行切口,手术原则是尽可能切除所有肉眼可见肿瘤,包括受累的腹膜及脏器,目标为无残留病灶(R0)。
一项纳入50 例Ⅲ或Ⅳ期MOC 回顾性研究结果显示,接受理想肿瘤细胞减灭术较未达到理想减瘤患者总体生存率提高3.8 倍(95%CI:2.07~6.1)[48]。AGO-OVAR 3、AGO-OVAR 5 和AGO-OVAR 7三项多中心、前瞻性、随机对照试验的探索性分析结果表明,晚期MOC 初次肿瘤细胞减灭术达到R0 能够显著改善PFS(P=0.0008)和OS(P=0.0031),而手术达R1 与未达R1 患者之间预后无差异[50]。另一项研究纳入474 例MOC,结果显示接受肿瘤细胞减灭术者与未行手术者5 年OS 差异有统计学意义(12% vs.8%,P<0.01),理想的肿瘤细胞减灭术与不理想者5 年OS 无统计学差异(8% vs.3%,P=0.3),该研究证实肿瘤细胞减灭术可以改善MOC 的5 年OS[51]。
晚期MOC 淋巴结切除问题目前无相关研究可以借鉴,本共识推荐参照SOC 处理原则,若术前及术中评估均未发现增大淋巴结,不推荐进行系统性淋巴结切除术。若有可疑肿大淋巴结,应进行取样或系统性切除术,尤其是达到理想肿瘤细胞减灭术者。
专家共识:晚期MOC 患者推荐进行肿瘤细胞减灭术,手术原则是尽可能切除所有肉眼可见肿瘤,目标为无残留病灶(R0)(证据级别:低;推荐强度:强)。若术前及术中评估均未发现增大淋巴结,不推荐进行系统性淋巴结切除术,若发现可疑肿大淋巴结,并已达到理想肿瘤细胞减灭术,应进行淋巴结取样或系统性切除术(证据级别:极低;推荐强度:弱)。见图3。
7 术后辅助治疗
7.1 化疗
MOC 能否从辅助化疗中获益的临床研究证据不足,目前关于手术后辅助化疗指征的共识或推荐并非基于明确的获益证据。参考NCCN 指南的建议,本共识推荐ⅠA 期或ⅠB 期MOC 手术后无需补充辅助化疗,ⅠC 期可以选择观察或辅助化疗。Ⅱ期及以上术后需辅助以铂类为基础联合化疗,化疗方案选择卡铂联合紫杉醇、奥沙利铂联合氟尿嘧啶或卡培他滨,上述化疗方案基础上可以联合贝伐珠单抗。
7.1.1 早期患者
早期EOC 辅助化疗的临床试验较多,样本量最大的临床试验为ICON1 和ACTION。ICON1 研究入组标准宽泛,凡研究者不确定患者能否从化疗中获益均可入组,ACTION 纳入少部分Ⅱa 期患者,2 项研究中Ⅰ期患者均为93%。共纳入925 例,其中MOC 180 例(20%)。合并分析显示,辅助化疗组10例复发,观察组22 例复发,2 组间无统计学差异[27]。
一项回顾性研究分析美国国家癌症数据库(NCDB)4242 例,结果表明Ⅰ期MOC(包括ⅠA、ⅠB和ⅠC)接受或不接受化疗的患者5 年OS 分别为86.8%和89.7%,无统计学差异。按分期和分级进行分层分析,结果与总体一致[52]。
专家共识:推荐ⅠA 与ⅠB 期MOC 患者术后随访观察,ⅠC 期可选择辅助化疗或随访观察(证据级别:中等;推荐强度:强)。见图4。
7.1.2 晚期患者
晚期MOC 能否从辅助化疗中获益的临床试验资料相对缺乏,治疗方案一直参考SOC。近年来,多个临床研究及meta 分析数据均显示紫杉醇联合卡铂在MOC 辅助治疗中的疗效有限。
一项病例-对照研究共纳入27 例MOC 与54例非黏液性卵巢上皮癌,结果显示MOC 对铂为基础的化疗反应率仅为26.3% (95%CI:9.2%~51.2%),中位PFS 为5.7 月(95%CI:1.9~9.6月),中位OS 为12 个月(95%CI:8~15.6 月)[10]。meta 分析显示与SOC 相比,MOC 晚期病例少,满意的肿瘤细胞减灭术比例大,其他脏器转移比例高,对紫杉醇联合卡铂方案反应率更低,PFS 和OS 更短[47]。另有研究将7 个GOG 临床试验进行meta分析,共纳入1896 例,其中MOC 34 例(1.8%),术后均接受6 周期紫杉醇联合卡铂化疗,结果显示MOC 与SOC 的中位PFS(10.5 月vs.16.9 月)和OS(14.8 月vs.45.1 月)均有显著差异[53]。
鉴于晚期MOC 手术后辅助化疗的反应率有限,有观点认为需要调整治疗的思路,即治疗应基于病理和分子标记指导的靶向治疗,并非原发灶的部位[54]。基于MOC 与胃肠道肿瘤在组织学和生物学行为上的相似性,首先对胃肠道肿瘤的传统化疗方案奥沙利铂联合氟尿嘧啶进行探索。MD Anderson和John Hopkins 2 个医学中心联合对MOC 术后接受辅助化疗的52 例进行回顾性队列研究,Ⅰ期患者占59%,26 例接受胃肠型肿瘤化疗方案(氟尿嘧啶、卡培他滨、奥沙利铂或伊立替康),26 例接受妇科肿瘤化疗方案(卡铂或顺铂,不包含前述几种化疗药物)。结果提示胃肠型方案相较于妇科方案的PFS(HR=0.4,95%CI:0.1~0.97)与OS(HR=0.2,95%CI:0.1~0.8)均有所改善[55]。GOG241 是一项国际多中心、Ⅲ期临床试验,用于比较奥沙利铂联合卡培他滨与紫杉醇联合卡铂对MOC 预后的影响,在此基础上进一步随机加用贝伐珠单抗或安慰剂,以探究贝伐珠单抗对MOC 预后的影响。但因入组缓慢,研究最终只纳入50 例,不得不提前终止临床试验。更遗憾的是,对其中40 例进行病理复核,只有45%为原发MOC,其余均为MMC[56]。
专家共识:晚期MOC 化疗方案推荐选择紫杉醇联合卡铂、氟尿嘧啶联合奥沙利铂和卡培他滨联合奥沙利铂,上述方案也可联合贝伐珠单抗。其他可选方案包括紫杉醇周疗联合卡铂周疗、多西他赛联合卡铂、卡培他滨联合多柔比星脂质体和紫杉醇周疗联合卡铂3 周方案(证据级别:低;推荐强度:弱)。见图4。
7.1.3 腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)
临床试验证实HIPEC 能够改善EOC 的预后,由于MOC 发病率较低,在MOC 中的临床证据尚显不足。一项Ⅲ期多中心随机对照试验显示,在Ⅲ期EOC 行中间型肿瘤细胞减灭术时应用HIPEC 可改善OS 和PFS,且未增加围手术期并发症发生率。该研究绝大部分纳入的为高级别SOC,MOC 只有3例[57]。2 项meta 分析证实,无论是原发或复发EOC,HIPEC 均可延长生存,改善预后[58,59]。
一项大型多中心回顾性研究纳入210 例少见卵巢来源的恶性肿瘤,其中MOC 84 例,中位随访时间43.5 月。结果显示MOC 接受肿瘤细胞减灭术后给予HIPEC,中位OS 和PFS 均超过5 年,提示HIPEC可为MOC 带来生存获益[60]。
基于以上研究,中国抗癌协会妇科恶性肿瘤腹腔热灌注化疗临床应用专家共识(2019)[61]推荐对MOC 术前或术中破裂、大量黏液溢出污染腹腔者,可以借鉴PMP 的经验,给予HIPEC 治疗,灌注液推荐使用5%葡萄糖。
专家共识:晚期MOC、术前或术中肿瘤破裂、大量黏液溢出污染腹腔、合并PMP 者推荐HIPEC(证据级别:低;推荐强度:弱)。见图4。
7.2 靶向治疗和抗血管生成药物治疗
辅助化疗在MOC 中效果有限,靶向治疗的相关研究结果值得期待。目前,关于MOC 靶向治疗的研究不多,治疗前景大多借鉴其他癌种实验数据或少数个案应用经验。
7.2.1 PARP 抑制剂与免疫检查点抑制剂 基因数据库分析MOC 的分子病理特点如下:KRAS/NRAS 突变66%,TP53 错义突变49%,ERBB2 扩增26%,RNF43 突 变 11%,ARID1A 突 变 10%,PIK3CA/PTEN 突变9%,BRAF 突变9%,ER 阳性表达率11%。同源重组修复缺陷在MOC 占比仅为0.5%,MSI-H/dMMR 占比也非常低(约0.5%)。从基因分子分型角度分析,MOC 对于抗ERBB2 治疗,抗BRAF 以及CDK4/6 抑制剂可能获益,对于PARP抑制剂以及免疫检查点抑制剂的敏感性欠佳[62]。
7.2.2 VEGF 抑制剂 VEGF 抑制剂已被证实可以改善SOC 及转移性直肠癌的预后[63],目前并无充足的证据证实贝伐珠单抗在MOC 中的作用。应用贝伐珠单抗的GOG241 因入组缓慢而提前终止。借鉴SOC 的经验,VEGF 抑制剂可用于MOC 的治疗。
7.2.3 EGFR 单克隆抗体 EGFR 高表达且KRAS野生型的转移性结直肠癌一线应用西妥昔单抗可提高客观缓解率[64]。西妥昔单抗在KRAS 野生型MOC 细胞系中有抗增殖作用[65]。EGFR 单克隆抗体可用于KRAS 野生型的MOC。
7.2.4 抗HER2 治疗 Kim 等[66]研究显示37.84%(14/46)MOC 表达HER2,组织学类型均为膨胀型。曲妥珠单抗联合化疗治疗2 例HER2 扩增的MOC,取得较为满意疗效,分别达到PR 和SD[67]。也有报道曲妥珠单抗和拉帕替尼成功治疗进展性HER2 阳性MOC 的病例[55]。
专家共识:VEGF 抑制剂可用于MOC 的治疗。KRAS 野生型的MOC 可尝试西妥昔单抗治疗。HER2阳性的MOC 可尝试曲妥珠单抗治疗(证据级别:极低;推荐强度:弱)。积极鼓励患者参加临床试验。
8 复发性MOC 的治疗
复发性MOC 预后不良。小样本回顾性分析显示,MOC 复发后5 年生存率为0%~6.9%[68]。MOC 对传统以铂类为基础联合化疗敏感性差,铂敏感复发这一概念不适宜于MOC。回顾性研究分析SOCRATES 实验的数据,探究化疗在“铂敏感复发”(无铂间期>6 个月)MOC 中的作用。该研究共纳入20 例复发MOC,与非黏液性卵巢癌相比,MOC 对二线铂类为基础的联合化疗缓解率更低(36.4%vs.62.6%,P=0.04),PFS 和OS 更短(4.5 月vs.8个月,P=0.03;17.9 月vs.28.8 月,P=0.003)[69]。Pisano 等[49]回顾性分析21 例MOC,结果复发性MOC 对二线化疗的客观缓解率仅为9.1%。Cheng等[70]回顾性分析21 例ⅡC~Ⅳ期复发性MOC,全部接受二次肿瘤细胞减灭术,其中7 例达到满意的肿瘤细胞减灭术,其余14 例为不满意的肿瘤细胞减灭术,总体中位OS 为27 个月(8~64 个月),复发后中位生存时间为10 个月(3~32 个月)。满意的肿瘤细胞减灭术与不满意肿瘤细胞减灭术患者中位生存时间无统计学差异,分别为10、9.8 月。
专家共识:复发性MOC 对化疗的反应率低,二次肿瘤细胞减灭术获益有限(证据级别:低;推荐强度:强)。鼓励患者参加临床试验。见图4。
形成本专家共识,旨在提醒国内妇科肿瘤医师重视MOC 的诊治。本共识制订过程中,专家团队虽已广泛检索文献集思广益,仍难面面俱到。本共识采用GRADE 分级标准对证据质量进行评估,结合临床实际与专家讨论给出推荐强度,在每一项专家共识后均清晰地进行标注,让共识参阅者对于推荐的强度和所依据的证据等级心中有数。由于MOC发病率低,迄今缺乏大规模的前瞻性RCT,因此,本共识的证据等级多为中、低或极低。相较于应用更加广泛的NCCN 指南和FIGO 指南,本共识单独对MOC 诊治过程中常见的问题分别进行循证检索,并给出给出推荐意见,方便临床参考与应用。本共识可与NCCN 指南和FIGO 指南互为补充,用于指导临床工作。专家共识团队希冀妇科肿瘤医师在MOC 诊治过程中,需紧密跟踪最新研究进展,综合兼顾肿瘤病情(分期、分级)和患者意愿,结合MDT的意见,以期尽量做到规范化和个体化诊治。
参与讨论专家(按姓氏笔画排序):马瑞卿(航天中心医院);王玉东(上海交通大学医学院附属国际和平妇幼保健院);王世军(首都医科大学附属北京宣武医院);王冬(重庆市肿瘤医院);王永军(北京大学国际医院);王刚(四川省妇幼保健院);王武亮(郑州大学第二附属医院);王建六(北京大学人民医院);王建东(首都医科大学附属北京妇产医院);王莉(河南省肿瘤医院);王淑珍(首都医科大学附属北京朝阳医院);王静(湖南省肿瘤医院);孔为民(首都医科大学附属北京妇产医院);卢一艳(航天中心医院);田小飞(陕西省肿瘤医院);付凤仙(航天中心医院);朱根海(海南省人民医院);向阳(中国医学科学院北京协和医院);刘淑娟(空军军医大学西京医院);孙阳(福建省肿瘤医院);阳志军(广西医科大学附属肿瘤医院);李庆水(山东第一医科大学附属肿瘤医院);李俊东(中山大学附属肿瘤医院);李斌(中国医学科学院肿瘤医院);杨英捷(贵州省肿瘤医院);吴强(江苏省肿瘤医院);张师前(山东大学齐鲁医院);张颐(中国医科大学第一附属医院);张德普(山东第一医科大学附属肿瘤医院);陈佩芳(福建医科大学附属协和医院);范江涛(广西医科大学第一附属医院);罗成华(北京大学国际医院);胡元晶(天津市中心妇产科医院);娄阁(黑龙江省肿瘤医院);高春英(吉林省肿瘤医院);黄奕(湖北省肿瘤医院);曾庆东(辽宁省肿瘤医院);蔡红兵(武汉大学中南医院);熊光武(北京大学国际医院)

