PAX9基因在肺鳞状细胞癌中的表达及其临床意义▲
黄浩 石硕 王永勇 谭翔 戴磊 梁冠标 陈铭伍
广西医科大学第一附属医院心胸外科,南宁市 530021
肺癌是世界上发病率和死亡率极高的癌症[1],其中肺鳞状细胞癌(lung squamous cell carcinoma, LUSC)是一种常见的非小细胞肺癌亚型,占所有肺癌的25%~30%[2]。LUSC与吸烟密切相关,癌细胞中的靶向驱动基因频率可能较低,具有高度的异质性,目前有效的靶向药物少,给临床精确治疗带来了很大的困难。配对盒(paired box, PAX)基因是一类进化保守的基因家族,PAX基因是与生长发育调控相关的转录因子,参与多种细胞内信号转导通路的调控,在胚胎发育、组织器官形成和分化中发挥关键作用[3]。PAX9在多种肿瘤组织中异常表达,在人类口腔黏膜鳞状细胞癌和唾液腺肿瘤中高表达[4],而在食管鳞状细胞癌和黑色素瘤中低表达[5-6]。Hsu等[7]报道,PAX9参与了多种细胞信号通路如Wnt、PI3K/AKT和BMP等,并受原癌基因c-myb的调控,PAX9基因可能在LUSC的发生、发展中起重要作用。本研究就PAX9基因在LUSC中的表达情况和临床意义进行了探讨,现将结果报告如下。
1 材料与方法
1.1 数据库的采集和整理 从TCGA官方网站(https://portal.gdc.cancer.gov/)获取TCGA-LUSC数据集,数据集包括488例LUSC患者的基因测序数据和预后数据。从Gene Expression Omnibus数据库(GEO,http://www.ncbi.nlm.nih.gov/geo)获取GSE21933数据集和GSE73403数据集。GSE21933数据集包括11例成对的LUSC组织和邻近正常肺组织的测序数据,GSE73403数据集包括69例LUSC样本的临床和预后资料,用于生存分析。利用limma软件包对不同芯片的表达数据进行分位数归一化,使其达到同一水平。
1.2 LUSC患者癌组织及癌旁组织的PAX9基因表达检测 选取2019年6月至2020年11月广西医科大学收治的34例LUSC患者为研究对象,收集患者术后的LUSC组织和癌旁组织,病理学确认。患者在术前均未接受放疗、化疗、介入治疗以及靶向治疗;所有受试者签署知情同意书;研究经广西医科大学第一附属医院医学伦理委员会批准(批号为201910016)。
1.3 细胞株 人肺鳞状细胞癌细胞(NCI-H520)购自上海中乔新舟生物技术有限公司;人正常肺上皮细胞(BEAS-2B)购自上海翼和应用生物技术有限公司。两种细胞在实验前均经STR鉴定,用支原体检测试剂盒进行支原体检测。
1.4 定量实时RT-PCR(qRT-PCR) 用TRIzol法提取细胞总RNA,用PrimeScriptTM RT试剂盒(Takara)逆转录合成cDNA。使用FastStart Universal SYBR Green Master (德国默克公司)进行qRT-PCR。内参为甘油醛-3-磷酸脱氢酶(GAPDH),GAPDH扩增引物:
上游引物(F):5′-GTCAGCCGCATCTTCTTT-3′,
下游引物(R):5′-CGCCCAATACGACCAAAT-3′。
PAX9基因扩增引物:
上游引物(F):5′-AGGAAGCCAGTACGGTCAG-3′,
下游引物(R):5′-ATGTAAGGCGACCTTGGGC-3′。
引物序列由北京擎科生物技术有限公司设计和合成。
1.5 蛋白质印迹实验(Western Blot) 用RIPA裂解缓冲液(索莱宝公司)和1 mM苯甲基磺酰氟(索莱宝公司)提取细胞的总蛋白。用BCA蛋白质分析试剂盒(Beyotime Biotechnology)测定蛋白质浓度后,运用蛋白质印迹技术测定蛋白表达情况。在ChemiDoc MP凝胶成像系统(美国Bio-Rad公司)中观察所有蛋白条带。
1.6 细胞培养和转染 用含有10%胎牛血清(以色列BI生物工业公司)的DMEM培养基培养NCI-H520和BEAS-2B。PAX9 siRNA (si-PAX9)和siRNA NC(si-NC)由RiboBio (Guangzhou, China)设计合成。将50 nM si-PAX9和50 nM si-NC用于NCI-H520细胞转染,48 h后,收集转染细胞,用PCR鉴定转染效率。采用的试剂盒为 Lipofectamine 3000(美国Invitrogen公司),细胞转染步骤按照试剂盒说明书进行。
1.7 CCK-8试验 转染48 h后,分别将si-PAX9 NCI-H520和si-NC NCI-H520细胞以2×103的密度接种在96孔板中,每组设置6个重复,分别在0 h、24 h、48 h、72 h、96 h时加入10 μL CCK-8试剂(日本东仁公司)。用酶标仪检测450 nm处吸光度值。
1.8 平板克隆试验 转染48 h后,分别将si-PAX9和si-NC NCI-H520细胞以1×103的密度接种在96孔板中,每组设置3个重复并培养14 d。14 d后,用1%多聚甲醛在4℃固定菌落30 min,然后用0.1%结晶紫染液染色30 min。用ImageJ软件测量每孔克隆数。
1.9 伤口愈合试验 转染48 h后,分别将si-PAX9 NCI-H520和si-NC NCI-H520细胞种植于六孔板中,每组设置3个重复。当细胞贴壁后,用100 μL的枪头划痕。24 h后观察细胞划痕并拍照。
1.10 细胞周期测定 转染48 h后,收集si-PAX9 NCI-H520和si-NC NCI-H520细胞,PBS清洗2次,4℃、70%预冷乙醇中固定过夜。第2天,用PBS洗涤细胞,按照说明书(江苏凯基公司)使用碘化丙啶染色,在CytoFLEX流式细胞仪中检测细胞周期。用FlowJo分析CytoFLEX的结果。
1.11 统计学处理 采用SPSS 22.0统计学软件对数据进行分析。计量资料的两组间均数比较采用t检验。绘制ROC曲线,分析PAX9基因在TCGA-LUSC、GSE21933数据集中的诊断效能。将TCGA-LUSC、GSE73403数据集中的PAX基因和具有临床意义的指标用于构建列线图模型,并采用基于生存分析的算法构建LUSC总体生存评估模型。将数据集的样本分为训练组和验证组,在列线图构建完成后,将训练集和验证集分别作为内部训练数据集和外部验证数据集,评估列线图模型的性能。采用Kaplan-Meier法、log-rank检验分析比较不同PAX9表达水平LUSC患者的总体生存率。以P<0.05 为差异有统计学意义。
2 结 果
2.1 PAX9基因诊断LUSC的效能 基于TCGA-LUSC数据集,绘制ROC曲线进行分析发现,PAX9诊断LUSC的效能良好(AUC=0.900,P<0.001,见图1A);基于GSE21933数据集绘制ROC进行分析发现,PAX9诊断LUSC的效能良好(AUC=0.960,P<0.001,见图1B)。
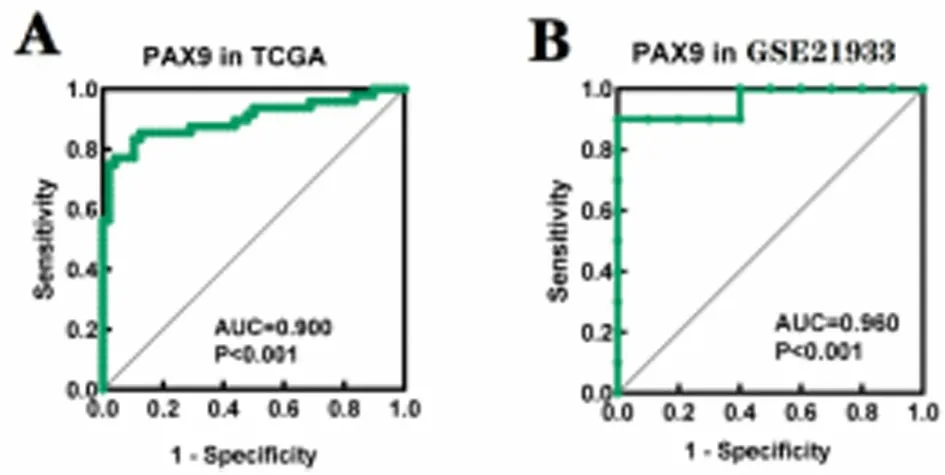
图1 基于TCGA-LUSC、GSE21933数据集的PAX9诊断LUSC的ROC曲线
2.2 建立LUSC患者预后列线图模型 建立基于TCGA-LUSC数据集的PAX9表达、吸烟和病理分期的列线图,建立LUSC患者预后的列线图模型(见图2A),进行内部验证得到C指数为0.864,利用列线图预测LUSC患者1年、3年和5年生存率的准确性和特异性较高(图2B~图2E)。
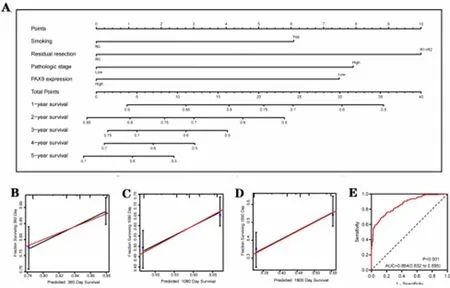
图2 基于TCGA-LUSC数据集的PAX9表达、吸烟和病理分期的列线图、内部数据验证和C索引(图2A:列线图;图2B~图2D: 1年、3年和5年生存期的内部验证数据集;图2E:列线图的C索引)
建立基于GSE73403数据集的PAX9表达、吸烟和病理分期的列线图(见图3A),进行内部验证得到C指数为0.795,利用列线图预测LUSC患者1年、3年和5年生存率的效果良好(见图3B~图3D)。

图3 基于GSE73403数据集的PAX9表达、吸烟和病理分期的列线图、内部数据验证和C索引(图3A:列线图;图3B~图3D: 1年、3年和5年生存期的内部验证数据集;图3E:列线图的C索引)
2.3 不同PAX表达水平LUSC患者的生存分析 利用TCGA-LUSC、GSE73403数据集进行生存分析发现,PAX9低表达的LUSC患者的总体生存率均显著低于PAX9高表达的LUSC患者(均P<0.05)。见图4。
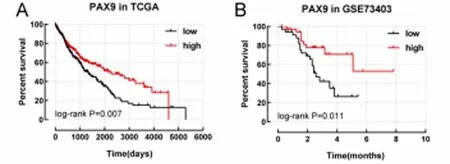
图4 基于TCGA- LUSC数据集和GSE73403数据集的LUSC患者的Kaplan-Meier生存曲线
2.4 LUSC患者癌组织及癌旁正常组织的PAX9基因表达情况 34例LUSC患者癌组织PAX9基因表达水平显著低于其癌旁正常组织(P<0.05)。见图5。
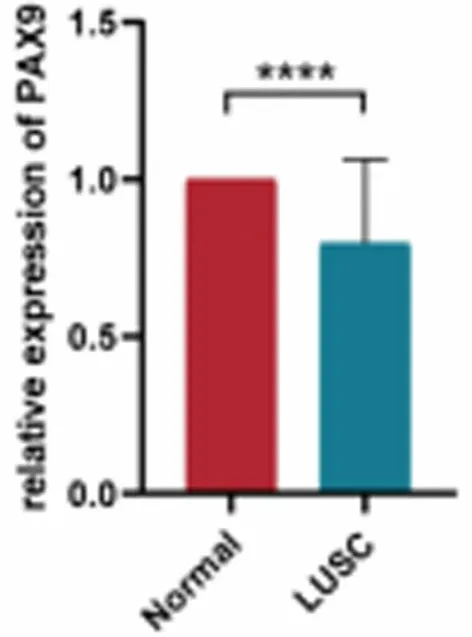
图5 LUSC患者癌组织及其癌旁正常组织的PAX9基因表达水平比较
2.5 NCI-H520、BEAS-2B细胞的PAX9蛋白、基因的表达情况 NCI-H520 PAX9的蛋白、基因表达水平均显著低于BEAS-2B(P<0.05)的表达水平。见图6。

图6 NCI-H520、BEAS-2B细胞的PAX9蛋白、基因的表达情况
2.6 PAX9基因敲除对NCI-H520细胞活力的影响 PAX9基因敲除试验结果显示,培养96 h后的si-PAX9转染组NCI-H520细胞的活力显著高于si-NC对照组和空白组NCI-H520细胞活的力(P<0.05)。见图7。
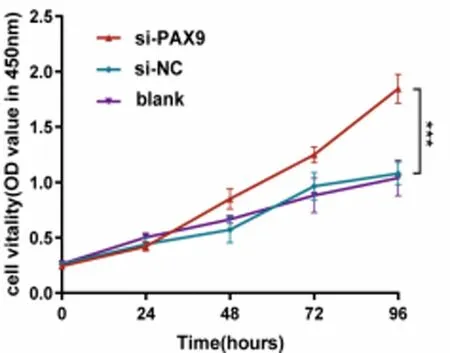
图7 si-PAX9、si-NC和空白组NCI-H520细胞的活力比较
2.7 平板克隆试验、伤口愈合试验及细胞周期测定 平板克隆试验结果提示,si-PAX9转染组NCI-H520细胞的克隆数显著多于si-NC转染组(P<0.05,见图8A)。伤口愈合试验结果提示,si-PAX9转染组NCI-H520细胞的愈合速度显著快于si-NC转染组(P<0.05,见图8B)。流式细胞术检测结果显示,与si-NC转染组、空白组比较,si-PAX9转染组NCI-H520细胞处于S期的细胞明显减少,处于G2期的细胞明显增加(见图8C)。

图8 si-PAX9转染组、si-NC转染组和空白组NCI-H520细胞的克隆情况、细胞损伤情况和细胞周期比较
3 讨 论
肺鳞状细胞癌(LUSC)患者起病隐匿,被诊时往往已经处于癌症中晚期,预后差,生存率较低。在靶向治疗中,由于LUSC的EGFR突变和ALK基因的重排发生率低[8],因此只有少数LUSC患者可以采用EGFR和ALK抑制剂进行治疗,并且有效率不高,疗效局限[9]。寻找LUSC相关的新靶点,提高LUSC患者的诊断和靶向治疗效率,才能提高LUSC患者的总体生存率。
研究[10-15]发现,PAX9是参与细胞分化和组织发育的一个转录调节因子,在食管鳞状细胞癌、口腔鳞状细胞癌和头颈部鳞状细胞癌等鳞癌组织中异常表达,miRNA-31可以通过调节下游靶点PAX9来影响肺癌的发生,认为PAX9基因可能在LUSC的发生、发展中起重要作用。
为探讨PAX9基因在LUSC中的表达情况和临床意义,本研究通过TCGA官方网站获取TCGA-LUSC数据集,从Gene Expression Omnibus数据库获取GSE21933数据集和GSE73403数据集,同时选取34例LUSC患者为研究对象对其癌组织及癌旁组织的PAX9基因表达情况进行了检测分析等研究。结果显示,基于TCGA-LUSC及GSE21933数据集绘制ROC曲线进行分析发现,PAX9诊断LUSC的效能良好(AUC=0.900;AUC=0.960)。建立基于TCGA-LUSC数据集的PAX9表达、吸烟和病理分期的列线图,建立基于GSE73403数据集的PAX9表达、吸烟和病理分期的列线图,建立LUSC患者预后的列线图模型进行分析发现,利用列线图预测LUSC患者1年、3年和5年生存率的效果良好。利用TCGA-LUSC、GSE73403数据集进行生存分析发现,PAX9低表达的LUSC患者的总体生存率均显著低于PAX9高表达的LUSC患者。蛋白、基因表达的检测结果显示,LUSC患者癌组织PAX9的基因表达水平显著低于其癌旁正常组织;人肺鳞状细胞癌细胞(NCI-H520)PAX9的蛋白、基因表达水平均显著低于人正常肺上皮细胞(BEAS-2B)的表达水平。PAX9基因敲除试验结果显示,培养96 h后的si-PAX9转染组NCI-H520细胞的活力显著高于si-NC对照组和空白组NCI-H520细胞的活力;平板克隆试验结果显示,si-PAX9转染组NCI-H520细胞的克隆数显著多于si-NC转染组;伤口愈合试验结果显示,si-PAX9转染组NCI-H520细胞的愈合速度显著快于si-NC转染组;流式细胞术检测结果显示,与si-NC转染组、空白组比较,si-PAX9转染组NCI-H520细胞处于S期的细胞明显减少,处于G2期的细胞明显增加。结果提示,PAX9是LUSC的抑癌基因,PAX9的表达水平与LUSC的发病以及患者的预后密切相关,PAX9基因与LUSC细胞的增殖、迁移和克隆有关。

