乳糖酸修饰的黄芩苷自组装胶束载药系统的制备及体外评价
邵艳寻,郭切切,张舒迪,杨雅欣,龚法伍,刘占军
华北理工大学药学院,河北 唐山 063210
中医学家发现许多中药材能抑制和减轻化疗药物产生的不良反应,提高治疗效果[1-2]。黄芩苷(baicalin,BC)是黄芩的主要有效成分,具有抗菌、抗炎、抗氧化、镇静、降压、免疫抑制等药理作用[3-4]。研究[5-6]发现,黄芩苷主要影响肿瘤细胞内源性凋亡,通过多种信号通路影响B淋巴细胞瘤-2(B-cell lymphoma 2,Bcl-2)家族蛋白、细胞色素C、Caspase-3、Caspase-9等蛋白表达,诱导肝癌细胞凋亡。黄芩苷虽有诸多优势,但其水溶性较差,生物利用度低[7]。目前已经开发了一系列载黄芩苷的纳米制剂,包括固体脂质纳米粒、磷脂复合物、共沉淀物、纳米乳[8-12]等,但存在工艺复杂、载药量低等问题。阿霉素(doxorubicin,DOX)是一种蒽环类拓扑异构酶抑制剂,可通过下调Bcl-2的蛋白表达以及诱导Wnt通路抑制剂的表达来诱导肝癌细胞凋亡。但是通过单独应用阿霉素,常会因为其较差的器官选择性而引起严重的毒副反应。目前,已有研究发现黄芩苷在肝癌、肺癌、乳腺癌等癌症的化疗中具有辅助治疗的作用,可以减轻不良反应,增强抗癌效果。
自组装胶束作为纳米药物载体,具有内核疏水外壳亲水的结构,能改善难溶性药物的溶解性并实现持续、缓慢的药物释放[13]。针对胶束增溶能力强、粒径小、循环时间长等优点[14-16],可通过寻找合适的载体材料设计开发载黄芩苷和阿霉素胶束。O-羧甲基壳聚糖(O-carboxymethyl chitosan,OCMC)保留了壳聚糖骨架大量的活性氨基,可用于化学修饰进行改造[17-19]。由于骨架上同时具有氨基和羧基,在水介质中有两亲性聚电解质的特性,在骨架上通过疏水修饰可以获得具有pH值敏感的壳聚糖自组装胶束体系。例如将疏水性药物小分子偶联到OCMC骨架上构建自组装前药胶束[20]。
乳糖酸(lactobionic acid,LA)可被肝实质细胞膜上的ASGP-R受体特异性识别并通过内吞作用快速摄取[21-22],将其修饰到骨架上会增强载体的靶向递送能力。因而本研究设计合成CMBC及LACMBC,并以LA-CMBC为载体制备负载阿霉素的自组装胶束,对其制剂学性质及体外抗肿瘤活性进行考察,以期实现协同效应,为中药与化疗药物的协同抗肝癌研究奠定基础。
1 材料与仪器
FTIR-8400S红外光谱分析仪,日本岛津公司;ZEN3690型激光粒度分析仪,英国Malvern仪器公司;F-320荧光分光光度计,天津港东科技股份有限公司;布鲁克600兆核磁共振波谱仪,德国布鲁克仪器公司;JEM-2800F型聚焦双束扫描电子显微镜(SEM),美国FEI仪器有限公司;Lambda 35紫外可见光分光光度计,珀金埃尔默仪器有限公司;iMark全自动酶标仪,美国Bio-Rad公司。
黄芩苷(质量分数>90%,批号21967-41-9)、N-羟基琥珀酸亚胺(NHS,分析纯)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl,分析纯)、乳糖酸(分析纯)、N,N-二甲基甲酰胺(DMF,分析纯)、二甲基亚砜(DMSO,分析纯)、无水乙醇(分析纯)均购于阿拉丁有限公司;OCMC,脱乙酰度>90%,浙江澳兴生物科技有限公司;盐酸阿霉素,分析纯,天津市福晨化学试剂厂;DMEM高糖培养基(Eallbio,批号NG190320EL)、胰酶(Eallbio,批号N190823CF)、四甲基偶氮唑蓝(MTT,Eallbio,批号190114)均购于北京中生奥邦生物科技有限公司;胎牛血清,天津康源生物技术有限公司;人肝癌细胞HepG2受赠于华北理工大学的齐亚娟教授实验室。
2 方法与结果
2.1 CMBC的合成
根据文献方法[13]利用EDC/NHS介导的酰胺化反应,将黄芩苷偶联到OCMC骨架上合成CMBC。称取(76~189 mg黄芩苷,0.2~0.5 mol OCMC)的黄芩苷溶解于DMF中,超声溶解水浴加热至60 ℃,加入相当于黄芩苷2倍物质的量的EDC和NHS进行活化,搅拌30 min即得黄芩苷NHS活性酯溶液。另称取200 mg OCMC溶于蒸馏水中,60 ℃搅拌溶解,加入等量的DMF稀释,搅拌均匀。然后逐滴加入上述制备的黄芩苷活性酯溶液,60 ℃反应4 h后室温下继续反应24 h。反应液用透析袋(相对分子质量8000~14 000)在蒸馏水介质中透析72 h,冻干即得CMBC。通过控制黄芩苷和OCMC的投料比,可以获得不同黄芩苷取代度的CMBC。
2.2 LA-CMBC的合成
称取76 mg(0.25 mol OCMC)的乳糖酸溶于5 mL蒸馏水中溶解,加入相当于乳糖酸2倍物质的量的EDC和NHS搅拌30 min使乳糖酸的羧基活化。另取冻干的CMBC溶于蒸馏水中,搅拌过夜,将活化后的乳糖酸逐滴加入到CMBC水溶液中,室温搅拌48 h后,反应液用透析袋在蒸馏水介质中透析48 h,冻干即得LA-CMBC。合成路线见图1。
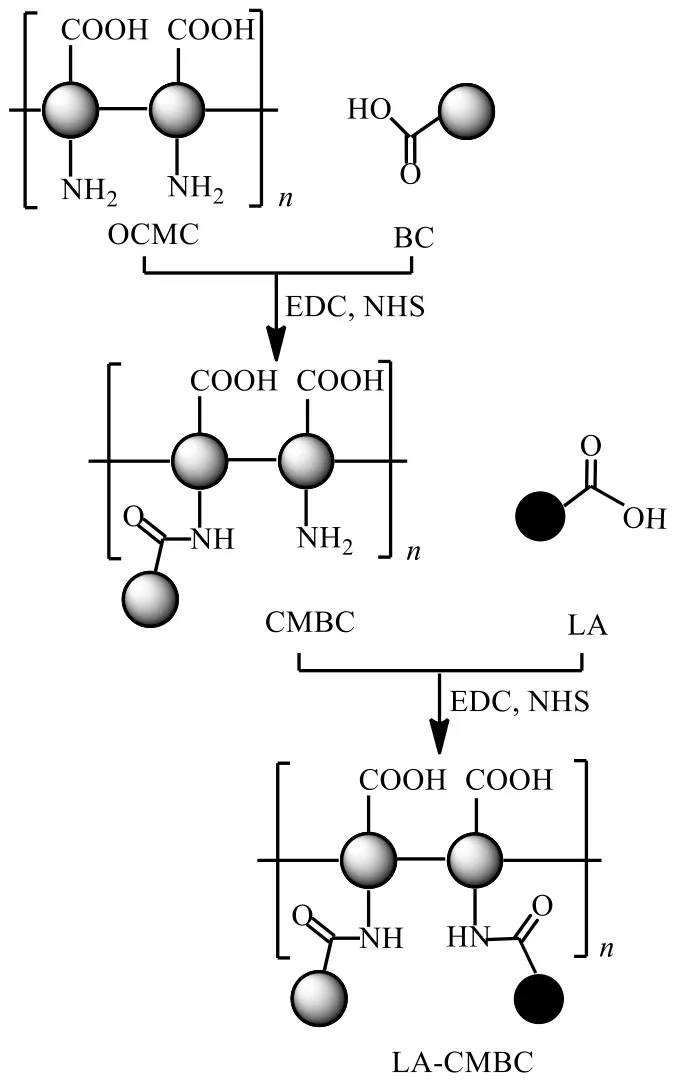
图1 CMBC和LA-CMBC的合成过程Fig.1 Synthesis of CMBC and LA-CMBC
2.3 偶联物的表征及结果
2.3.1 核磁共振氢谱(1H-NMR)检测及结果 以氘代DMSO和D2O为溶剂,分别对黄芩苷、OCMC进行1H-NMR分析;以混合溶剂(D2O-氘代DMSO 1∶1)对CMBC和LA-CMBC进行1H-NMR分析。结果发现,图2中OCMC在δ3.29~4.00显示出糖环骨架质子较宽的吸收峰。δ2.00处的特征峰归属于N-乙酰葡萄糖胺上的甲基氢。相比于OCMC在δ6.75~8.00出现的新的吸收峰,归属于黄酮类母核上的氢,其中在δ6.11~7.40处是苯环上氢的吸收峰,证实了黄芩苷成功地偶联到了OCMC骨架上。图2显示乳糖酸偶联至CMBC之后,在δ3.34~4.32出现了许多新的小峰,归属于乳糖酸环上的亚甲基峰。
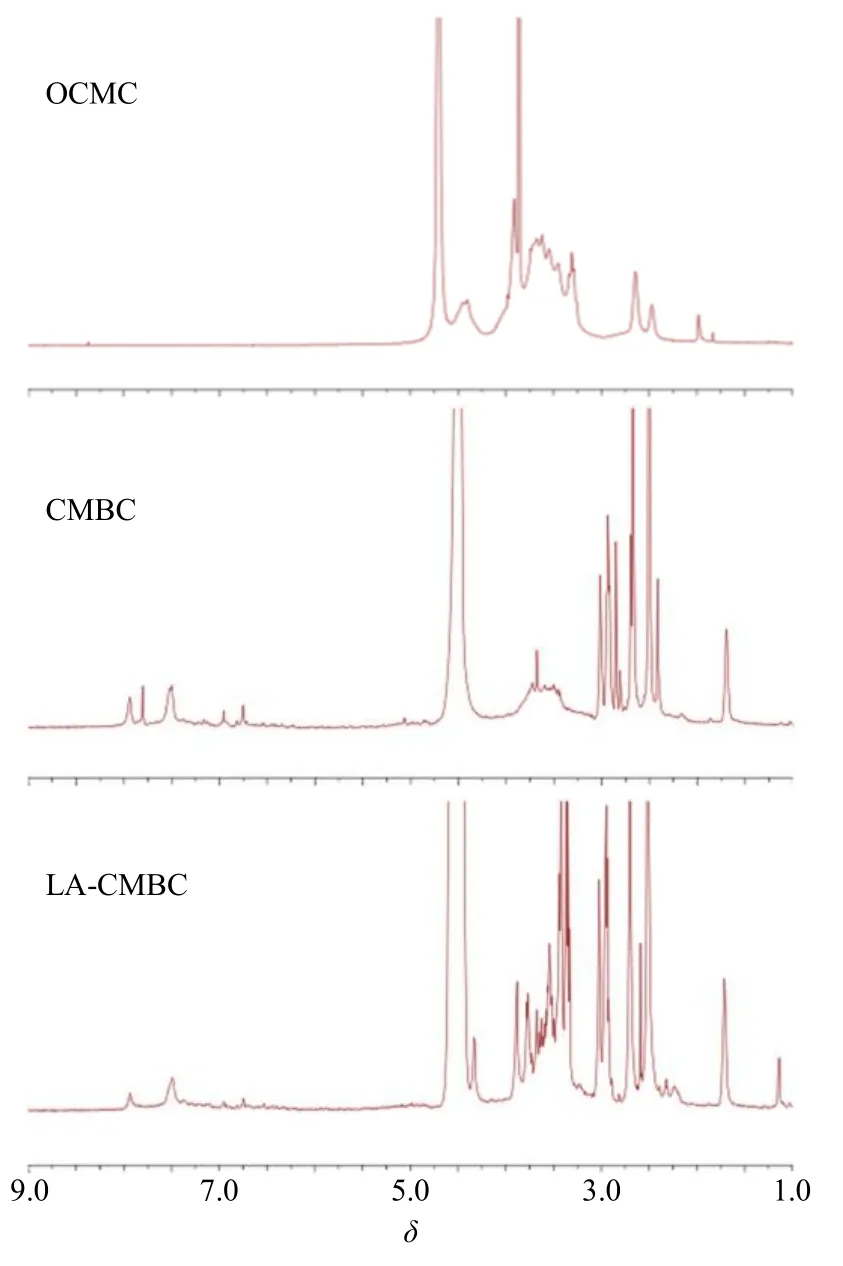
图2 OCMC、CMBC和LA-CMBC的1H-NMRFig.2 1H-NMR spectrum of OCMC, CMBC and LA-CMBC
2.3.2 红外光谱(IR)检测及结果 采用IR法对OCMC、CMBC和LA-CMBC进行表征。结果(图3)显示,OCMC在1602 cm-1的特征吸收谱带为酰胺II谱带,对应于伯氨基上N-H的弯曲振动,酰胺I谱带是C=O的伸缩振动吸收峰,波数稍高(1650 cm-1),由于1602 cm-1处吸收峰较大,因此使得酰胺I谱带和酰胺II谱带的吸收峰区分并不明显,说明OCMC的脱乙酰化程度较高,活性氨基较多。产物CMBC与OCMC图谱相比,出现了2个区分明显的吸收峰,位于1602 cm-1的酰胺II谱带吸收峰强度明显降低,而位于1650 cm-1的酰胺I谱带吸收峰则相反的呈现增强趋势,说明形成了更多的酰胺键,使得黄芩苷与OCMC骨架偶联。终产物LACMBC与CMBC相比,位于1602 cm-1的酰胺II谱带吸收峰强度进一步降低,而酰胺I谱带进一步增强,因此同样证实乳糖酸也是通过酰胺键与OCMC骨架偶联的。
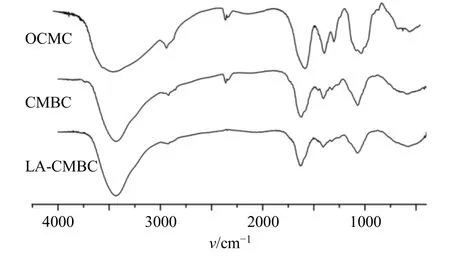
图3 OCMC、CMBC和LA-CMBC的IR图Fig.3 Infrared spectrum of OCMC, CMBC and LA-CMBC
2.3.3 CMBC取代度的测定及结果
(1)黄芩苷分析方法的建立:采用紫外分光光度法测定黄芩苷的取代度。以无水乙醇为溶剂,配制一定质量浓度的黄芩苷溶液,在200~600 nm进行紫外光谱扫描。取少量OCMC、CMBC水溶液,分别用无水乙醇稀释至适当质量浓度进行光谱扫描,结果见图4。

图4 黄芩苷、CMBC和OCMC的紫外扫描图谱Fig.4 UV scanning atlas of baicalin, CMBC and OCMC
可以看出,黄芩苷有2处明显吸收,最大吸收波长是278 nm。而OCMC在此范围内均无吸收,说明OCMC材料对黄芩苷的紫外吸收没有任何影响。而且,偶联物CMBC显示出了跟黄芩苷峰形一致的吸收。因此,可以确定将278 nm作为检测CMBC中黄芩苷含量的检测波长,且进一步证明了黄芩苷成功修饰到了OCMC骨架材料上。
(2)黄芩苷标准曲线建立:以无水乙醇为溶剂,配制质量浓度分别为4.10、5.13、6.15、7.18、8.20、9.23 μg/mL的黄芩苷系列标准溶液,于278 nm处测定各吸光度值。回归方程为Y=0.074 1X-0.043 3,r²=0.997 4。
(3)黄芩苷取代度的测定结果:黄芩苷的取代度规定为每100个OCMC重复单元中氨基连接黄芩苷的个数。在CMBC合成中,通过控制黄芩苷和OCMC的投料比可以得到不同取代度的CMBC,即CMBC-1、CMBC-2、CMBC-3。称取3种CMBC各1 mg至5 mL量瓶中,无水乙醇溶解定容,分别在278 nm下测定吸光度,计算取代度。
取代度=mMOCMC/(m样品-m)M黄芩苷
m指通过黄芩苷标准曲线计算出的CMBC偶联物中黄芩苷的质量,M黄芩苷指黄芩苷的相对分子质量;m样品指加入的CMBC总质量,MOCMC指OCMC单位糖单元的摩尔分数
从表1中看出,在黄芩苷投料比达到0.35时,已经有足够多的黄芩苷偶联到了OCMC上。因此,在偶联乳糖酸时为了能有较多的乳糖酸偶联到CMBC产物上,选用CMBC-2用于乳糖酸的接枝。
表1 黄芩苷和OCMC投料比及黄芩苷的取代度 ( ,n = 3)Table 1 Feeding ratio of baicalin and OCMC and substitution degree of BC ( , n = 3)
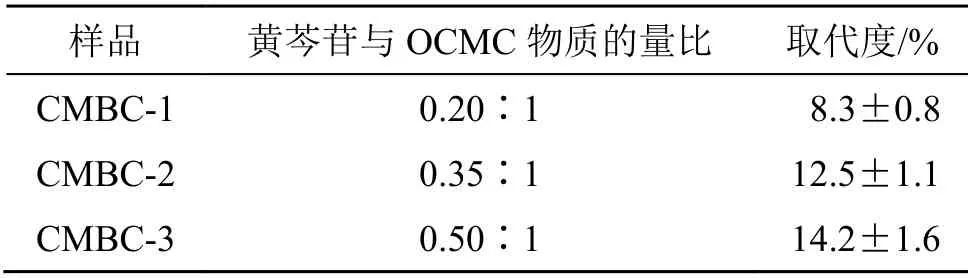
表1 黄芩苷和OCMC投料比及黄芩苷的取代度 ( ,n = 3)Table 1 Feeding ratio of baicalin and OCMC and substitution degree of BC ( , n = 3)
样品 黄芩苷与OCMC物质的量比 取代度/%CMBC-1 0.20∶1 8.3±0.8 CMBC-2 0.35∶1 12.5±1.1 CMBC-3 0.50∶1 14.2±1.6
2.4 自组装胶束的制备及表征
采用透析-超声法制备自组装胶束。由于CMBC和LA-CMBC均为两亲性偶联物,所以两者在水中透析的过程中就会自组装形成纳米胶束,为了使纳米颗粒分散均匀,再用探头式超声在冰浴条件下超声处理3次,每次处理2 min,超声程序设置为开2 s停4 s,超声功率为120 W。然后过0.45 μm的滤膜,即得自组装胶束(图5),于4 ℃冰箱保存。

图5 CMBC胶束 (左)、LA-CMBC胶束 (中) 和LACMBC冻干物 (右)Fig.5 CMBC micelles (left), LA-CMBC micelles (middle),and LA-CMBC lyophilized products (right)
采用激光粒度电位分析仪测定胶束的粒径、多分散指数(polydispersity index,PDI)和Zeta电位,结果见表2和图6。采用SEM观察胶束的形貌大小,结果见图7。
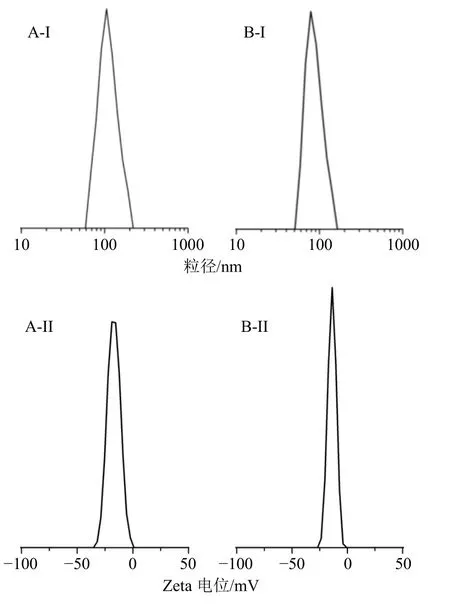
图6 CMBC-2 (A)、LA-CMBC-2 (B) 的粒径分布 (I) 和Zeta电位 (II)Fig.6 Particle size distribution (I) and Zeta potential (II) of CMBC-2 (A) and LA-CMBC-2 (B)

图7 CMBC-2 (A)、LA-CMBC-2 (B) 的扫描电镜图Fig.7 SEM images of CMBC-2 (A) and LA-CMBC-2 (B)
表2 3种不同取代度的CMBC和LA-CMBC的粒径、PDI和Zeta电位 ( , n = 3)Table 2 Partical size, PDI and Zeta potential of CMBC and LA-CMBC with three different degree of substitution( , n = 3)

表2 3种不同取代度的CMBC和LA-CMBC的粒径、PDI和Zeta电位 ( , n = 3)Table 2 Partical size, PDI and Zeta potential of CMBC and LA-CMBC with three different degree of substitution( , n = 3)
样品 取代度/%粒径/nm PDI Zeta电位/mV CMBC-1 8.3 215.0±4.8 0.112±0.030 -17.02±0.29 CMBC-2 12.5 181.1±3.7 0.094±0.021 -17.16±0.75 CMBC-3 14.2 164.7±6.5 0.163±0.035 -17.24±0.82 LA-CMBC-2 - 156.3±6.4 0.131±0.087 -14.47±0.51
3种CMBC胶束粒径在164~215 nm,随着黄芩苷取代度的增加,胶束粒径逐渐减小。这是因为疏水基团越多,形成的疏水性内核就更紧密,粒径更小。LA-CMBC-2胶束粒径约为156 nm,可以满足肝靶向制剂要求,粒径小于CMBC-2胶束,推测可能是水溶性乳糖酸的引入使OCMC骨架柔性增强,更易弯曲缠绕成粒径更小的粒子。2自组装体系均显示出负值的Zeta电位,说明在自组装的过程中,带负电荷的亲水性OCMC可以较为均匀的分布在偶联物的表面,也间接证实了自组装体系的形成。通过SEM观察到的自组装胶束为形状较规则的类球形,粒径大小较均一,实际观察到的粒径约为150 nm,比粒度电位分析仪测定的粒径稍小。这是因为SEM样品在预处理过程中因干燥导致粒子失水,从而使电镜下呈现的粒径比其在粒度仪(水介质体系)中的数据要稍小一些,此现象与文献报道一致[23]。
2.5 临界胶束浓度(critical micelle concentration,CMC)的测定及结果
LA-CMBC在水中的自组装行为采用芘荧光探针法进行考察。配制质量浓度为0.012 mg/mL的芘溶液和1 mg/mL的LA-CMBC母液。取8个棕色样品瓶,各加入100 μL芘溶液,氮气吹干后各加入不同体积的LA-CMBC母液,蒸馏水定容至10 mL。使所配制的系列溶液质量浓度分别为0.001、0.005、0.010、0.025、0.050、0.100、0.250、0.500 mg/mL。水浴超声40 min,室温避光静置8 h。荧光分光光度计的激发波长为334 nm,测定各溶液中芘的荧光吸收,将芘的第3个峰的谱带强度与第1个峰的谱带强度之比(I3/I1)对质量浓度的对数做图,交点处对应的质量浓度即为胶束的CMC值。
测得LA-CMBC胶束的CMC值为(0.081±0.019)mg/mL(图8),说明LA-CMBC在水中容易聚集形成纳米粒,并且进入血管后可以抵抗大量的血液稀释,是一种良好的两亲性偶联物。
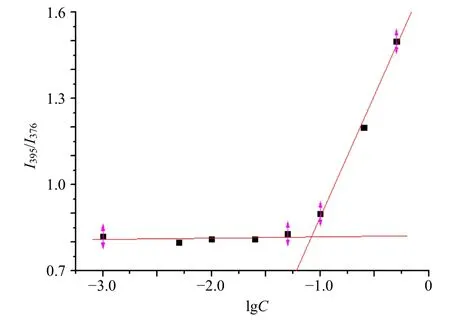
图8 芘发射光谱荧光强度比值I3/I1和胶束质量浓度(C)的对数关系图 ( , n = 3)Fig.8 Logarithmic relationship between pyrene emission spectral fluorescence intensity ratio I3/I1 and micelle concentration ( , n = 3)
2.6 载药胶束DOX/LA-CMBC的制备、含量测定、体外释放及结果
2.6.1 载药胶束的制备 采用透析法制备DOX/LA-CMBC胶束。称取DOX·HCl 3 mg溶于5 mL DMSO,加入2倍物质的量的三乙胺进行脱盐酸处理,避光搅拌过夜。另取LA-CMBC 10 mg溶于5 mL蒸馏水,搅拌过夜使之充分溶胀溶解。将阿霉素溶液缓慢滴加到LA-CMBC水溶液中,继续避光搅拌24 h后对蒸馏水透析24 h。将溶液用探头超声处理,过0.45 μm滤膜即得。
2.6.2 阿霉素含量测定方法的建立 采用紫外分光光度法测定胶束制剂中阿霉素的含量。
(1)阿霉素对照品储备液的制备:以DMSO为溶剂配制200 μg/mL的阿霉素对照品储备液,避光备用。
(2)检测波长的确定:分别取适量阿霉素储备液、CMBC、LA-CMBC胶束溶液用DMSO稀释至适当质量浓度,在280~600 nm扫描其紫外吸收光谱。如图9可见,阿霉素在481 nm处有一比较大的特征吸收峰,偶联物CMBC和LA-CMBC在481 nm处均无吸收,说明选用LA-CMBC作为载体不会影响阿霉素的紫外吸收,因此,选用481 nm作为阿霉素定量测定的检测波长。
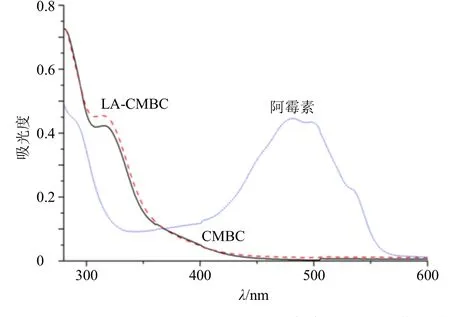
图9 阿霉素、CMBC、LA-CMBC溶液的紫外扫描图谱Fig.9 Ultraviolet scanning atlas of doxorubicin, CMBC and LA-CMBC solutions
(3)标准曲线的建立:取阿霉素对照品储备液用DMSO分别稀释配制成质量浓度为5、10、15、20、30、40 μg/mL的系列对照品溶液。于481 nm处测定吸光度值,绘制标准曲线,进行线性回归,得到阿霉素标准曲线的回归方程为Y=0.019 2X+0.004 5,R2=0.999 4。可见阿霉素在5~40 μg/mL线性关系良好。
(4)精密度试验:取阿霉素储备液用DMSO稀释成5、20、40 μg/mL的阿霉素供试液,用紫外在同天内每个质量浓度测量5次得到日内精密度;连续测定5 d,得日间精密度。计算出低、中、高3种质量浓度的阿霉素供试液的日内RSD分别为1.83%、0.95%、0.68%;日间RSD分别为1.98%、1.52%、1.27%,均小于2.0%,满足分析测试的要求。
(5)回收率试验:分别配制250、1000、2000 μg/mL的阿霉素溶液各5份,各取0.2 mL,加入处方比例的LA-CMBC胶束溶液混匀后用DMSO定容至10 mL,即得质量浓度分别为5、20、40 μg/mL的阿霉素供试液,紫外测定各吸光度值,计算阿霉素的回收率,分别为98.83%、101.19%、100.79%,说明阿霉素与LA-CMBC胶束溶液不发生吸附作用,可认为该载体对药物含量测定没有影响,该方法可行。
(6)稳定性试验:按“2.6.1”项下方法制备阿霉素浓度为5、20、40 μg/mL的载药胶束供试液,分别在室温下于0、2、4、6、8、10、12、24 h测定紫外吸收。结果显示,3种质量浓度的供试液在24 h内的RSD分别为1.24%、1.68%、1.52%,表明在24 h内供试液稳定性良好。
(7)重复性试验:按“2.6.1”项下方法制备6份样品溶液,分别进行紫外测定,计算RSD值,考察重复性,结果RSD为1.49%,表明该方法重复性良好。
2.6.3 载药胶束中阿霉素的含量测定及结果 量取载药胶束0.5 mL于10 mL量瓶中,加入DMSO超声混匀并定容至刻度,按“2.6.2”项下的方法测定吸光度值,测得载药胶束中阿霉素的包封率为(69.67±3.87)%,载药量为(16.08±0.25)%(n=3)(由于阿霉素是以疏水性小分子包载于自组装胶束中,其本身溶解度很低,故不考虑极少量游离阿霉素的量)。
包封率=m1/m2
载药量=m1/m总
m1为阿霉素在自组装胶束中的量,m2为阿霉素的投料量,m总为载药胶束的总质量
2.6.4 DOX/LA-CMBC载药胶束的理化性质考察及结果 取适量载药胶束溶液用蒸馏水稀释后,利用马尔文粒度仪检测,结果见图10。测得DOX/LACMBC载药胶束的平均粒径为(180.2±6.7)nm,PDI为0.140±0.003,Zeta电位为(-16.14±0.25)mV(n=3)。

图10 DOX/LA-CMBC的粒径分布 (A) 和Zeta电位 (B)Fig.10 Particle size distribution (A) and Zeta potential (B)of DOX/LA-CMBC
2.6.5 不同pH值环境下载药胶束中阿霉素、黄芩苷的体外释放及结果 采用透析法,选取不同pH值(5.8、6.5、7.4)的PBS溶液作为释放介质,采用荧光分光光度法测定阿霉素在3种不同pH值PBS溶液中的标准曲线,结果分别为阿霉素荧光强度(F,pH 5.8)=163.62X+2.475 9,R2=0.999 5;F(pH 6.5)=158.09X+0.166 9,R2=0.999 1;F(pH 7.4)=143.06X+1.257 1,R2=0.999 4;结果表明阿霉素在0.02~0.80 μg/mL荧光强度与质量浓度线性均良好。采用紫外法测定黄芩苷在3种PBS溶液中的标准曲线,结果分别为Y(pH 5.8)=0.068 4X-0.006 1,R2=0.999 1;Y(pH 6.5)=0.066 8X-0.001 4,R2=0.999 0;Y(pH 7.4)=0.064 0X+0.003 1,R2=0.999 1;结果表明黄芩苷在0.1~20.0 μg/mL线性关系良好。
量取DOX/LA-CMBC溶液1 mL,置于透析袋内,密封好后浸入含20 mL释放介质的锥形瓶中,在37 ℃、100 r/min转速的条件下进行体外释放实验。在预设时间点取样1 mL,并同时补充等体积新鲜的释放介质。计算累积释放量,分别作阿霉素、黄芩苷的体外释放曲线(图11)。从释药曲线看出,胶束中阿霉素的释放均较为缓慢、持久,无明显突释现象。还表现出pH值敏感性,即在较低pH值条件下释放较快且多,在较高pH值条件下,释放较缓慢且较少。胶束中的黄芩苷在pH 7.4条件下只释放了26.16%,在pH 6.5条件下释放了38.24%,虽然比pH 7.4下释放较快,但是释放量依然较少,说明胶束在到达肿瘤部位前可以较好的保持结构的稳定性。而在pH 5.8条件下不仅释放快,释放量还达到了68.45%,说明胶束到达肿瘤部位时,胶束体系瓦解,酰胺键快速水解从而释放出黄芩苷。总之,阿霉素、黄芩苷的释放行为一致,均表现为pH值敏感性。

图11 载药胶束中阿霉素和黄芩苷在不同pH值释放介质中的释药曲线 ( , n = 5)Fig.11 Drug release curves of doxorubicin and baicalin in drug-loading micelles in different pH release media ( ,n = 5)
2.7 体外抗肿瘤活性检测及结果
采用MTT法检测胶束制剂的细胞毒性。实验中考察的黄芩苷的质量浓度分别为0.25、0.50、1.00、5.00、10.00 μg/mL。简而言之,将HepG2细胞以5×103个/孔的密度接种于96孔板中培养过夜,试验组分别加入不同质量浓度的黄芩苷、阿霉素、CMBC、LA-CMBC和DOX/LA-CMBC溶液,对照组加入等体积培养液,每组5个复孔后培养48 h,之后弃培养液,每孔加10 μL MTT(5 mg/mL)和190 μL培养液后培养4 h,终止培养并弃上清,每孔加入150 μL DMSO,避光震荡10 min后于570 nm处测吸光度,计算细胞生长抑制率。
细胞生长抑制率=(A对照—A试验)/A对照
由表3看出,纯阿霉素对HepG2细胞生长抑制作用最强,黄芩苷、CMBC及LA-CMBC对细胞均有一定的抑制作用,并与浓度成依赖性。在实验浓度下,黄芩苷的抑制率从5%升至35%,CMBC抑制率从10%升至46%,LA-CMBC抑制率从14%升至51%,表明与黄芩苷相比,CMBC与LA-CMBC的抑制率均高于黄芩苷(P<0.05),表明黄芩苷作为疏水端包裹于胶束中能显著提高其抗肿瘤效果。且LA-CMBC与CMBC相比,差异具有显著性(P<0.05),可认为LA-CMBC比CMBC有较强抑制作用,一定程度上表明了乳糖酸的靶向作用。在胶束质量浓度为1~10 μg/mL内,DOX/LA-CMBC的抑制作用最强(P<0.01),说明以LA-CMBC为载体共同递送阿霉素和黄芩苷可行。
表3 黄芩苷、阿霉素、CMBC、LA-CMBC和DOX/LA-CMBC对HepG2细胞的生长抑制率 ( , n = 3)Table 3 Growth inhibition rate of baicalin, doxorubicin, CMBC, LA-CMBC and DOX/LA-CMBC on HepG2 cells ( ,n = 3)

表3 黄芩苷、阿霉素、CMBC、LA-CMBC和DOX/LA-CMBC对HepG2细胞的生长抑制率 ( , n = 3)Table 3 Growth inhibition rate of baicalin, doxorubicin, CMBC, LA-CMBC and DOX/LA-CMBC on HepG2 cells ( ,n = 3)
与黄芩苷组比较:*P<0.05 **P<0.01;与CMBC组比较:#P<0.05*P < 0.05 **P < 0.01 vs baicalin group; #P < 0.05 vs CMBC group
样品 细胞生长抑制率/%0.25 μg·mL-1 0.50 μg·mL-1 1.00 μg·mL-1 5.00 μg·mL-1 10.00 μg·mL-1黄芩苷 5.1±1.2 9.0±0.5 15.2±1.4 28.2±0.7 35.4±1.0阿霉素 35.0±2.4 53.4±1.5 62.3±2.0 73.1±1.6 79.2±1.2 CMBC 10.4±2.2 12.1±1.7* 20.6±2.5* 33.3±1.3* 46.0±1.7*LA-CMBC 14.2±1.6 15.1±1.9*# 25.6±2.4*# 40.5±1.0*# 51.3±1.5*#DOX/LA-CMBC 28.3±2.1*# 31.1±1.6*# 47.6±1.2**# 63.5±1.8**# 70.2±0.9**#
3 讨论
本研究在OCMC偶联黄芩苷形成的前药基础上进行靶向修饰,获得LA-CMBC并以其为载体制备载药胶束,实现黄芩苷与阿霉素的共同递送,所制备的胶束具有较好的制剂学性质。图12为DOX/LA-CMBC胶束形成示意图。OCMC骨架构成亲水性外壳,增加了胶束的血液循环时间,在胶束表面形成水化层而阻止血浆调理素等蛋白吸附在胶束表面,避免被网状内皮系统吞噬[2]。疏水性药物黄芩苷缔合为疏水内核同时作为一种药物,与阿霉素共同递送来发挥协同抗癌作用。

图12 DOX/LA-CMBC载药胶束形成示意图Fig.12 Schematic diagram of DOX/LA-CMBC drug-carrying micelle formation
在考察胶束体外释放时发现当释放介质pH值为5.8时,胶束体系出现浑浊现象,但全程未见有明显的沉淀,推测在酸性条件下胶束体系稳定性下降,从而使体系趋于瓦解,但并未达到彻底裂解、聚集并沉淀的程度,这与文献报道一致[13]。
细胞毒性实验表明,纯阿霉素对HepG2细胞生长抑制作用最强,这是因为纯阿霉素溶液通过自由扩散进入细胞,而胶束通过靶向作用及实体瘤的高通透性和滞留效应(EPR效应)到达肿瘤环境并存在缓慢的胞内释药行为,所以使进入并富集于细胞的药量少于纯阿霉素,但是阿霉素选择性差,毒副作用大。CMBC和LA-CMBC的抑制作用比DOX/ LACMBC的弱,这是由于后者除了有乳糖酸介导的靶向作用还会通过体系瓦解、酰胺键水解释放DOX、黄芩苷2种药物,且据文献数据[1,24]推测2药物可能具有协同的抗肝癌作用。具体机制如下:褚冬青等[25]发现将黄芩苷与DOX联用可以诱导舌癌细胞凋亡,并且协同增效机制可以下调Bcl-2、磷酸化粘着斑激酶(phosphorylated focal adhesion kinase,p-FAK)及磷酸化酪氨酸蛋白激酶(phosphorylated tyrosine protein kinase,p-Src)蛋白表达;郁洁雯等[26]将黄芩苷与阿霉素联用抑制脑神经胶质瘤细胞,其效果优于单个药物治疗,可见二者联合应用具有协同抗肿瘤作用。肿瘤的发生从来都不是一种基因异常造成的,联合给药才可增强药效。黄芩苷可以阻滞HepG2肝癌细胞在S期,通过促进人肝癌细胞的E-钙黏蛋白(E-cadherin,E-cd)表达,抑制整合素-β1(integrin-β1)表达、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)mRNA和蛋白的表达以及抑制STAT3蛋白的磷酸化,从而抑制肿瘤细胞的增殖[27]。阿霉素可通过下调Bcl-2的蛋白表达以及诱导Wnt通路抑制剂的表达来诱导肝癌细胞凋亡[28]。可见黄芩苷和阿霉素可以通过不同的作用机制诱导肝癌细胞凋亡。故本研究推测,当胶束通过主动靶向作用及EPR效应到达肿瘤环境释放黄芩苷、阿霉素时,两者可以发生协同作用。本研究将在动物水平上继续考察两者的协同效应,为中草药与化疗药物的协同抗肝癌研究奠定基础。
利益冲突所有作者均声明不存在利益冲突

