GST-π、Ki-67的表达与体质量指数在直肠癌预后中的临床意义
黄崇杰,洪滉,刘长宝,曹伟兰,黄颖鹏,王中林
温州医科大学附属第二医院,浙江 温州 325027,1.肛肠外科;2.综合外科;3.胃肠外科
大肠癌的发病率在恶性肿瘤中排名第三,且有逐年升高的趋势[1]。大肠癌的发生、进展及预后情况是一个多因素共同干预的生物学过程。Ki-67是一种参与细胞增殖分裂的核蛋白,研究认为肿瘤细胞Ki-67的高表达可促进细胞增殖分裂,肿瘤的侵袭转移 能力强[2]。GST-π(glutathione S-transferase π)是一种多功能代谢酶亚型,研究发现GST-π基因高表达可促进药物失活及外排,从而增加肿瘤细胞对抗化疗药物。因此GST-π与Ki-67的表达与大肠癌发生发展、侵袭转移等均具有相关性,可评估及预测肿瘤的恶性程度及远期预后情况。研究表明超重和肥胖增加了癌症发生的风险,也是目前世界严重的公共卫生问题[3]。体质量指数(body mass index, BMI)与大肠癌发病、转移、肿瘤耐药及预后关联基因的关系目前仍存在争议。本研究探讨直肠癌组织中GST-π、Ki-67的表达及患者BMI水平与肿瘤临床生物学特征之间的关系及临床意义,对直肠癌患者疗效分析及远期预后评估提供指导意义。
1 对象和方法
1.1 对象 回顾性分析温州医科大学附属第二医院肛肠外科及普通外科于2010年1月1日至2013年1月1日收治的直肠癌手术患者共308例,行经腹或腹腔镜下直肠癌根治术(包括直肠癌低位前切除术、腹会阴联合直肠癌根治术),II期高危及III期患者常规行术后辅助化疗。收集的临床资料包括:性别、年龄、基础疾病(糖尿病、高血压病)、BMI、肿瘤下缘距齿状线距离、肿瘤大小及浸润深度(T1-T4)、分化程度(高、中、低分化)、病理类型、淋巴结转移、TNM分期及5年生存率情况。准入标准:①成年且经本院术后病理确诊直肠癌;②术前6个月内体质量波动低于10%者;③原发直肠癌;④病例信息资料完整。排除标准:①未成年或临床病理资料不全者;②原位癌和TNM分期IV期患者;③结直肠肿瘤家族史;④合并其他恶性肿瘤患者,或其他器官远处转移;⑤手术前曾经接受新辅助化疗的直肠癌患者;⑥行姑息性手术者;⑦电话失访,非肿瘤因素死亡的患者。
1.2 方法
1.2.1 分组:根据患者临床一般资料及肿瘤病理生物学特征进行分组,按BMI分为:超重组(BMI≥ 24 kg/m2)、正常组(BMI为18.5~24 kg/m2)、消瘦组(BMI<18.5 kg/m2);GST-π阳性组、GST-π阴性组;Ki-67高阳性组(Ki-67>70%)、Ki-67低阳性组(Ki-67≤70%);SPSS17.0分析BMI及肿瘤指标(GST- π、Ki-67)的表达与患者临床及病理特征的相关性,进一步分析BMI与GST-π、Ki-67表达之间的相关性及临床意义。分析Ki-67高阳性患者5年生存率与BMI的关系。
1.2.2 病理标本检测:联合病理科将术后直肠癌标本取材,将肿瘤组织用中性甲醛溶液固定,常规石蜡脱水,将组织用石蜡包埋后切片,厚度4 μm,切片常规脱蜡,用鼠抗人Ki-67、GST-π单克隆抗体孵育后,采用SP法染色,树胶封片后高倍显微镜下观察,根据试剂盒说明书免疫组化实验步骤对Ki-67、GST-π在直肠癌中的表达情况进行检测。在高倍光学显微镜下随机观察切片10个视野并计数。GST-π的阳性表达染色情况主要定位于胞质与胞膜,光镜下染色后细胞质为黄色或棕黄色颗粒的为阳性细胞,计算阳性细胞百分比进行分组,细胞质内未见阳性细胞或阳性细胞比例<15%为(-),着色细胞所占比15%~25%为(+),细胞质内见阳性细胞所占百分比25~75%为(++),细胞质内见阳性细胞所占百分比>75%为(+++)。根据统计需要分为GST-π表达阴性组(-),阳性组(+/++/+++)。Ki-67的表达集中在细胞核,经过染色后肿瘤细胞核内染色分为未染色、淡黄色颗粒、棕黄色颗粒或褐色颗粒,其中褐色、棕黄色颗粒为阳性细胞,胞浆内染色的细胞不作为阳性计数,根据肿瘤细胞染色阳性细胞数计算百分率。统计分析时方便计算,将Ki-67染色阳性细胞数所占比进行分组:肿瘤细胞染色阳性细胞数所占百分比≤70%为Ki-67低阳性,肿瘤细胞染色阳性细胞数所占百分比>70%为Ki-67高阳性。
1.3 统计学处理方法 采用SPSS17.0软件进行统计学分析。计数资料以例数(%)表示,两样本率或构成比比较采用χ2检验,多样本率比较采用行列表的χ2检验(单向有序,变量属性不同,采用秩和检验;双向有序,变量属性不同,采用等级相关分析)。BMI与Ki-67阳性表达的相关性采用单变量Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化检测GST-π在直肠癌组织中的表达情况 GST-π的阳性表达染色情况主要定位于胞质与胞膜,光镜下染色后细胞质为黄色或棕黄色颗粒的为阳性细胞(见图1)。
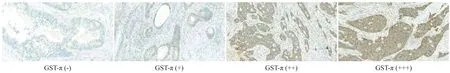
图1 GST-π在直肠癌组织中的表达(×400)
2.2 免疫组化检测Ki-67在直肠癌组织中的表达情况 Ki-67的表达集中在细胞核,肿瘤细胞核内染色分为未染色、淡黄色、棕黄色或褐色颗粒,其中褐色、棕黄色颗粒为阳性细胞(见图2)。
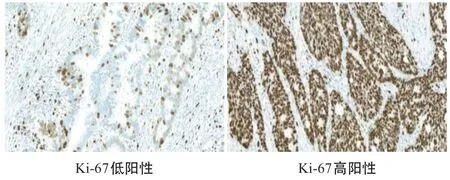
图2 Ki-67在直肠癌组织中的表达(×400)
2.3 BMI与患者临床特征及肿瘤病理的关系 不同BMI水平在患者性别、糖尿病病史、肿瘤下缘位置、癌结节转移、淋巴结转移情况之间差异均无统计学意义(P>0.05)。BMI与患者年龄、高血压、肿瘤浸润、肿瘤大小、TNM分期、组织分化程度及术后5年生存率具有相关性(P<0.05)。进一步研究表明,患者年龄、高血压病、肿瘤直径≥3 cm与超重相关(P<0.05)。肿瘤的浸润程度、高TNM分期、分化程度及5年生存率低均与消瘦相关(P<0.05)。见表1。
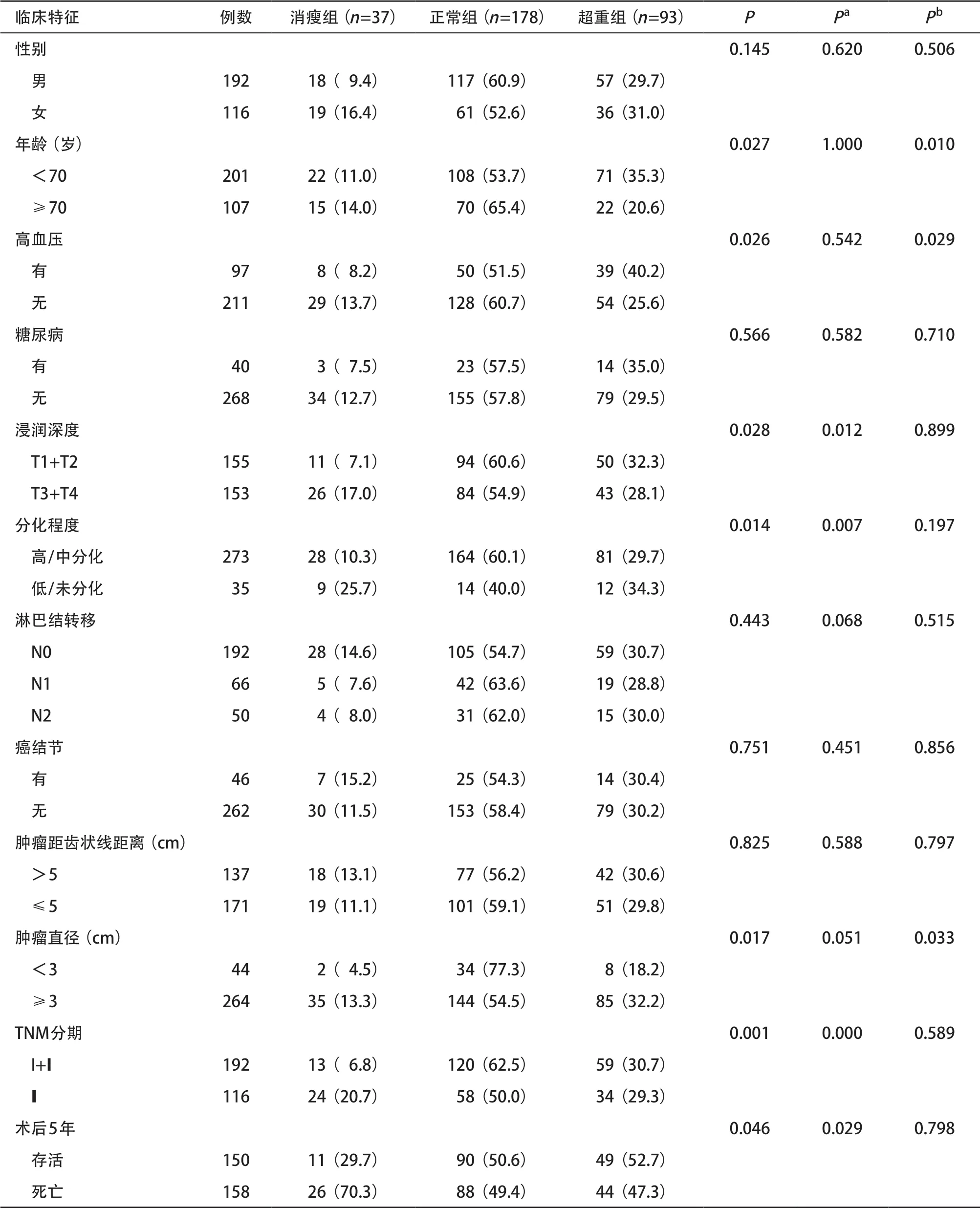
表1 BMI与直肠癌临床生物学特征的关系[例(%)]
2.4 直肠癌Ki-67的表达与肿瘤临床及病理特征的关系 直肠癌组织Ki-67的表达在年龄、性别、是否患基础疾病(糖尿病、高血压病)、肿瘤距齿状线距离、肿瘤大小、分化程度、癌结节、淋巴结转移情况等因素之间差异均无统计学意义(P>0.05)。Ki-67的表达与BMI、肿瘤浸润深度、TNM分期及术后5年生存率相关,差异有统计学意义(P<0.05)。见表2。
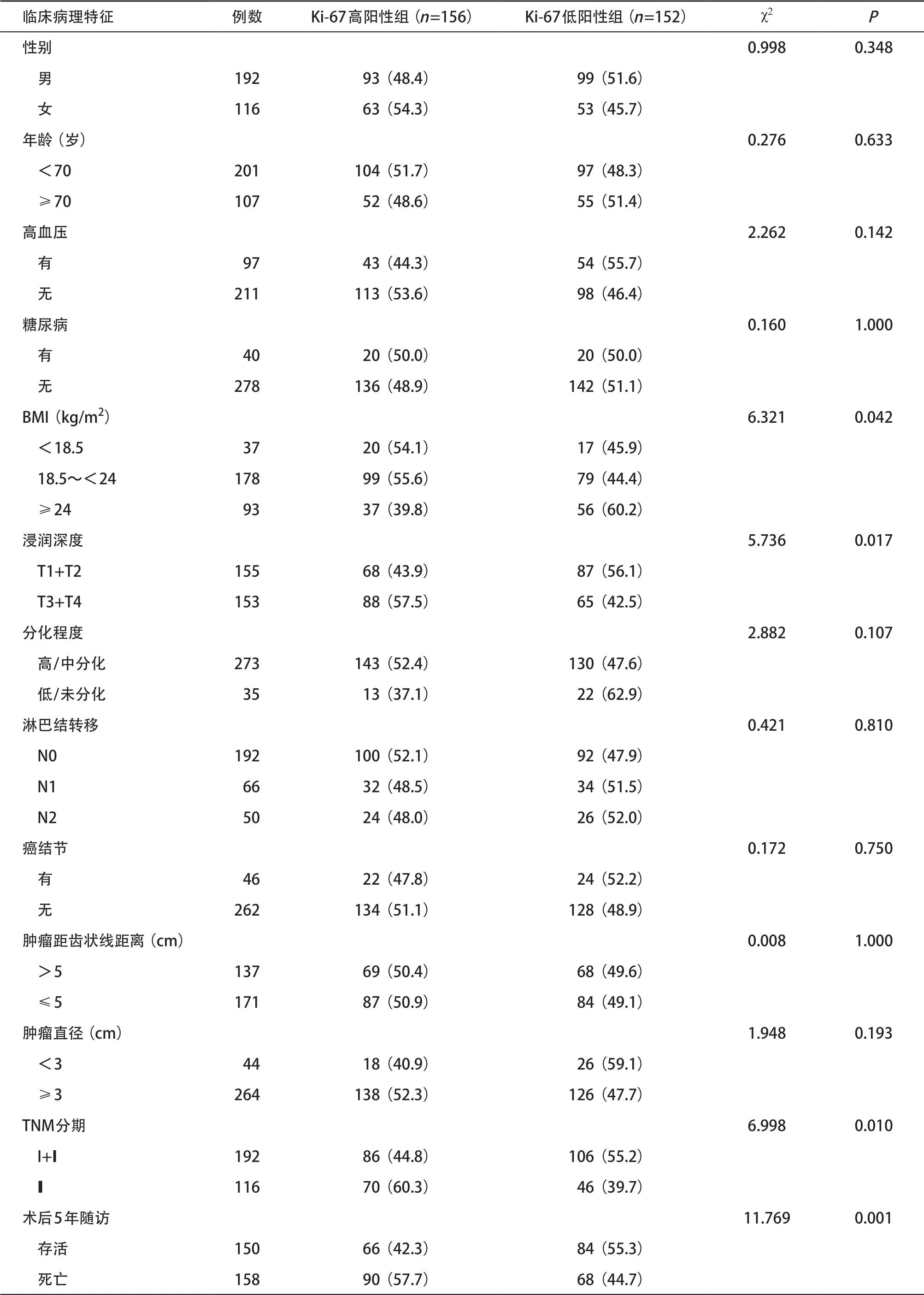
表2 Ki-67的表达与直肠癌临床生物学特征的关系[例(%)]
2.5 直肠癌GST-π的表达与肿瘤临床及病理特征的关系 直肠癌GST-π的表达与患者性别、年龄、是否患基础疾病(糖尿病、高血压病)、肿瘤浸润程度、肿瘤大小、癌结节转移及5年生存率比较,差异均无统计学意义(P>0.05)。GST-π的表达水平与直肠癌患者BMI相关(P<0.05)。GST-π的表达水平与淋巴结转移情况有关(P<0.05)。GST-π的表达与肿瘤距齿状线距离有关,肿瘤位置越低,GST-π表达水平越高,差异有统计学意义(P<0.05),GST-π的表达水平与肿瘤TNM分期有关,差异有统计学意义(P<0.05)。见表3。
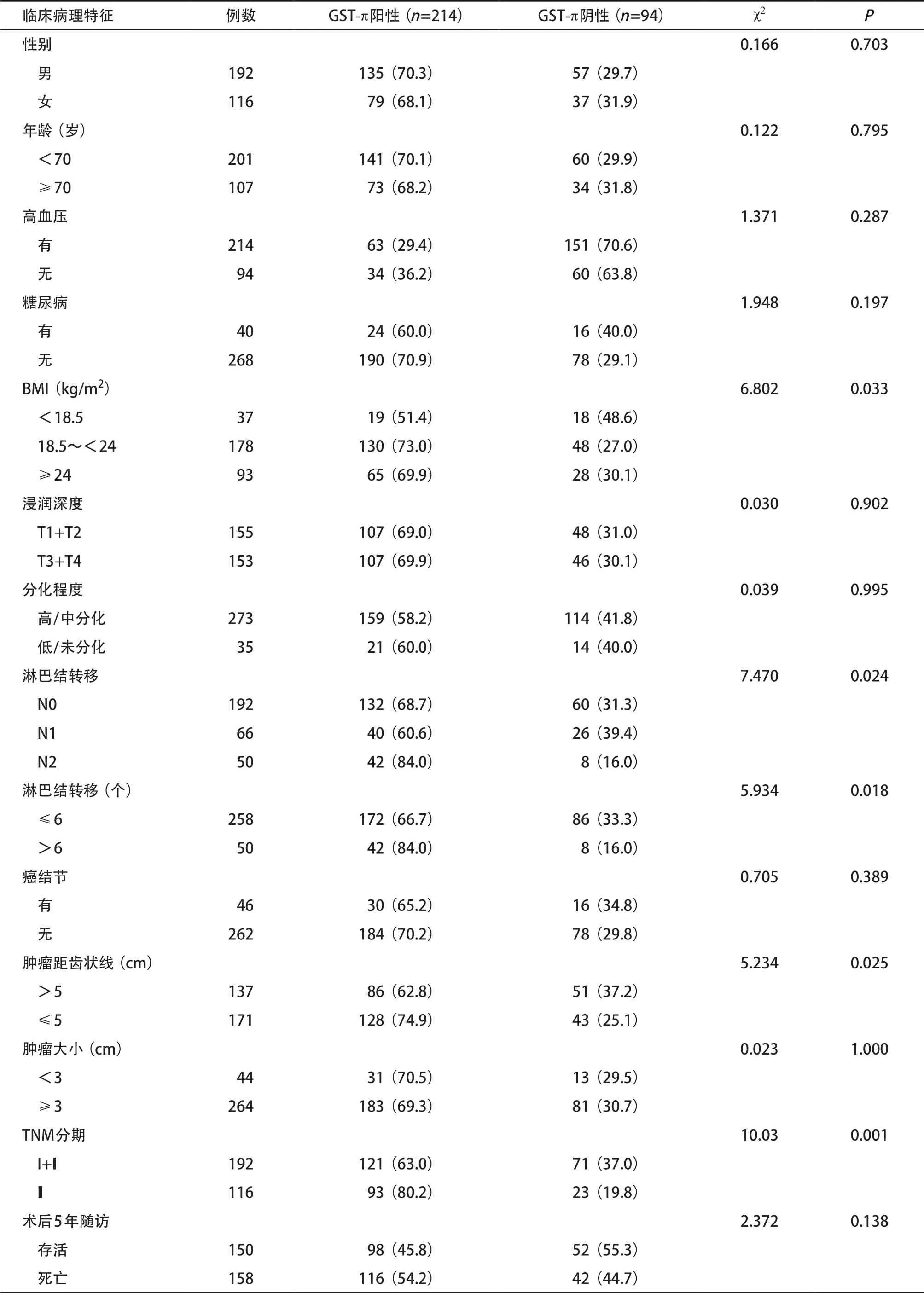
表3 GST-π与直肠癌临床病理特征的关系[例(%)]
2.6 直肠癌组织Ki-67表达与患者BMI的关系 Ki-67及BMI均与患者术后5年生存率相关,进一步分析BMI与Ki-67阳性表达的相关性,超重且Ki-67高阳性表达直肠癌所占比明显低于正常BMI组(P<0.05)。见表4。进一步分析Ki-67高阳性表达的患者术后5年生存率与肥胖或消瘦的关系,Ki-67高阳性表达且正常、消瘦、超重的患者5年生存率分别是45.5%,20.0%,45.9%。分组比较患者术后5年生存率,消瘦组与正常组间差异有统计学意义(P<0.05)。见表5。
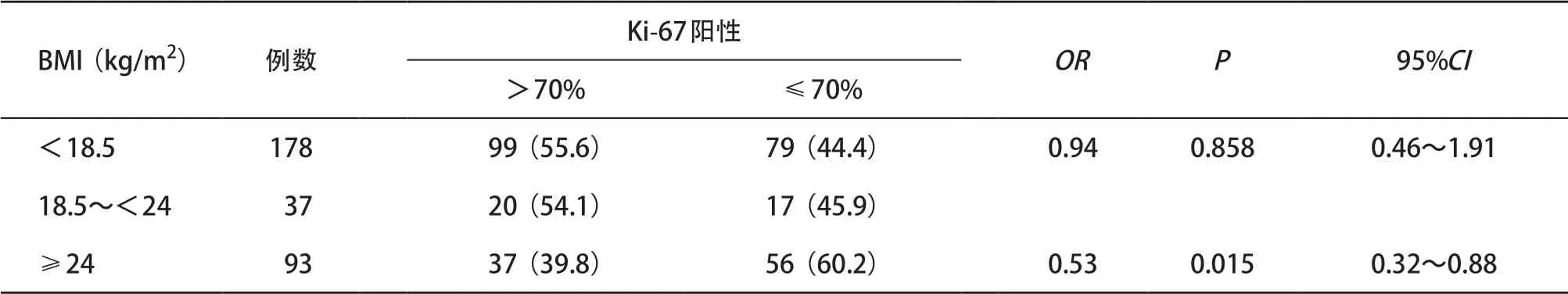
表4 BMI与组织Ki-67表达水平的相关性
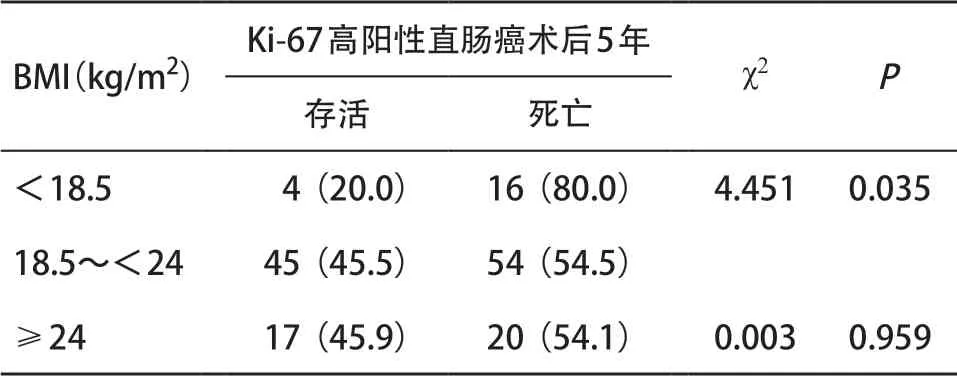
表5 Ki-67高阳性表达患者术后5年生存率与BMI之间的关系
3 讨论
大肠癌是目前全球第三大消化道肿瘤,有研究表明大肠癌的发病危险因素包括肥胖、吸烟、代谢综合征和大肠癌家族史等[4]。世界癌症研究基金会研究表明大肠癌与肥胖密切相关,肥胖被列为大肠癌的独立风险因素[5]。大肠癌的发病率在富裕阶段的民族中更为显着,可能与饮食结构和生活水平有关,但仍有消瘦的大肠癌患者远期预后情况差的结论[6],直肠癌患者BMI与临床特征、病理及远期生存率的研究目前尚无定论。本研究表明直肠癌患者BMI与发病年龄、是否患高血压、肿瘤的大小、肿瘤浸润、TNM分期、组织分化及术后5年生存率相关,而与患者是否有糖尿病、性别、肿瘤位置、癌结节、淋巴结转移不相关。年龄大于70岁的超重患者占比最少,而年纪小于70岁的超重患者占比最多,表明BMI与患者的年龄相关。年龄大于70岁的超重患者占比低,可能与高龄患者机体功能差,肥胖同时有心脑血管方面慢性疾病及死亡率高有关。RIM等[7]研究发现直肠癌患病率男性高于女性,且消瘦人群患III期大肠癌的比例明显高于超重患者。本研究剔除短期内体质量变化较大的病例,发现III期的大肠癌消瘦患者比正常组高,而超重与正常组之间无明显差异。本研究发现患者BMI与肿瘤浸润程度有关,消瘦与直肠癌浸润程度呈正相关(P<0.05)。肿瘤浸润程度为(T3+T4)的超重患者占比明显较高,认为在肿瘤浸润深度及恶性度方面,消瘦的患者风险更高。本研究还发现不同BMI与肿瘤分化程度呈相关性,消瘦组低分化占比较高,明显高于正常BMI组(P<0.05)。同时,正常BMI组、消瘦组、超重组术后5年生存率为52.7%、29.7%、50.6%。与正常BMI组比较,消瘦组患者术后5年生存率低,而超重组5年生存率差异无统计学意义。SHIBAKITA等[8]研究表明低BMI患者肿瘤更容易进展及发生淋巴结及远处转移,可作为大肠癌的独立危险因素之一,与本研究结果相符。
Ki-67是由MKI67基因编码的,与细胞增殖分裂相关的核蛋白,其表达与RNA的转录密切相关。Ki-67高表达提示肿瘤细胞分裂增殖快,肿瘤的侵袭转移能力就越强。Ki-67蛋白的高表达被认为是乳腺癌、前列腺癌、神经内分泌肿瘤等恶性肿瘤预后的不良因素[9-10]。本研究发现直肠癌患者Ki-67的高阳性表达与肿瘤浸润、TNM分期、BMI及术后5年生存率有关,与患者是否有高血压病、糖尿病、年龄大小、肿瘤位置、癌结节及淋巴结转移等因素均不相关。在肿瘤浸润深度方面,本研究发现Ki-67的阳性表达与直肠癌的浸润深度呈正相关,T3+T4期直肠癌患者表现明显,III期的直肠癌较中早期直肠癌高阳性表达高,说明高Ki-67表达提示肿瘤晚期概率大。WANG等[11]研究发现Ki-67高阳性表达大肠癌与肿瘤分期和术后5年低生存率差呈相关性,可作为判断远期预后的指标。Ki-67低阳性组患者术后5年生存率明显高于Ki-67高阳性表达的患者,表明Ki-67低阳性表达的肿瘤患者远期预后较好,而且Ki-67高阳性表达合并消瘦的患者5年生存率更低,说明消瘦与Ki-67的表达水平可作为评估直肠癌恶性度及预后的预测因子。
谷胱甘肽S-转移酶(glutathione S- transferase, GST)是人体内生物转化最重要的II相代谢酶,是大肠癌发病的一个风险因素。JANKOVA 等[12]研究发现GST-π表达高的大肠癌患者如果未接受化疗,那么术后生存率明显比低GST-π表达患者低。罗敏等[13]研究表明GST-π高表达直肠癌患者出现淋巴结转移的概率大。以上研究结果表明高GST-π表达大肠癌患者预后较差。本课题表明直肠癌淋巴结转移与GST-π阳性表达存在正相关性,GST-π高阳性表达患者术后随访直肠癌复发转移的概率越高。III期直肠癌GST-π阳性表达率明显高于(I+II)期直肠癌,而且组织分化越差,GST-π阳性表达率越高,这与之前JANKOVA等[12]研究相符。KIM等[14]研究表明进展期直肠癌患者,肿瘤位置越低,其总体预后情况较差。本研究也发现中低位大肠癌组织GST-π阳性表达比例明显偏高,提示对化疗产生耐药的可能性大,预后不佳。但本研究显示GST-π阳性表达与患者术后5年生存率无关,也可能与研究的样本量有关。
综上所述,本研究揭示了直肠癌患者BMI与肿瘤组织Ki-67的表达存在相关性,可以作为评估大肠癌恶性程度、侵袭转移及预测预后的临床参数。结合分析BMI与GST-π、Ki-67的表达水平及相关性,对评估肿瘤的恶性度、预后情况起到重要作用。

