GLP1R基因多态性与中国汉族人群2型糖尿病风险及血糖、血脂、胰岛功能的关系
郑文文,郑超,周心禾
1.嘉兴市第二医院 内分泌科,浙江 嘉兴 314001;2.浙江大学医学院附属第二医院 内分泌科,浙江 杭州 310009;3.温州医科大学附属第二医院 内分泌科,浙江 温州 325027
胰高血糖素样肽1(glucagon-like peptide-1, GLP-1)主要由小肠远端和近端结肠的肠道L细胞分泌,由胰高血糖素原基因编码,是一种由30个氨基酸组成的多肽[1-2]。GLP-1的特异性靶点为胰高血糖素样肽1受体(glucagon-like peptide-1 receptor, GLP1R),GLP-1通过与GLP1R结合,以葡萄糖依赖方式促进胰岛素分泌,从而维持机体血糖稳态[3]。因此,GLP1R功能受损将会导致胰岛β细胞的功能障碍。
编码GLP1R的人类GLP1R基因定位于6号染色体的短臂(chr 6p21),包含13个外显子[4]。其基因多态性的发生可能导致GLP1R的结构改变,从而使得GLP1R出现功能障碍[5]。在HapMap II期数据库(http://www.hapmap.org)中,共鉴定出33个单倍型标记的单核苷酸多态性(single nucleotide polymorphism, SNP)位点。本研究选择其中3个位点,即rs3765467、rs2268657和rs6923761,目前有关该3个位点的研究数据在我国十分有限。本研究通过探讨GLP1R基因rs3765467、rs2268657和rs6923761多态性与中国汉族人群2型糖尿病(type 2 diabetes mellitus, T2DM)及血糖、血脂、胰岛功能的相关性,为T2DM的病因诊断、治疗及预后提供理论依据。
1 对象与方法
1.1 对象 选取2016年3月至2018年6月温州医科大学附属第二医院的T2DM患者526例,其中男286例,女240例,均符合WHO(1999年)诊断标准,排除1型糖尿病、特殊类型糖尿病、严重肝肾功能损害者、肿瘤等疾病。选取健康志愿者334例作为对照组,其中男183例,女151例。本研究已通过医院医学伦理委员会的批准,所有研究对象均知情同意。
1.2 临床及生化检测 记录研究对象的年龄、性别,并测量身高、体质量,体质量指数(body mass index, BMI)。留取所有研究对象清晨空腹静脉血,由温州医科大学附属第二医院检验科专人测定空腹血糖(fasting blood glucose, FBG)、糖化血红蛋白(HbA1c)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)。另外留取T2DM患者空腹及餐后2 h静脉血,检测空腹C肽(fasting plasma C-peptide, FP-C)、餐后2小时血糖(2-hour postprandial blood glucose, 2hPG)、餐后2小时C肽(2 hours postprandial C-peptide, 2hP-C),并根据FBG及FP-C水平通过HOMA2 calculator(www.dtu.ox.ac.uk/homacalculator/index.php)软件计算获得胰岛β细胞功能指数(HOMA-β),胰岛素敏感指数(HOMA-IS)以及胰岛素抵抗指数(HOMA-IR)。
1.3 基因组DNA提取及检测 留取所有研究对象的2 mL外周静脉血,置于乙二胺四乙酸二钠(EDTANa2)抗凝管中,按照DNeasy血液/组织基因组DNA提取试剂盒(德国Qiagen公司)说明书提取样本DNA。应用竞争性等位基因特异性PCR(kompetitive allele specific PCR, KASP)技术检测GLP1R基因rs3765467、rs2268657和rs6923761三个位点的基因型。步骤如下:先把所有DNA样本进行质检,将质检合格的DNA稀释至浓度为5 ng/μL。取2 μL DNA样本,55 ℃ 45 min烘干,并配置混合物(mix),3 μL体系[包括引物mix及2X KASP master mix(北京梓熙生物科技有限公司)],在ABI 7900仪器上进行预读,然后在ABI 7900 PCR仪中进行PCR反应,94 ℃ 5 min,94 ℃ 20 s,61 ℃ 1 min,10个循环;94℃ 20 s,55 ℃ 1 min,26个循环;72 ℃ 1 min。最后进行基因分型和判读。
1.4 统计学处理方法 采用SPSS20.0软件进行统计分析。基因型频率分布作Hardy-Weinberg平衡检验;计数资料采用例数和百分率表示,采用χ2检验或Fisher精确检验进行组间比较;计量资料中符合正态分布,采用±s表示,不符合正态分布,采用M(P25,P75)表示,分别采用独立样本t检验或秩和检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 T2DM组与对照组一般资料与生化指标比较 T2DM组与对照组在性别、LDL-C、HDL-C方面差异无统计学意义(均P>0.05);T2DM组的年龄、BMI、TG、TC、FBG、HbA1c水平显著高于对照组,差异有统计学意义(均P<0.05)。见表1。
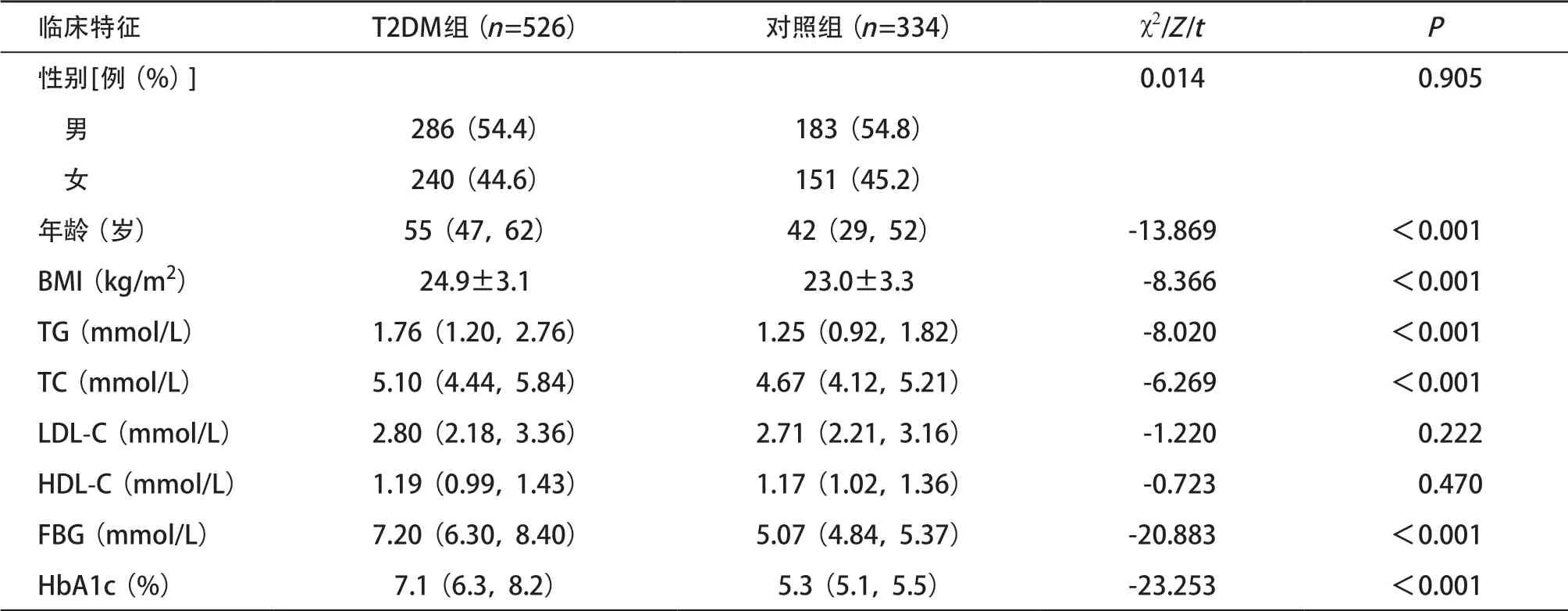
表1 T2DM组与对照组的临床指标比较
2.2 各SNP位点Hardy-Weinberg平衡检验 GLP1R基因rs3765467(C>T)、rs2268657(G>A)、rs6923761(G>A)三个位点分布情况见表2。对对照组中该三个位点的基因型频率进行Hardy-Weinberg平衡检验,三个基因位点分布符合Hardy-Weinberg平衡(P=0.782、0.570、0.759),提示研究样本具有群体代表性。
2.3 各SNP位点基因型和等位基因频率分布 T2DM组GLP1R基因:rs3765467位点CC基因型和C等位基因的频率均高于对照组,差异具有统计学意义(均P<0.05),见表2。在隐性模型中,T2DM组GLP1R基因rs3765467位点CC基因型频率显著高于对照组,差异有统计学意义(P<0.05),见表3。

表2 GLP1R基因各位点基因型和等位基因频率分布[例(%)]

表3 两种遗传模型中GLP1R基因各位点基因型频率分布[例(%)]
2.4 T2DM影响因素的Logistic回归分析结果 以是否发生T2DM作为因变量,以rs3765467隐性模型、年龄、性别、BMI、TG、TC为自变量,进行多因素Logistic回归分析。结果显示,Logistic回归模型在调整了年龄、性别、BMI、TG、TC后,rs3765467位点CC基因型是T2DM发病的独立危险因素,携带CC基因型患者发生T2DM的风险是CT或TT基因型携带者的1.724倍(OR=1.724,95%CI=1.217~2.443,P= 0.002),见表4。
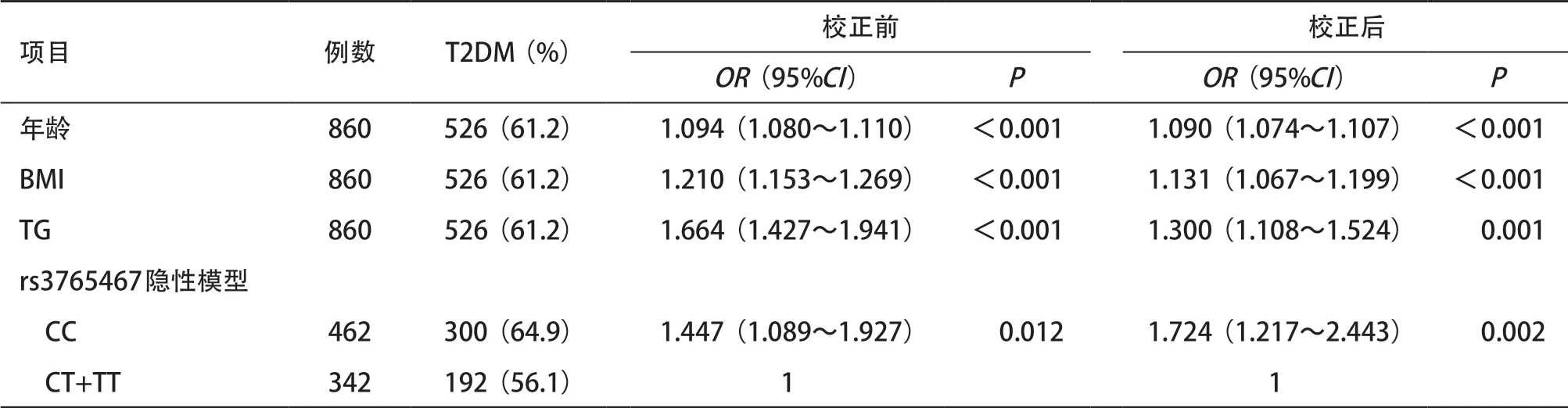
表4 T2DM影响因素的多因素Logistic回归分析
2.5 GLP1R基因多态性与BMI、血脂、血糖代谢关系 在隐性模型中,GLP1R基因(rs3765467、rs2268657、rs6923761)的基因型与BMI、血糖、血脂之间的关系见表5。在GLP1R基因rs3765467位点中,CC基因型HbA1c水平高于CT+TT基因型(t= -2.517,P=0.012);而在GLP1R基因rs2268657位点中,GG基因型HDL-C水平显著高于GA+AA基因型(t= -2.162,P=0.031)。
2.6 T2DM组中GLP1R基因rs3765467位点胰岛功能情况 在T2DM组中,GLP1R基因rs3765467位点CC基因型的FP-C、HOMA-β、HOMA-IR水平均低于CT+TT基因型,差异均有统计学意义(t=1.978,P=0.048;t=2.308,P=0.021;t=2.012,P=0.045),见表6。
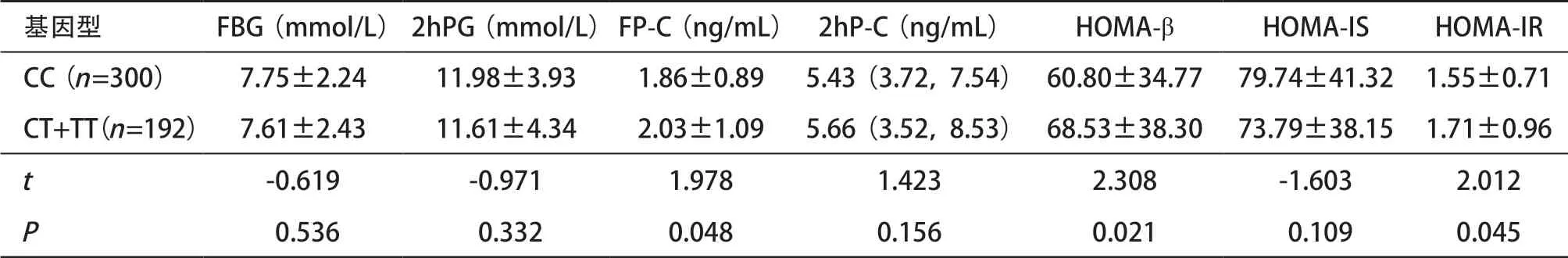
表6 T2DM组中GLP1R基因rs3765467位点胰岛功能比较
3 讨论
已有相关研究发现GLP1R基因多态性与T2DM、肥胖、胰岛素分泌、GLP1R受体激动剂药物疗效等具有相关性[6-8]。在我国鲜有研究发现GLP1R基因rs3765467、rs2268657、rs6923761三个位点与T2DM的发病风险相关,而有关其对代谢指标以及胰岛功能影响的研究更是少见。本研究采用病例-对照研究对中国汉族人群T2DM的GLP1R基因三个位点基因多态性的分布特点及对相关指标的影响进行分析,发现GLP1R基因rs3765467位点基因多态性与T2DM的发病风险明显相关,经过Logistic回归分析校正混杂因素后,发现携带CC基因型者患T2DM的风险是携带CT+TT基因型者的1.724倍,表明CC基因型是T2DM的危险因素。但本研究未发现rs2268657、rs6923761与T2DM的发病风险相关,这可能是由于样本量较少且不同种族中这些位点的表达存在差异,需进一步扩大样本量予以验证。
进一步研究GLP1R基因三个位点与血糖、血脂等代谢指标的关系时发现,rs3765467位点CC基因型HbA1c水平明显高于CT+TT基因型;rs2268657位点GG基因型HDL-C水平显著高于GA+AA基因型。这在既往研究中亦有类似报道,DE LUIS等[9]关于肥胖人群的研究发现,与rs6923761位点GG基因型人群相比,GA/AA基因型人群具有更优的BMI、TG和HDL-C水平。李蕊等[10]的研究则发现,在T2DM人群中,携带rs10305420位点CC基因型者的HDL-C水平明显高于CT/TT基因型者;携带rs3765467位点GG基因型者的TG水平显著低于GA/AA基因型者。但本研究发现的GLP1R基因位点与血糖、血脂的关系与以往的研究不同,补充了既往研究。上述研究表明GLP1R基因变异可能会影响机体的血糖、血脂代谢。
GLP-1通过与胰岛、肠道、脑、肺、肾脏、下丘脑、心脏等器官上的GLP1R结合发挥相应的作用。GLP1R是G蛋白偶联受体B1家族成员,主要在胰岛β细胞内表达,含有463个氨基酸[11]。在胰岛上,GLP-1与胰岛β细胞上的GLP1R结合,激活环磷酸腺苷酶依赖的蛋白激酶A信号通路,从而促进胰岛素释放,抑制胰高血糖素分泌,抑制胰岛β细胞凋亡,促进胰岛β细胞增殖[12]。因此,GLP1R基因变异可能改变GLP1R对体内GLP-1的反应。GLP1R基因rs3765467位点是目前发现的与GLP1R功能改变相关的SNPs之一,该突变是由谷氨酰胺取代了第131位精氨酸[8]。已有研究发现rs3765467位点与胰岛β细胞功能相关。LI等[13]通过研究Roux-en-Y胃旁路术后的肥胖T2DM患者发现rs3765467位点可能通过削弱GLP-1与GLP1R的相互作用导致胰岛β细胞功能障碍和凋亡。NISHIYA等[14]研究也发现在高能量摄入的日本男性研究者中携带rs3765467位点GG基因型者HOMA-β水平明显低于AA+AG基因型者,提示GG基因型可能是降低胰岛素分泌的重大风险。本研究在对携带rs3765467位点的T2DM患者分析中发现,携带CC基因型者空腹C肽、HOMA-β水平显著低于CT+TT基因型者,表明CC基因型可能是胰岛β细胞功能障碍,胰岛素分泌下降的重要风险因素。这与既往研究结果相符。而CT+TT基因型患者HOMA-IR水平明显高于CC基因型患者,提示携带CT+TT基因型者可能更容易出现胰岛素抵抗。这在既往研究中尚未发现,期待进一步扩大样本量来研究明确。
综上所述,本研究初步探讨了GLP1R基因多态性与T2DM之间的相关性,发现GLP1R基因rs3765467位点与中国汉族人群T2DM的风险相关,且相关位点与血糖、血脂及胰岛功能存在一定关联。

