基于CT平扫的影像组学模型在预测老年人腰椎骨质疏松中的价值
蒋乐真,郭艺帆,苏洁惠,林文潇,吴爱琴,白光辉
1.温州医科大学附属第二医院 放射影像科,浙江 温州 325027;2.浙江中医药大学附属第一医院 放射影像科,浙江 杭州 310006
骨质疏松症以骨骼力学强度下降致骨折风险上升为特征[1],其发病率不断升高,现已成为一个不容忽视的公共卫生问题[2]。尽管骨质疏松症的发病率很高,但它具备特定的诊断工具,有效的治疗方案和预防方法,其筛查可以帮助确定哪些患者将从干预中受益,从而潜在地减少其所带来的社会和经济负担[3]。
影像组学涉及到定量指标的提取,即医学图像中的影像组学特征,经高级数据模型算法进一步分析可发现肉眼无法识别的影像特征[4-5]。影像组学分析可能有助于评价小梁骨的微结构变化[6-8]。骨密度(bone mineral density, BMD)只是骨强度一个量化因素,质的因素同样不可缺少,骨质好坏可根据骨组织结构进行评估。影像组学或能将腰椎CT图像中所包含的骨质结构信息量化并应用于诊断。本研究采用腰椎CT平扫图像进行影像组学分析,评估其在中老年人腰椎骨质疏松诊断中的临床价值。
1 对象和方法
1.1 对象 收集2020年7月至2020年10月于温州医科大学附属第二医院行腰椎CT检查及双能X线吸收测定法(dual energy X-ray absorptiometry, DXA)检查的患者。纳入标准:①年龄>45岁;②在腰椎CT检查后1个月内完成DXA检查;③腰椎CT平扫检查中包含薄层CT扫描。排除标准:①患有影响骨代谢的各类疾病;②长期服用糖皮质激素或其他影响骨代谢的药物;③腰椎多发肿瘤,如骨髓瘤、转移瘤等。经筛选共纳入66例,年龄48~92(67.9± 9.0)岁。在这些腰椎中,存在伪影、骨折、压缩变形的腰椎被排除。本研究获得温州医科大学附属第二医院伦理委员会批准。
1.2 方法
1.2.1 腰椎DXA检查及分组:采用美国GE公司的Lunar Prodigy双能X线BMD仪测量腰1~4椎体正位BMD。扫描仪精确度误差为0.68%,最小有意义变化值为1.88%,每日测量前均对仪器质量进行校正。参考骨质疏松的影像学与BMD诊断专家共识[9],根据DXA检查结果将对腰椎进行分组,标准如下:T值≤-2.5标准差(standard deviation, SD)为骨质疏松,T值>-2.5 SD为非骨质疏松(低骨量和正常)。对于患者的骨质疏松症诊断,除沿用上述相同标准外,一旦影像学检查确诊脆性骨折,无论DXA的检查结果是否达到骨质疏松诊断标准,该患者即可诊断骨质疏松[9]。根据是否具有骨质疏松进行分层抽样,以7:3的比例将各腰椎分配至训练组和验证组。训练组中所有腰椎都被用来训练预测模型,而验证组中的腰椎被用来评价预测模型的性能。
1.2.2 腰椎CT检查:采用Philips Brilliance 16 螺旋CT机及GE Optima CT660 CT机,扫描方法:患者仰卧位,双手上举抱头,行腰椎螺旋扫描。扫描范围:根据腰椎侧位定位像,包括腰1至腰5椎体。扫描条件:管电压120 kV,管电流250 mAs,层厚 1 mm,层间隔1 mm,螺距1.063。
1.2.3 图像分割:将腰椎CT平扫薄层图像导入3D Slicer 4.10.0软件中,对腰椎CT平扫图像中的三维感兴趣(region of interest, ROI)逐层勾画。首先,沿着腰椎椎体骨皮质内侧缘、椎体与椎弓根交界处手动勾画得到ROI-A,骨岛、增生及终板变性等异常区将从ROI-A中手动剔除。然后,在ROI-A的基础上,使用Margin模块中的Shrink功能将ROI-A边缘向内缩减2 mm以得到最终用于特征提取的三维ROI-B(见图1)。所有腰椎ROI勾画均由医师A(从事骨肌影像诊断工作9年)完成。间隔1个月后,随机选择30个腰椎由医师A和B(医师B,从事骨肌影像诊断工作7年)分别勾画,分别用于观测者内与观测者间的一致性检验。
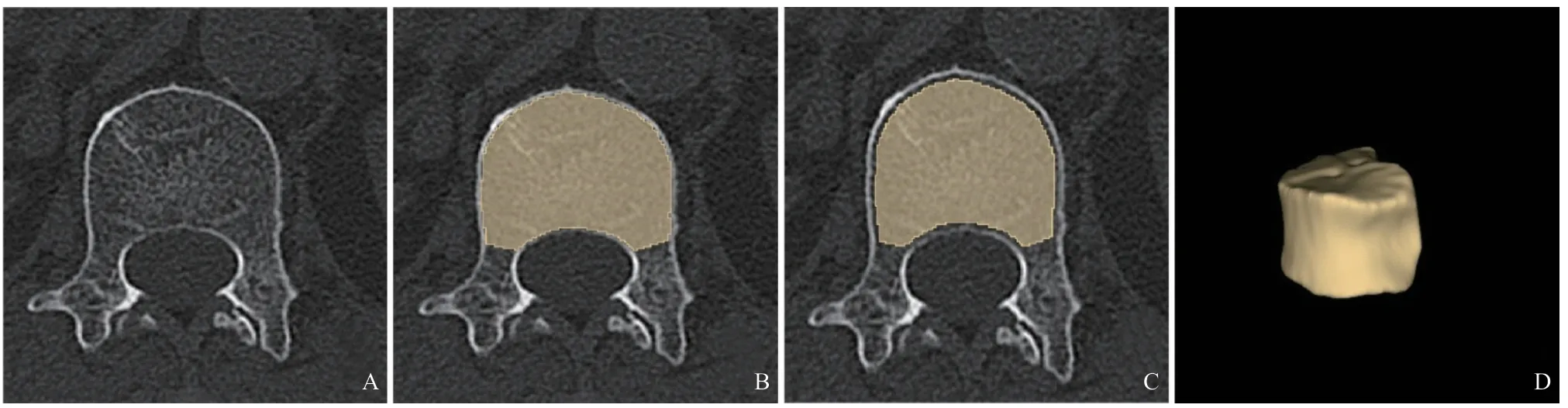
图1 腰椎椎体骨松质ROI手动勾画示意图
1.2.4 影像组学特征提取:应用AK软件(Artificial Intelligence Kit,GE Healthcare,美国)中的PyRadiomics模块进行影像组学特征提取,共提取 1 316个特征,可大致分为以下几类:一阶特征,形状特征,灰度共生矩阵(gray level co-occurrence matrix, GLCM),灰度尺寸区域矩阵(gray level size zone matrix,GLSZM),灰度游程长度矩阵(gray level run length matrix,GLRLM),邻域灰度差矩阵(neighbouring gray tone difference matrix, NGTD),灰度相关矩阵(gray level dependence matrix, GLDM)。本研究提所取影像组学特性的详细描述可参见PyRadiomics文档 (http://pyradiomics.readthedocs.io)。
1.2.5 影像组学特征选择与影像组学模型构建:计算组内相关系数(interclass correlation coefficient, ICC)以评估观察者内和观察者间的一致性,ICC值>0.90的特征将被保留。对符合一致性要求的特征数据进行预处理,包括使用中位数替换异常值及缺失值,然后进行数据标准化,以消除量纲的影响。在完成数据预处理后,使用最大相关性最小冗余度(min-redundancy and max relevance, mRMR)算法对特征进行降维,消除冗余和不相关的特征,本研究将保留了10个特征。使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO) Logistic回归算法从保留的特征中选取出与腰椎骨质疏松诊断最相关的非零系数特征,并对所选特征相应的加权系数进行线性组合,以计算每个腰椎体影像组学评分(Rad-score)。采用受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under the curve, AUC)、准确率、灵敏度、特异度评估影像组学模型预测性能。通过绘制校准曲线和Hosmer-Lemeshow检验评价模型拟合度,P>0.05表明没有偏离拟合。
1.3 统计学处理方法 采用R3.6.1进行数据分析。计量资料以±s表示,2组间比较采用独立样本t检验;计数资料以例和率表示,2组间比较采用χ2检验。使用Wilcoxon秩和检验进行Rad-score的组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 在纳入的66例受检者中,患有骨质疏松症的患者43例,未患有骨质疏松症的患者23例。共有264个腰椎,其中237个腰椎符合研究要求,根据DXA检查结果,骨质疏松组的腰椎共95个,非骨质疏松组的腰椎共142个。骨质疏松症患者与非骨质疏松症患者的年龄、体质量指数差异均无统计学意义(P>0.05),性别差异有统计学意义(P<0.05)。见表1。
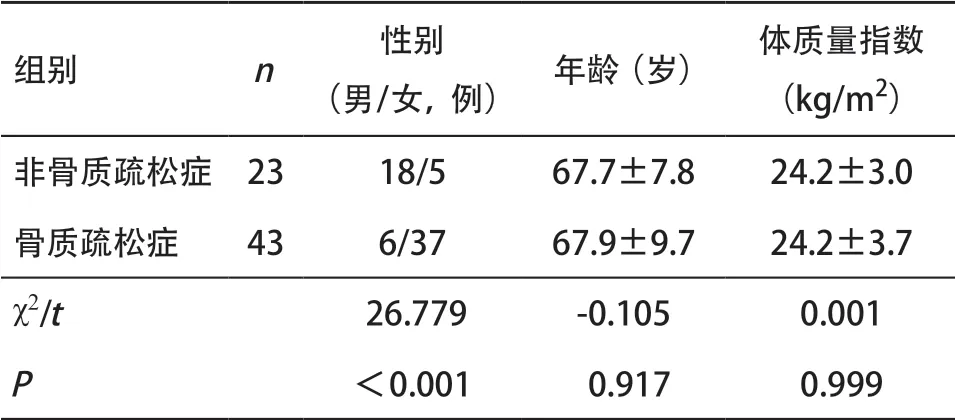
表1 骨质疏松症和非骨质疏松症患者的一般资料比较
2.2 影像组学模型构建与评估 从ROI中共提取1 316个影像组学特征。在观察者内和观察者间一致性检验中,ICC值>0.90的特征共有871个。采用mRMR算法进行特征去冗除杂,保留前10个相关性大的特征。接着使用LASSO算法和十折交叉验证将保留的特征精简为7个最优的特征,并基于这些特征构建影像组学模型(见图2A)。构建模型的特征乘以各自对应系数之和,即是对应患者的Rad-score(见表2)。训练组和验证组中骨质疏松腰椎的Radscore均高于非骨质疏松腰椎,且差异有统计学意义(均P<0.001,见图2B)。

表2 筛选出的影像组学特征及其相应系数
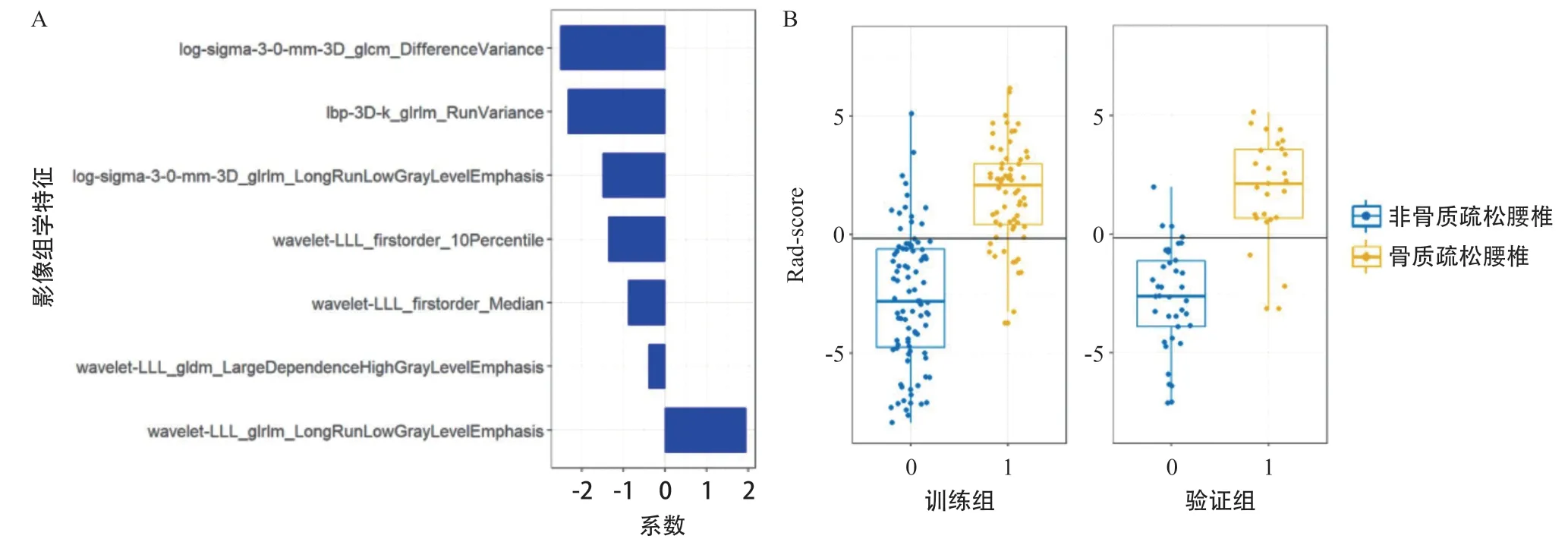
图2 影像组学模型构建特征以及骨质疏松腰椎和非骨质疏松腰椎Rad-score在训练组、验证组中的差异
影像组学模型在训练组和验证组的AUC值分别为0.908(95%CI=0.863~0.952)和0.935(95%CI= 0.873~0.996),显示该模型对腰椎骨质疏松良好的预测能力(见图3)。校准曲线表明影像组学模型的诊断结果与DXA检查结果间一致性在训练组及验证组均较好(见图4),且经Hosmer-Lemeshow检验显示均P>0.05。
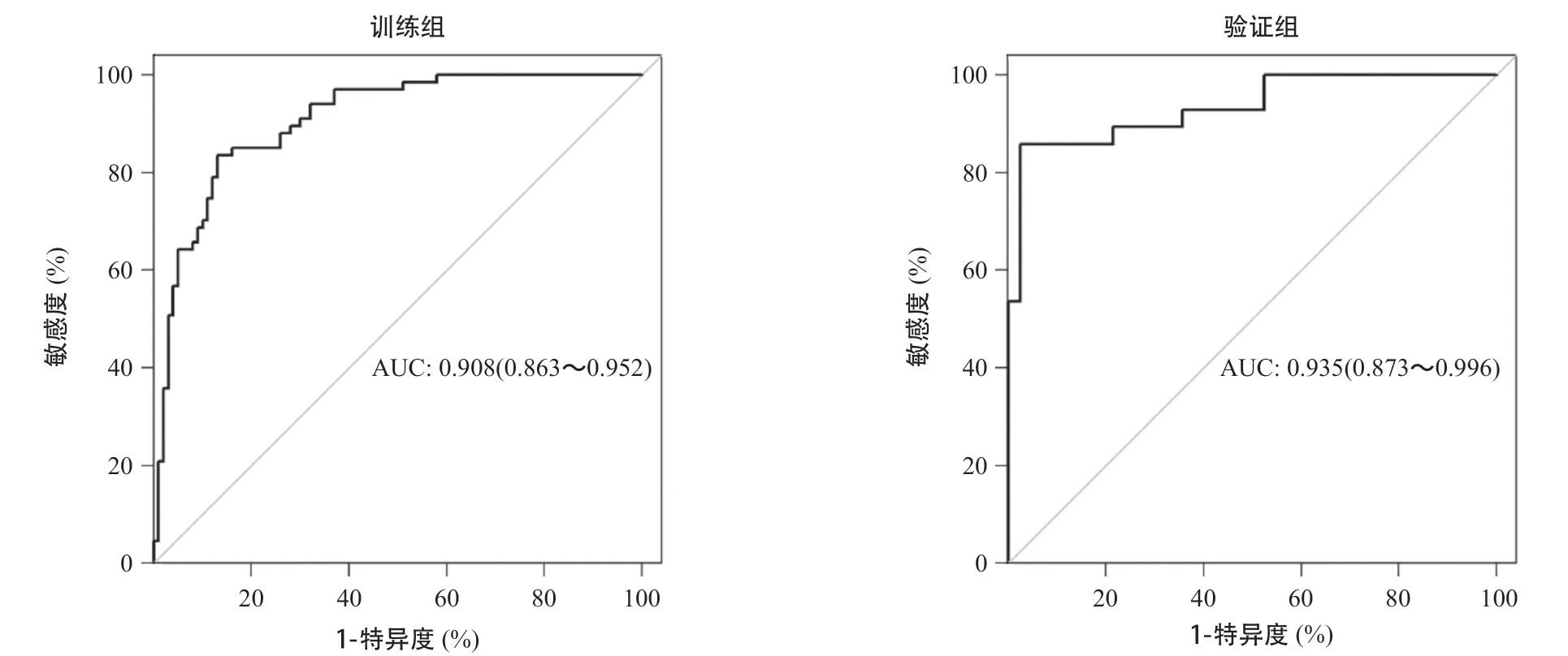
图3 基于CT平扫影像组学模型预测腰椎骨质疏松的ROC曲线
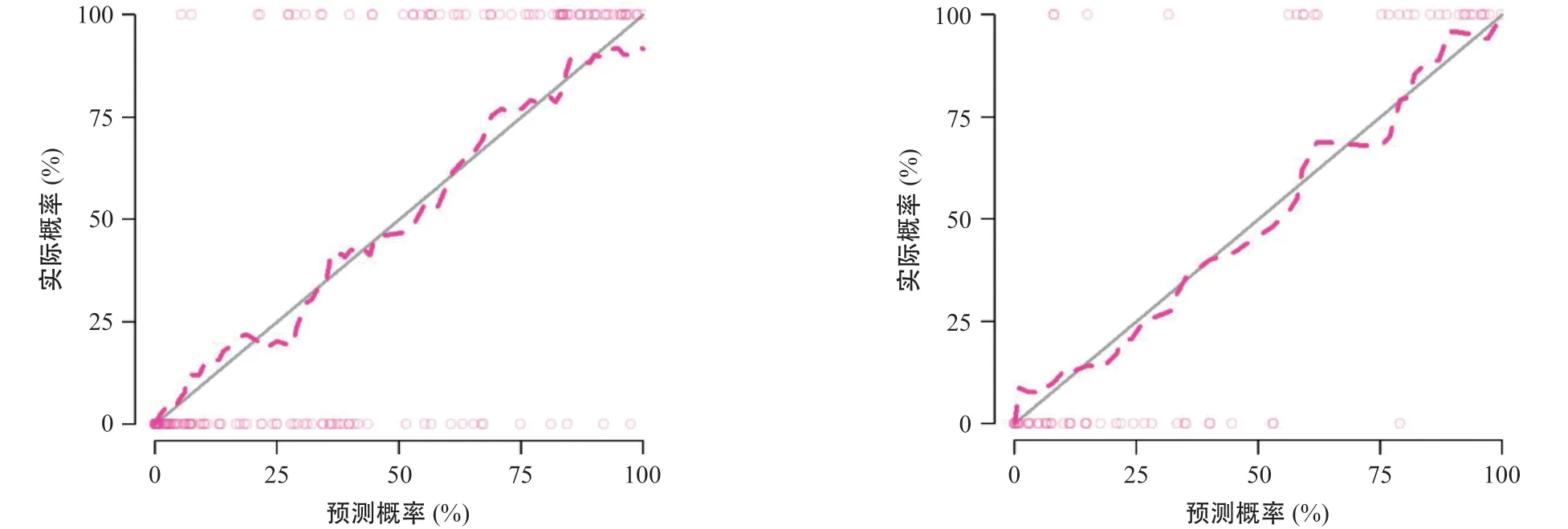
图4 影像组学模型校准曲线
3 讨论
骨质疏松症是一种以骨骼脆性增加为特征的疾病,该病的发生主要归咎于BMD和骨质量的减低,背痛、无明显创伤的骨折(通常发生于脊柱、髋部、桡骨远端和肱骨近端)和BMD减低是其常见的临床表现。在骨质疏松症的诊断中,BMD的测量具有重要价值,目前DXA和定量CT(quantitative computed tomography, QCT)是BMD测量的主要技术手段[9]。DXA辐射剂量低,是当前BMD测量中应用广、认可度高的一种手段,腰椎、髋部及前臂是其主要的测量部位[9]。由于DXA的平面投影成像技术原理,体质量、脊柱侧凸、骨质增生、椎体骨折和血管钙化等因素均会影响DXA的BMD测量,导致测量结果的准确性下降、骨质疏松患者的漏诊[10-11]。 QCT的测量结果并不受脊柱退变、侧凸和体质量等因素影响[12],相对于DXA能够提供更为准确的诊断。然而,辐射剂量一直是临床和患者持续关注的问题。单独QCT扫描的辐射剂量高于DXA,应采用低剂量CT扫描技术,但QCT被推荐与胸、腹部或髋部等CT扫描同时进行而不增加额外的辐射剂量[13]。本研究所构建的影像组学模型同样不需要在原有检查中增加额外的辐射剂量,同时为单个腰椎骨骼脆性评估提供了骨质相关的定量结果。此外,腰椎一直是DXA和QCT测量BMD常用部位,而基于腰椎CT平扫所建立的影像组学模型在临床实践中有着庞大的受众。已有研究者通过腰椎MRI建立影像组学模型对骨质疏松症进行分析得到较高的诊断价值,但对于有幽闭恐惧症、体内有金属植入物等无法进行磁共振检查的患者有一定局限性,且时间长、费用较高。本研究采用CT检查,虽存在一定的辐射性,但覆盖面广、成本低、速度快、受众人群多。因此,本研究基于腰椎CT平扫构建的中老年人腰椎骨质疏松预测模型是适应当前临床环境的。
影像组学特征能够反映组织和病变的特征,如异质性和形状,大致可分为以下几类:基于统计学的、基于模型的、基于变换的、基于形态学的、基于锐利度的[4]。每种分类都包含不止一种特征提取算法,而每一种算法都可生成多种影像组学特征。研究发现,于CT图像上提取的腰椎骨松质一阶直方图特征能够反映骨骼完整性,但与BMD无关[14]。BMD是骨强度一个量化因素,质的因素同样不可缺少,两者关系密切。在骨质疏松椎体中,骨量丢失导致骨小梁变细、数量减少、小梁间隙增大,黄骨髓随之增加[15-18]。因此,腰椎骨松质异质性主要受黄骨髓及骨小梁比例、排布的影响,而该骨松质异质性实际上是骨质好坏的评价指标。与肿瘤异质性分析不同,骨骼异质性可以在高分辨力QCT图像上被肉眼观测[19]。随着骨结构分析的不断深入,已有研究结果表明骨结构分析在诊断骨质疏松症和骨折风险评估中也具有重要价值[20-21]。因此,通过影像组学定量分析腰椎骨松质异质性,将骨质好坏的评估定量化、数据化,可帮助临床更好地诊断和评估骨质疏松症。本研究共提取的影像组学特征在数量和种类上繁多,经过特征降维,最终筛选出7个特征用于构建影像组学模型,该模型在训练组和验证组中均表现出较高的预测效能,训练组和验证组的AUC值分别为0.908(95%CI=0.863~0.952)和0.935(95%CI=0.873~0.996)。鉴于既往研究发现与本研究结果,我们推测影像组学特征能够较好地反映腰椎骨松质的异质性,进而构建出能够较为准确预测腰椎BMD的模型。
本研究存在一定的局限性:本研究样本量偏小,没有设立外部验证组,过拟合问题可能存在,将来需要进行采集大样本多中心数据构建预测模型并进行外部验证;由于目前尚缺乏成熟的全自动勾画软件,该影像组学模型在实际工作中应用存在一定的难度。手工勾画的时间成本较高且存在一定主观因素影响,故腰椎骨松质全自动勾画软件是迫切需要的;腰椎DXA的BMD测量受到诸多因素的影响,以其检查结果评估腰椎骨量丢失存在一定的误差,将来需要采用QCT以更准确地测量腰椎BMD。
综上所述,影像组学能够在CT平扫图像中挖掘与腰椎骨松质异质性相关的定量特征,而基于这些特征所构建的影像组学模型可以较好地用于中老年人腰椎骨质疏松的预测。本研究所建立的影像组学模型,仅基于临床易获取的常规腰椎CT平扫检查便可预测骨质疏松,不会额外增加患者检测负担,具有方便、无创、可重复的特点,故在临床应用中具有较好的前景,可认为是一种潜在的骨质疏松症筛查工具。

