乳腺黏液微乳头状癌1例
王园园,魏红权,刘珺,韩小于,沈增丽,潘庆
浙江省立同德医院 病理科,浙江 杭州 310000
乳腺黏液癌是一种比较少见的,呈惰性生物学行为,预后较好的浸润性乳腺癌亚型。本病一般好发于中老年女性,罕见发生于年轻女性。组织病理形态特点之一是可见大量细胞外黏液,肿瘤细胞可呈梁索状、实性片状、实性乳头状或筛状漂浮在黏液中,少数情况下肿瘤细胞可呈微乳头状。微乳头状结构的存在一般提示预后不良,黏液微乳头状癌总生存期和无复发生存期明显低于传统单纯性黏液癌。笔者报道1例发生于年轻女性的乳腺黏液微乳头状癌病例,以提高临床和病理医师对本病的认识。
1 病例资料
患者,女,38岁,因“发现右侧乳房肿块1个月”于2015年7月10日就诊于浙江省立同德医院。患者1个月前无意中发现右侧乳房肿块,表面皮肤无红肿、疼痛,无乳头溢液,发病以来肿块无明显增大。专科体格检查:双侧乳房对称,未见乳头凹陷及橘皮征,触诊右乳内下象限可及一个鹌鹑蛋大小肿块,质中,边界清,可移动,无压痛,左乳未及明显肿块。双腋下及双锁骨上淋巴结无肿大。影像学检查:乳腺超声提示低回声团块。随后局麻下行右乳肿块切除术,术中右侧乳房内下象限近乳晕处见一个2.5 cm×2.0 cm大小的肿块。
病理检查:淡黄灰白组织及透明胶冻样物一堆,大小分别为2.5 cm×2.2 cm×1.5 cm和 1.5 cm×1.5 cm×0.4 cm,灰白组织切面实性,质中。镜下观察:大量细胞外黏液被纤维组织分隔成大小不等的黏液湖,其中漂浮有微乳头状细胞团,细胞团外缘呈锯齿状,部分有中央腔隙但无纤维血管轴心(见图1A)。肿瘤细胞形态大小较一致呈立方或柱状,细胞边界不清,有的相互融合呈合胞体样。胞浆嗜酸性,胞核深染,核仁不明显,伴轻-中度异型增生,部分细胞呈“鞋钉样”(见图1B),未见明显核分裂象及砂砾样钙化。黏液区周围为伴有扩张导管的实性区域,部分导管上皮细胞呈复层排列伴轻-中度异型增生及微乳头状增生(见图1C),导管腔内充满黏液。免疫组织化学染色(见图2)微乳头结构:上皮膜抗原(epithelial membrane antigen, EMA)、黏蛋白1(mucin 1, MUC1)周边阳性(极性倒转),雌激素受体(estrogen receptor, ER)(2+,70%),孕激素受体(progesterone receptor, PR)(2+,65%),P63、钙结合蛋白(Calponin)残存的小灶肌上皮阳性,细胞角蛋白(cytokeratin, CK)5/6、c-erbB-2(HER2)、突触素(synaptophysin, SyN)、嗜铬素A(chromogranin A, CgA)、CD56阴性,Ki-67阳性指数15%;实性区:ER(2+,70%),PR(2+,70%),P63、Calponin肌上皮阳性,HER2、CK5/6阴性,Ki-67阳性指数5%。病理诊断: (右乳)黏液微乳头状癌,周围见部分低级别导管原位癌,微乳头亚型,未见淋巴管和血管侵犯。临床进一步行乳腺区段扩大切除术+前哨淋巴结活检术,术后病理检查,原手术野未见癌组织残留,(上、下、内、外、基底)各手术切缘阴性,前哨淋巴结4颗未见癌转移。术后随访3年无复发转移。

图1 肿瘤组织病理染色
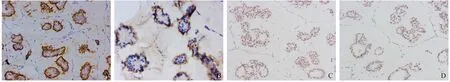
图2 免疫组织化学染色EnVision法检测肿瘤组织相关蛋白表达
2 讨论
乳腺黏液癌临床罕见,占所有乳腺癌的1%~7%[1]。纯黏液癌(pure mucinous carcinoma of breast,PMC)的细胞外黏液成分大于90%,PMC又进一步分为A型和B型,A型细胞少,无神经内分泌分化,B型富细胞,具有不同程度的神经内分泌分化。PMC的肿瘤细胞可以呈实性片状、筛孔状、小簇状漂浮在细胞外黏液内。少数情况下肿瘤细胞可以排列成小实心桑椹样或是类似大小的中空小管状结构,但缺乏纤维血管轴心,即微乳头状结构。2002年NG等[2]报道了5例黏液微乳头状癌(mucinous micropapillary carcinoma,MUMPC),并首次将其作为一种新的黏液癌亚型提出。MUMPC作为PMC的一个特殊亚型,是否可以被识别为一种形态学、临床或基因都不同于PMC的肿瘤目前仍存在争议。
在LIU等[3]的一项回顾性研究中,MUMPC患者的总生存期和无复发生存期明显低于PMC,并且微乳头状特征被证实为黏液癌无复发生存期的独立不良预后因素。但在XU等[4]的研究中,所有乳腺黏液癌病例均呈低至中核级别的弥漫性或局灶性微乳头状结构,且均未发生局部复发或远处转移。因此他们认为MUMPC的临床病理特征,如高核分级、HER2扩增,可能是其临床行为的主要原因,而不是微乳头状结构本身。但更多的研究表明[5-6],与PMC相比,MUMPC发病年龄更早,常表现出更高的核级、更高的组织学分级、更高的淋巴结转移率、更高的淋巴血管浸润率、更高的Ki-67指数和更多的HER2扩增病例数以及更短的无进展生存和远处无病生存期。并且微乳头状结构的占比、淋巴血管浸润率和肿瘤大小被认为是淋巴结转移的显著和独立不良预后因素。因此MUMPC在临床表现和疾病预后上还是与PMC有着明显不同的,也进一步提示理医师在诊断时应该评估肿瘤细胞的核级和微乳头状结构的占比,以更有利于临床医师识别出那些存在不良预后风险的患者。另外,分子遗传学上[6],MUMPC和PMC有部分分子改变重叠,但TTN、PIK3CA突变更多见于PMC,而GATA3、TP53和SF3B1突变则多见于MUMPC。因此MUMPC与PMC在基因上也可能存在一定差异。
PMC是一种预后良好的呈惰性生物学行为的肿瘤,治疗上可采取乳腺区段切除或单纯切除术,也可术后结合激素受体的检测情况辅以有限的内分泌治疗,考虑到MUMPC发生淋巴血管浸润和淋巴结转移的风险较高,一些学者建议MUMPC应更积极地进行前哨淋巴结活检和(或)腋窝淋巴结清扫,根据淋巴结情况评估是否进行更积极的术后治疗[3,6-8]。本例术前B超提示低回声团块,采取单纯肿块切除术,术后病理回报为乳腺MUMPC,低-中核级,微乳头比例>90%,后进一步行扩大切除术,术后病理检查示前哨淋巴结未见癌转移,为临床I期;免疫标记ER、PR弥漫阳性,HER2阴性、Ki-67阳性指数为15%,术后随访3年无复发转移。
因MUMPC的特殊生物学行为,明确诊断显得尤为重要,在病理诊断上主要需要与以下两种疾病进行鉴别:①乳腺浸润性微乳头状癌:光镜下二者的细胞排列模式相同,免疫组化标记EMA阳性部位均位于肿瘤细胞团的间质侧。但二者的区别在于MUMPC肿瘤细胞周围的收缩空隙被多少不等的黏液(占肿瘤体积的30%~90%)[8]所占据。②普通PMC:MUMPC为PMC的一个特殊亚型,一般来说,要求黏液癌中微乳头状肿瘤成分达到50%才可诊断,MUMPC中出现的“鞋钉”样细胞、周围黏液中的砂砾样钙化及肿瘤周围同时伴发的微乳头状导管原位癌都可以作为诊断的佐证,免疫组织化学染色MUMPC常表达MUC1而普通的PMC则表达MUC2和MUC6。
总之,MUMPC是PMC的一种特殊亚型,其形态、生物学行为和分子特征与PMC均有一定的差别。目前国内外的报道有限,对于病理医师来说,在黏液癌中辨别微乳头状结构的存在十分重要,因为微乳头通常更具侵袭性,同样也影响治疗的选择。

