鞘内注射瞬时受体电位通道A1 shRNA 对部分坐骨神经结扎小鼠神经病理性疼痛的作用及其机制
赵 峰, 樊少卿, 程晓燕, 李小娜, 李长生, 马浩杰
(1.河南省中医院麻醉科,河南 郑州 450002;2.河南省肿瘤医院麻醉与围术期医学科,河南 郑州 450003)
神经病理性疼痛是一种由损伤或疾病影响躯体感觉系统引起的慢性疼痛,其发病机制复杂,临床治疗效果不佳[1]。星形胶质细胞在中枢神经系统中大量存在,与突触有密切联系,并且产生趋化因子,参与神经病理性疼痛的发生发展,星形胶质细胞的激活在神经性疼痛中发挥重要作用[2]。瞬时受体电位通道A1(transient receptor potential cation channel subfamily A member 1,TRPA1)是 瞬 时受体电位(transient receptor potential,TRP)通道家族的一员。TRP 通道是一种非选择性钙离子(Ca2+)通透性阳离子通道,通过介导Ca2+内流导致内质网Ca2+水平升高,引起神经递质的释放产生疼痛[3]。采用TRP 通道拮抗剂能减轻神经病理性疼痛[4-5]。TRPA1 不仅参与调节炎症性疼痛、痛觉过敏和炎性疾病,还参与神经病理性疼痛的发生[6-7]。但目前关于TRPA1在部分坐骨神经结扎(partial sciatic nerve ligation,pSNL)小鼠神经性疼痛模型中的作用及其机制尚不明确。本研究观察TRPA1 在pSNL 小鼠神经病理性疼痛模型中的作用,探讨TRPA1 是否可以通过影响星形胶质细胞的激活参与神经病理性疼痛的发生发展过程,以及其发挥作用的具体机制,为研究神经病理性疼痛的发病机制及治疗方法提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器30只SPF级雄性C57BL/6 小鼠,8~10周龄,体质量20~25 g,购自成都达硕实验动物有限公司,动物使用许可证号: SYXK(川)2019-189。RIPA 蛋白裂解液和PMSF 蛋白酶抑制剂(北京索莱宝科技有限公司),兔抗TRPA1 抗体(1∶1 000,美国Proteintech 公司),兔抗蛋白激酶C ε 型(protein kinase C epsilon type,Prkce)抗体(1∶1 000)、兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(1∶5 000)、兔抗GAPDH 抗体(1∶5 000)和山羊抗兔IgG 抗体(1∶2 000,英国Abcam 公司)。动态足底触觉仪和智能热板仪(天津伯尔尼科技有限公司),Multiskan FC 酶标仪和-80℃超低温冰箱(美国Thermo Fisher Scientific 公司),美国伯乐蛋白电泳仪和蛋白转膜仪(美国Bio-Rad 公司)。
1.2 小鼠pSNL 模型的建立和分组30只小鼠随机分为对照组(6只)、假手术组(6只)和pSNL组(18只)。pSNL组小鼠经4% 水合氯醛腹腔注射麻醉后,于左侧股骨后外侧作一切口,分离并暴露坐骨神经主干,采用8-0 丝线结扎1/3~1/2 的坐骨神经直径厚度。假手术组小鼠切开皮肤肌肉找到神经后不结扎直接缝合切口,对照组小鼠不进行任何处理,小鼠麻醉清醒后自由进食饮水。为观察TRPA1 对pSNL 所致神经病理性疼痛的影响,pSNL组小鼠鞘内置管成功后随机分为pSNL模型组、pSNL+NC短发夹RNA(short hairpin RNA,shRNA)组 和pSNL+TRPA1 shRNA组,每组60只。pSNL+TRPA1 shRNA组小鼠于术后第7天鞘内注射TRPA1 shRNA。TRPA1 shRNA 由河南省中医院中心实验室构建并保存。
1.3 各组小鼠行为学观察于注射前和注射后l、7、12 及24h检测各组小鼠术侧后肢的机械缩足反射阈值(mechanical withdrawal threshold,MWT)和热阈值(thermal withdrawal latency,TWL)。采用动态足底触觉仪测量各组小鼠的MWT,打开电源,将最大强度设置为50 g,然后将小鼠置于塑料网格中自由活动。小鼠安静下来后,将探针对准左肢的足底中央,逐渐增加力度,当小鼠出现缩足现象时,记录数值,即为MWT。采用智能热板仪测定TWL,打开热板仪,将温度设置为(52.0±0.2)℃,然后将小鼠放入,记录小鼠有明显抽搐欲逃离所需的时间,即为TWL。实验重复3次,取平均值。
1.4 细胞的分离培养和处理人胚胎肾(human embryonic kidney,HEK)-293T 细胞培养于含10%胎牛血清的高糖DMEM 培养基,置于含5% CO2、37℃细胞培养箱中进行培养。从pSNL组小鼠中分离培养原代星形胶质细胞,采用Lipofectamine 2000分别转染TRPA1、Prkce 腺病毒表达载体和shRNA,继续培养48h后进行后续实验。TRPA1、Prkce 腺病毒表达载体和shRNA 由河南省中医院中心实验室构建并保存。
1.5 Western blotting 法检测各组小鼠术侧背根神经节(dorsal root ganglion,DRG)中TRPA1、Prkce和GFAP 蛋白表达水平采用胰酶消化各组小鼠术侧DRG,加入RIPA 裂解液于冰上裂解20 min,低温高速离心30 min 收集上清,即裂解的蛋白样品。经BCA 法检测蛋白浓度后,将蛋白样品加相应体积的4×loading buffer 煮沸使蛋白变性。等量蛋白样品经12% SDS-PAGE分离后,将目标蛋白条带转移至PVDF 膜上,5% 脱脂奶粉室温封闭2 h,4℃过夜孵育相应的一抗。次日,TBST 漂洗后,室温孵育HRP 标记的二抗1 h,漂洗后采用ECL 发光液检测目的蛋白表达水平。采用ECL 液显影,采用化学发光试剂盒在化学发光系统中检测,采用Image-ProPlus 6 软件分析条带灰度值,以目的蛋白条带灰度值与内参GAPDH 条带灰度值的比值作为目的蛋白表达水平。
1.6 各组细胞中TRPA1 和GFAP 蛋白的表达及血清中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)水平分离培养pSNL组小鼠的原代星形胶质细胞,转染TRPA1 腺病毒表达载体或shRNA继续培养48 h,分为空质粒组、Ad-TRPA1、sh-NC组和sh-TRPA1组。采用Western blotting 法检测各组细胞中TRPA1 和GFAP 蛋白表达水平(方法见 “1.5”)。动物模型血液样本经离心收集血清后用于炎症因子的检测。按照TNF-α和MCP-1 ELISA 检测试剂盒说明书进行操作。
1.7 免疫共沉淀(co-immunoprecipitation,Co-IP)法验证TRPA1 和Prkce 的相互作用将HEK-293T 细胞接种于6 孔板,采用Lipofectamine 2000转染TRPA1 腺病毒表达载体和Prkce 腺病毒表达载体。48h后离心收集细胞,加入含PMSF 的细胞裂解液于冰上裂解30 min。裂解液与TRPA1 抗体孵育过的磁珠于4℃过夜孵育。次日,采用PBST洗涤磁珠后,加入洗脱液洗脱蛋白复合物,采用Western blotting 法检测洗脱液中TRPA1 和Prkce蛋白的表达。操作过程中设置IgG 抗体孵育的磁珠作为对照以排除非特异性结合。
1.8 各组细胞中TRPA1、Prkce 和GFAP 蛋白表达水平及细胞上清中TNF-α 和MCP-1 水平为进一步检测TRPA1 及互作蛋白Prkce 对星形胶质细胞激活的影响,将TRPA1 shRNA 单独转染或与Ad-Prkce 共转染星形胶质细胞分为sh-TRPA1+empty vector组(转染空载体)和sh-TRPA1+Ad-Prkce组(转染Prkce 过表达载体)。48h后采用Western blotting法检测各组细胞中TRPA1、Prkce和GFAP 蛋白表达水平(方法见 “1.5”),ELISA 法检测各组细胞上清中TNF-α 和MCP-1 水平(方法见 “1.6”)。
1.9 统计学分析采用SPSS 23.0 统计软件进行统计学分析。各组小鼠MWT 和TWL,小鼠DRG组织中TRPA1 及GFAP 蛋白表达水平,小鼠血清和细胞上清中TNF-α 和MCP-1 水平,各组细胞中TRPA1、Prkce 和GFAP 蛋白表达水平,以±s 表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠MWT 和TWL小鼠部分行pSNL后第7天鞘内注射TRPA1 shRNA,于注射前和注射后l、7、12 和24h检测小鼠术侧后肢MWT 和TWL 结果显示: 与假手术组比较,pSNL组小鼠MWT 和TWL 降低(P<0.01),表明模型构建成功。与pSNL组比较,pSNL+ NC shRNA组小鼠MWT 和TWL 差异无统计学意义(P>0.05),而pSNL+TRPA1 shRNA组小鼠MWT 和TWL 明显升高(P<0.01)。见表1 和2。
表1 各组小鼠的MWTTab.1 MWT of mice in various groups (n=6,±s,g)

表1 各组小鼠的MWTTab.1 MWT of mice in various groups (n=6,±s,g)
*P<0.05 vs sham operation group;△P<0.05 vs pSNL group;#P<0.05 vs pSNL+NC shRNA group.
Group Control Sham operation pSNL pSNL+NC shRNA pSNL+TRPA1 shRNA MWT Before injection 11.51±0.80 11.20±0.68 5.62±0.33*5.82±0.42*5.53±0.28*1hafter injection 11.70±0.21 11.82±0.25 5.53±0.25*5.73±0.33*9.31±0.13*△#7hafter injection 11.06±0.45 10.80±0.31 5.72±0.13*5.52±0.43*10.22±0.42△#12hafter injection 10.81±0.35 11.22±0.43 5.51±0.32**5.81±0.63**10.73±0.48△#24hafter injection 11.62±0.34 11.31±0.14 4.84±0.69*4.55±0.38*10.90±0.13△#
2.2 各组小鼠DRG 中TRPA1 和GFAP 蛋白表达水平及血清中TNF-α 和MCP-1 水平与假手术组比较,pSNL组小鼠术侧DRG 中TRPA1 和GFAP蛋白表达水平升高(P<0.05),提示pSNL 后,星形胶质细胞活数增多。与pSNL+NC shRNA组比较,pSNL+TRPA1 shRNA组小鼠DRG 中GFAP蛋白表达水平明显降低(P<0.05),见图1 和2。ELISA 法检测炎症因子分泌结果显示:与假手术组比较,pSNL组小鼠血清中TNF-α 和MCP-1 水平 升高(P<0.05),与pSNL+NC shRNA组比较,pSNL+TRPA1 shRNA组小鼠血清中TNF-α和MCP-1 水平降低(P<0.05),即敲低TRPA1 表达可减轻pSNL 小鼠神经性疼痛的炎症反应,缓解因pSNL 引起的神经性疼痛。见表3。
表3 ELISA 法检测各组小鼠血清中TNF-α 和MCP-1 水平Tab.3 Levels of TNF- α and MCP-1 in serum of mice in various groups detected by ELISA method[n=3,±s,ρB/(ng·L-1)]
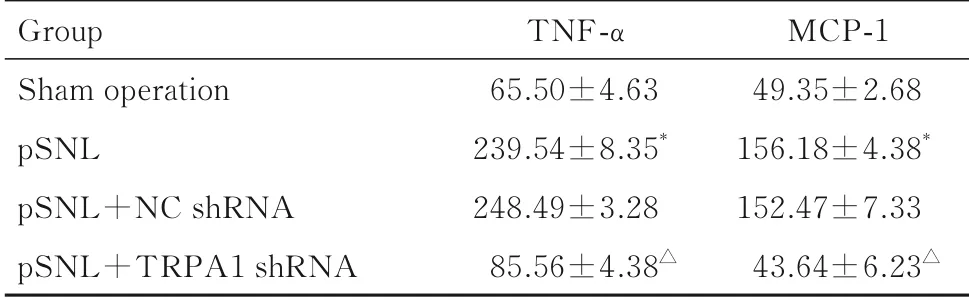
表3 ELISA 法检测各组小鼠血清中TNF-α 和MCP-1 水平Tab.3 Levels of TNF- α and MCP-1 in serum of mice in various groups detected by ELISA method[n=3,±s,ρB/(ng·L-1)]
*P<0.05 vs sham operation group;△P<0.05 vs pSNL+NC shRNA group.
Group Sham operation pSNL pSNL+NC shRNA pSNL+TRPA1 shRNA TNF-α 65.50±4.63 239.54±8.35*248.49±3.28 85.56±4.38△MCP-1 49.35±2.68 156.18±4.38*152.47±7.33 43.64±6.23△
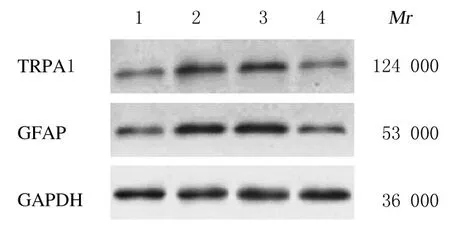
图1 Western blotting 法检测各组小鼠DRG 中TRPA1 和GFAP 蛋白表达电泳图Fig.1 Electrophoregram of expressions of TRPA1 and GFAP proteins in DRG of mice in various groups detected by Western blotting method
表2 各组小鼠的TWLTab.2 TWL of mice in various groups (n=6,±s,t/s)

表2 各组小鼠的TWLTab.2 TWL of mice in various groups (n=6,±s,t/s)
*P<0.05 vs sham operation group;△P<0.05 vs pSNL group;#P<0.05 vs pSNL+NC shRNA group.
Group Control Sham operation pSNL pSNL+NC shRNA pSNL+TRPA1 shRNA TWL Before injection 18.52±0.90 18.20±0.76 11.04±0.22*10.81±0.32*10.50±0.18*1hafter injection 17.71±0.19 17.81±0.65 10.91±0.12*10.74±0.31*16.33±0.23*7hafter injection 17.20±0.25 17.80±0.11 10.33±0.35*10.40±0.53*16.52±0.51*△#12hafter injection 16.83±0.51 17.22±0.46 10.52±0.65*10.31±0.53*16.81±0.55△#24hafter injection 17.64±0.43 18.03±0.12 8.73±0.52*8.53±0.34*17.63±0.63△#

图2 各组小鼠DRG中TRPA1和GFAP蛋白表达水平Fig.2 Expression levels of TRPA1 and GFAP proteins in DRG of mice in various groups
2.3 各组细胞中TRPA1 和GFAP 蛋白表达和细胞上清中TNF-α 及MCP-1 水平与空质粒组比较,Ad-TRPA1组细胞中TRP1 和GFAP蛋白表达水平明显升高(P<0.01);与sh-NC组比较,sh-TRPA1组细胞中TRPA1 和GFAP 蛋白表达水平明显降低(P<0.05),见图3和4。与空质粒组比较,Ad-TRPA1组细胞上清中TNF-α和MCP-1水平明显升高(P<0.05);与sh-NC组比较,sh-TRPA1组细胞上清中TNF-α 和MCP-1 水平 明显降低(P<0.05)。见表4。
表4 ELISA 法检测各组细胞上清中TNF-α 和MCP-1 水平Tab.4 Levels of TNF-α and MCP-1 in cell supernatant in various groups detected by ELISA method[n=3,±s, ρB/(ng·L-1)]

表4 ELISA 法检测各组细胞上清中TNF-α 和MCP-1 水平Tab.4 Levels of TNF-α and MCP-1 in cell supernatant in various groups detected by ELISA method[n=3,±s, ρB/(ng·L-1)]
*P<0.05 vs empty vector group;△P<0.05 vs sh-NC group.
Group Empty vector Ad-TRPA1 sh-NC sh-TRPA1 TNF-α 77.34±4.38 210.42±5.36*75.23±8.37 28.53±4.39△MCP-1 43.59±4.82 148.26±7.85*53.65±2.34 13.48±2.33△

图3 Western blotting 法检测各组细胞中TRPA1 蛋白表达电泳图(A)和直条图(B)Fig.3 Electrophoregram (A) and histogram (B) of expressions of TRPA1 protein in cells in various groups detected by Western blotting method
2.4 各组细胞中Prkce 和GFAP 蛋白表达水平及细胞上清中TNF- α 和MCP-1 水 平采 用Lipofectamine 2000 转染Prkce 腺病毒表达载体或shRNA 进入原代星形胶质细胞培养48 h,采用Western blotting 法检测细胞中Prkce 和GFAP 蛋白的表达,收集细胞上清液检测炎症因子的分泌结果显示:与空质粒组比较,Ad-Prkce组细胞中GFAP蛋白表达水平明显升高(P<0.05),与sh-NC组比较,sh-Prkce组细胞中GFAP 蛋白表达水平明显降低(P<0.05),见图5 和6。与空质粒组比较,Ad-Prkce组细胞上清 中TNF-α和MCP-1水平明显升高(P<0.01),与sh-NC组比较,sh-Prkce组细胞上清中TNF-α和MCP-1水平明显降低(P<0.01)。见表5。
表5 ELISA 法检测各组细胞上清中TNF-α 和MCP-1 水平Tab.5 Levels of TNF- α and MCP-1 in cell supernatant in various groups detected by ELISA method[n=3,±s,ρB/(ng·L-1)]

表5 ELISA 法检测各组细胞上清中TNF-α 和MCP-1 水平Tab.5 Levels of TNF- α and MCP-1 in cell supernatant in various groups detected by ELISA method[n=3,±s,ρB/(ng·L-1)]
*P<0.01 vs empty vector group;△P<0.01 vs sh-NC group.
Group Empty vector Ad-Prkce sh-NC sh-Prkce TNF-α 80.21±3.46 240.25±5.62*75.23±8.39 25.38±4.92△MCP-1 45.91±6.29 179.65±8.53*42.78±6.47 12.81±5.38△
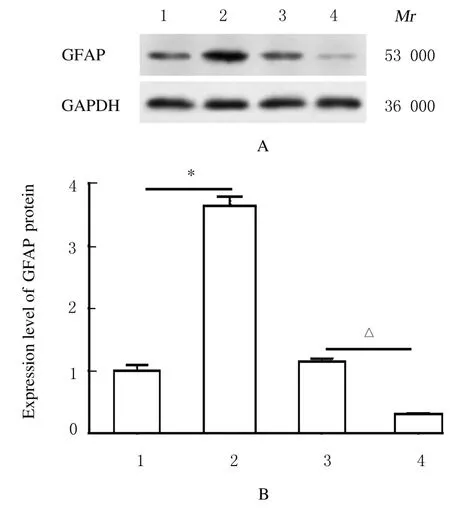
图4 Western blotting 法检测各组细胞中GFAP 蛋白表达电泳图(A)和直条图(B)Fig.4 Electrophoregram (A) and histogram (B) of expressions of GFAP protein in cells in various groups detected by Western blotting method

图5 Western blotting 法检测各组细胞中Prkce 和GFAP 蛋白表达电泳图Fig.5 Electrophoregram of expressions of Prkce and GFAP proteins in cells in various groups detected by Western blotting method
2.5 TRPA1 和Prkce 相互作用关系通过在线数据库STRING 预测TRPA1 和Prkce 相互作用关系见图7。Co-IP 法进一步验证其相互作用。见图8。

图7 STRING 数据库预测TRPA1 和Prkce 的相互作用Fig.7 Interaction between TRPA1 and Prkce predicted by STRING database

图8 Co-IP 法验证TRPA1 和Prkce 的相互作用Fig.8 Interaction between TRPA1 and Prkce verified by Co-IP method
2.6 各组细胞中TRPA1、Prkce 和GFAP 蛋白表达水平及细胞上清中TNF-α 和MCP-1 水平为进一步检测TRPA1 及互作蛋白Prkce对星形胶质细胞激活的影响,TRPA1 shRNA 单独转染或与Ad-Prkce 共转染星形胶质细胞。48h后检测TRPA1、Prkce 和GFAP 蛋白表达水平,收集细胞上清检测炎症因子的分泌结果显示: 与sh-TRPA1+empty vector组比较,sh-TRPA1+Ad-Prkce组细胞中TRPA1、Prkce 和GFAP 蛋白表达水平明显升高(P<0.01),见图9和10。与sh-TRPA1+empty vector组比较,sh-TRPA1+Ad-Prkce组细胞上清中TNF- α 和MCP-1水平明显升高(P<0.05)。见表6。
表6 ELISA 法检测各组细胞上清中TNF-α 和MCP-1 水平Tab.6 Levels of TNF- α and MCP-1 in cell supernatant in various groups detected by ELISA method[n=3,±s,ρB/(ng·L-1)]

表6 ELISA 法检测各组细胞上清中TNF-α 和MCP-1 水平Tab.6 Levels of TNF- α and MCP-1 in cell supernatant in various groups detected by ELISA method[n=3,±s,ρB/(ng·L-1)]
*P<0.05 vs sh-NC group;△P<0.05 vs sh-TRPA1+empty vector group.
Group sh-NC sh-TRPA1 sh-TRPA1+empty vector sh-TRPA1+Ad-Prkce TNF-α 90.55±5.68 29.13±4.29*25.33±6.22 85.16±7.15△MCP-1 46.98±7.38 15.58±5.62*14.81±6.72 43.75±6.36△

图6 各组细胞中Prkce 和GFAP 蛋白表达水平Fig.6 Expression levels of Prkce and GFAP proteins in cells in various groups

图9 Western blotting 法检测各组细胞中TRPA1、Prkce 和GFAP 蛋白表达电泳图Fig.9 Electrophoregram of expressions of TRPA1,Prkce, and GFAP proteins in cells in various groups detected by Western blotting method
3 讨 论
脊髓中的胶质细胞在神经病理性疼痛中发挥重要作用[8-9]。周围神经损伤后脊髓背角的小胶质细胞和星形胶质细胞被激活,其激活可能与促炎细胞因子白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)和TNF-α 的 产 生和释放有关[10]。星形胶质细胞对各种有害或生理刺激反应迅速且敏感,当机体受到某种刺激时,星形胶质细胞的特征性标志物GFAP 表达增加[11-13]。
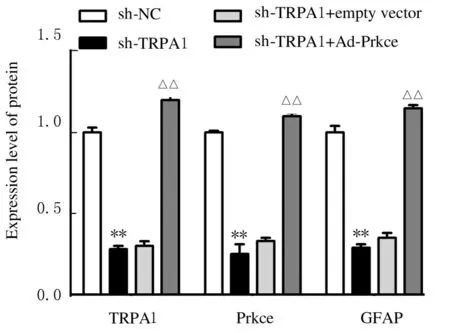
图10 各组细胞中TRPA1、Prkce 和GFAP 蛋白表达水平Fig.10 Expression levels of TRPA1, Prkce, and GFAP proteins in cells in various groups
研究[14-16]显示:TRPA1在伤害性神经信号传递中高表达,参与神经病理性疼痛的形成,采用TRPA1 拮抗剂HC-030031 可减轻大鼠的炎性痛和神经病理性疼痛。芳樟醇气味和白术素可以通过TRPA1 通路对小鼠产生镇痛作用[17-18],与本课题组发现的pSNL 小鼠DRG 中TRPA1 蛋白表达升高以及MWT和TWL 降低结果一致。在pSNL 小鼠中,二甲基三硫醚作用于TRPA1 受体可减轻创伤性神经性疼痛[19]。鞘内注射miR-141-5p mimic可以通过下调TRPA1 的表达减弱奥沙利铂诱导的神经 性疼痛[20]。但目前 关 于TRPA1 在pSNL 小鼠神经病理性疼痛模型中的作用机制并不明确,本研究结果显示: 鞘内注射TRPA1 shRNA组小鼠DRG中GFAP 蛋白表达水平降低,炎症因子分泌减少,MWT 和TWL 升高,说明敲低TRPA1 的表达可以抑制星形胶质细胞的激活以及炎症反应,减轻神经性疼痛。
本文作者分离培养pSNL 小鼠原代星形胶质细胞进行体外实验:过表达TRPA1 促进星形胶质细胞的激活以及炎症因子的分泌,敲低TRPA1 抑制星形胶质细胞的激活及炎症因子的分泌。为进一步研究TRPA1 在神经性疼痛中发挥作用的具体机制,通过STRING 数据库检索发现与TRPA1 相互作用的蛋白Prkce,Prkce 是蛋白激酶C(protein kinase C,PKC)家族成员之一[21],其通过与细胞骨架相互作用参与调节多种生理过程[22],还可以调节基因的表达、炎症反应和免疫应答等[23-24]。研究[25]显示:Prkce 是一种信号传导物质,在神经系统中起重要作用。大鼠DRG 持续受压后,术侧脊髓背角中Prkce 和星形胶质细胞激活标记物GFAP蛋白表达上调,表明Prkce 可能通过调节星形胶质细胞激活参与大鼠DRG 持续受压病理性神经痛的中枢敏化机制。重组脂联素通过抑制PKC 通路的激活抑制小鼠星形胶质细胞氧糖剥夺/复氧模型中炎症相关蛋白的表达[26]。通过鞘内注射阻断TRPM8 通过抑制PKC 和核因子κB(nuclear factor κB,NF-κB)信号通路减轻神经痛大鼠DRG 的冷痛过敏[27]。研究[28]显示:脊 髓神经元一氧化氮合酶与突触后致密物95 相互作用,通过激活Prkce,促进坐骨神经慢性收缩损伤小鼠神经痛的发生发展,这与本研究结果一致。本研究结果显示:在pSNL 小鼠原代星形胶质细胞中过表达Prkce 促进星形胶质细胞的激活以及炎症因子的分泌,敲低Prkce 抑制星形胶质细胞的激活及炎症因子的分泌,且过表达Prkce 可以逆转TRPA1 shRNA 对星形胶质细胞激活以及炎症因子分泌的抑制作用,即TRPA1 和Prkce 相互作用影响星形胶质细胞的激活以及炎症因子的释放,参与pSNL 小鼠神经病理性疼痛的调节机制。
综上所述,TRPA1 通过与Prkce 相互作用参与pSNL 模型小鼠星形胶质细胞的激活和神经性疼痛的发生发展。

