BMP9对共培养体系中人乳腺癌MDA-MB-231细胞迁移和侵袭的影响及其机制探讨*
王 林,段雯婷,王 维
1.陕西省西安市第一医院检验科,陕西西安 710002;2.陕西省西安市第一医院心血管内科, 陕西西安 710002;3.陕西省西安市儿童医院检验科,陕西西安 710003
骨是包括乳腺癌在内的多种癌症远处转移的常见部位,几乎所有晚期乳腺癌患者均会发生骨转移[1-3]。骨转移常表现为溶骨性病变,导致病理性骨折、顽固性骨痛、神经压迫和高钙血症[4]。发生骨转移的乳腺癌组织中来源于骨髓的间充质干细胞(BMSCs),为乳腺癌细胞的生长提供了良好的微环境。有研究发现,BMSCs与乳腺癌细胞(BCCs)的相互作用是乳腺癌骨转移和骨溶解的重要环节[5],深入了解这种相互作用及潜在的机制有助于探究乳腺癌的治疗新策略。骨中存在多种生长因子,包括骨形态发生蛋白(BMP)、转化生长因子-β(TGF-β)、成纤维细胞生长因子(FGFs)、血小板源性生长因子和胰岛素样生长因子[6],这些因子也被称为骨储存生长因子或骨衍生生长因子,其中TGF-β的促乳腺癌骨转移作用已经明确。TGF-β通过Smad信号通路促进乳腺癌细胞中甲状旁腺激素相关蛋白(PTHrP)的分泌。PTHrP通过上调破骨细胞激活因子促进破骨细胞的形成和骨质破坏[7]。但是,对于其他骨生长因子的功能和分子机制有待进一步研究。BMP9是一种骨储存生长因子,被证实为骨形成过程中最有效的BMP[8-9]。前期实验结果显示,BMP9能抑制乳腺癌细胞的增殖和转移[10],然而BMP9对骨微环境中的乳腺癌细胞的作用尚不明确。本研究体外模拟肿瘤微环境,在人乳腺癌MDA-MB-231细胞和人骨髓基质HS-5细胞共培养体系中加入BMP9,研究BMP9如何调节BMSCs和BCCs的相互作用,以探索乳腺癌骨转移的治疗新靶点。
1 资料与方法
1.1一般资料 人乳腺癌细胞MDA-MB-231购于中国科学院上海生命科学研究院生物化学细胞生物学研究所,人骨髓基质细胞HS-5购于美国菌种保藏中心,均由西安市第一医院检验科保存。
1.2仪器与试剂 重组BMP9购于Abcam生物试剂有限公司;DMEM高糖培养基购于Gibco公司;胎牛血清购于杭州四季青生物工程材料有限公司;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白缓冲液和封闭蛋白购于武汉博士德生物工程有限公司;蛋白marker购于北京赛百盛基因技术有限公司;细胞裂解液购于碧云天生物技术研究所;Transwell小室和辣根过氧化物酶(HRP)发光试剂购于Millipore公司;Matrigel胶购于Sigma公司;兔抗人趋化因子受体4(CXCR4)抗体购于Abcam 公司;兔抗人基质细胞衍生因子-1(SDF-1)抗体购于Santa Cruz公司;兔抗人P-Akt、Akt抗体购于Cell Signaling Technology公司;兔抗人基质金属蛋白酶(MMP)9、MMP2抗体购于Immunoway公司;山羊抗兔IgG二抗购于北京中杉金桥生物技术有限公司。
1.3方法
1.3.1细胞培养 MDA-MB-231细胞和HS-5细胞用含10 %胎牛血清的DMEM高糖培养基在37 ℃,50 mL/L CO2的条件下进行培养。
1.3.2共培养及实验分组 取常规培养对数生长期的MDA-MB-231细胞和HS-5细胞,分别以1.5×105/孔和1×105/孔细胞数量接种于6孔板中和Transwell小室中在37 ℃,50 mL/L CO2中进行单独培养16 h后,两种细胞更换为DMEM无血清培养基,并将小室置于6孔板内进行共培养,对照组在共培养体系中加入磷酸盐缓冲液(PBS),实验组给予100 ng/mL BMP9蛋白处理。
1.3.3细胞划痕实验检测细胞迁移能力 接种MDA-MB-231细胞于6孔板中,待细胞共培养前,用100 μL移液器枪头垂直划痕,并记录0 h划痕宽度,然后将MDA-MB-231细胞与HS-5细胞叠放进行共培养,显微镜观察36 h同一视野划痕愈合情况,计算平均划痕愈合率。划痕愈合率=(0 h划痕宽度-36 h划痕宽度)/0 h划痕宽度×100%,以此反映细胞迁移能力的变化,实验重复3次。
1.3.4Transwell细胞侵袭实验检测细胞侵袭能力 预先在每孔Transwell细胞上室加入50 μL Matrigel胶(DMEM无血清培养基1∶8稀释),37 ℃ 30 min待凝固。对照组和实验组共培养48 h后的MDA-MB-231细胞经胰酶消化离心后,分别用各自共培养体系中培养液重悬,以5×104/孔的浓度取400 μL加入上室,下室分别加入600 μL各自共培养体液的培养液,继续培养24 h,取出小室用PBS清洗2遍,自然晾干后经结晶紫染色5 min,于显微镜下观察计数穿膜细胞数,以反映细胞侵袭能力的变化,实验重复3次。
1.3.5Western blot检测BMP9对共培养体系中MDA-MB-231细胞MMP2、MMP9、CXCR4、SDF-1、P-Akt及HS-5细胞SDF-1表达的影响 按试剂盒要求分别提取对照组和实验组共培养48 h后的MDA-MB-231细胞和HS-5细胞总蛋白,取120 μg总蛋白行10% SDS-PAGE进行分离后干转至聚偏氟乙烯膜,经三羟甲基氨基甲烷盐酸盐吐温缓冲液(TBST)(含50 g/L脱脂奶粉)4 ℃封闭4 h后,分别加入经1∶1 000稀释的兔抗人MMP9、MMP2、CXCR4、SDF-1、P-Akt抗体(MDA-MB-231细胞),兔抗人SDF-1抗体(HS-5细胞),于4 ℃孵育过夜,经TBST洗涤2次和三羟甲基氨基甲烷盐酸盐缓冲液洗涤1次;加入经1∶1 000稀释的羊抗兔IgG二抗,室温孵育1 h,重复洗涤;暗室滴加HRP发光试剂2 min后经Bio-Rad凝胶成像系统采集图像,用Quantity One 4.6.6软件进行各条带灰度值分析,并用内参作比值,以检测各蛋白表达水平,实验重复3次。
1.3.6明胶酶谱法检测BMP9对共培养体系中MDA-MB-231细胞MMP2、MMP9相对活性的影响 收集对照组和实验组共培养48 h后的MDA-MB-231细胞上清液,经2 000 r/min离心10 min备用,配置分离胶和浓缩胶,根据蛋白水平调整上样量,与5×缓冲液混合上样,于4 ℃行SDS-PAGE,将凝胶置于洗脱液中振荡洗脱2次,每次40 min,漂洗液漂洗2次,每次40 min,然后将凝胶置于孵育液于37 ℃ 孵育42 h,孵育结束后经染色液染色3 h,以及脱色液A、B、C分别脱色0.5、1.0、2.0 h,用Quantity One 4.6.6软件分析蓝色背景MMP2(相对分子质量72×103)、MMP9(相对分子质量92×103)透亮带宽度和灰度值,做统计分析,实验重复3次。
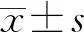
2 结 果
2.1BMP9可抑制共培养体系中MDA-MB-231细胞的迁移 划痕实验结果显示,对照组和实验组共培养体系中MDA-MB-231细胞平均愈合率分别为(84.28±2.54)%、(44.49±4.86)%,差异有统计学意义(t=12.58,P<0.05)。见图1。

图1 划痕实验检测BMP9对共培养体系中MDA-MB-231细胞迁移的影响(×100)
2.2BMP9可抑制共培养体系中MDA-MB-231细胞的侵袭 Transwell细胞侵袭实验结果显示,对照组和实验组共培养体系中MDA-MB-231细胞穿膜细胞数分别为481±22、121±11,差异有统计学意义(t=24.96,P<0.05)。见图2。
2.3BMP9对共培养体系中MDA-MB-231细胞MMP9、MMP2表达及相对活性的影响 Western blot检测结果显示,实验组MMP9的蛋白表达(0.10±0.01)较对照组(0.79±0.03)明显下调,MMP2的蛋白表达(0.11±0.03)较对照组(0.82±0.05)也明显下调,差异均有统计学意义(t=34.99、19.04,P<0.05),见图3;明胶酶谱检测结果显示,实验组MMP9相对活性(0.14±0.03)较对照组(0.90±0.07)明显下调,MMP2相对活性(0.12±0.02)较对照组(1.04±0.14)也明显下调,差异均有统计学意义(t=17.24、11.15,P< 0.05),见图4 。
图2 Transwell细胞侵袭实验检测BMP9对共培养体系中MDA-MB-231细胞侵袭的影响(×200)

图4 明胶酶谱法检测BMP9对共培养体系中MDA-MB-231细胞MMP9、MMP2相对活性的影响
2.4BMP9对共培养体系中MDA-MB-231细胞及HS-5细胞SDF-1/CXCR4-PI3K信号通路关键分子表达的影响 Western blot检测结果显示,实验组MDA-MB-231细胞中CXCR4受体蛋白表达(0.08±0.01)与对照组(0.07±0.01)比较,其配体SDF-1的蛋白表达(0.06±0.02)与对照组(0.05±0.01)比较,差异均无统计学意义(t=2.00、0.80,P>0.05);实验组P-Akt蛋白表达(0.09±0.01)较对照组(0.48±0.07)明显降低,差异有统计学意义(t=9.68,P<0.05);而实验组Akt蛋白表达(0.40±0.05)与对照组(0.46±0.03)比较,差异无统计学意义(t=1.70,P>0.05)。实验组HS-5细胞中SDF-1蛋白表达(0.14±0.01)较对照组(0.42±0.06)明显降低,差异有统计学意义(t=7.93,P<0.05)。见图5。
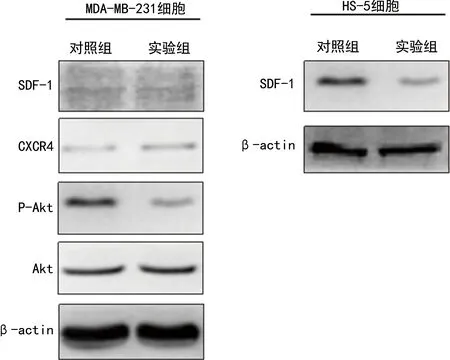
图5 Western blot检测BMP9对共培养体系中MDA-MB-231细胞及HS-5细胞SDF-1/CXCR4-PI3K信号通路关键分子表达的影响
3 讨 论
肿瘤包括乳腺癌在内,不是以自我维持的实体方式存在,而是不断地与其微环境相互作用[11-12]。BMSCs作为肿瘤微环境的重要组成部分,不管是在原发性癌还是骨转移性癌中均可与BCCs发生相互作用。BCCs可在乳腺癌早期招募BMSCs至其原发部位[5]。越来越多的证据表明,BMSCs与BCCs的相互作用在乳腺癌转移过程中扮演着关键角色[13-14],另外二者的交互对乳腺癌晚期所致的骨骼损伤过程有促进作用[15]。因此,肿瘤微环境中细胞的相互作用可能是治疗乳腺癌的潜在靶点。
BMP9也被称之为生长分化因子2,与包括乳腺癌在内的多种肿瘤的生长、黏附、侵袭和迁移有关。BMP9可通过BMP/SMAD途径促进卵巢癌细胞的生长[16],也可通过非经典BMP/SMAD途径抑制前列腺癌PC-3细胞的生长及促进其凋亡[17]。有研究表明,BMP9可抑制乳腺癌MDA-MB-231细胞的侵袭[9]。BMP9是最有效的成骨因子,可能比目前临床上使用的其他BMP有更好的促进骨再生的作用[8-9]。另外,作为一种分泌性蛋白,BMP9是骨髓中重要的骨相关分子,然而,其在乳腺癌骨转移中的作用尚不明确。有研究结果显示,BMP9通过阻断Akt信号通路降低HS-5细胞的细胞核因子κB受体活化因子配基的分泌,进而抑制MDA-MB-231细胞的侵袭[9]。
本研究建立HS-5细胞和MDA-MB-231细胞共培养模型,体外模拟肿瘤微环境,研究BMP9如何调节BMSCs与BCCs的相互作用。BMP9对MDA-MB-231细胞的迁移和侵袭有明显抑制作用。转移相关蛋白SDF-1和MMPs表达明显减少,然而,BMP9调控这些转移相关因子的机制还有待进一步研究。不同癌症对BMP9的反应不同,有文献报道BMP9在卵巢癌中与本研究相反的作用[16]。BMP9的致瘤或抑瘤特性反映了其在该肿瘤发育过程中与BCCs复杂的相互作用过程,BCCs对BMP9的生物学反应亦取决于其剂量、细胞类型和肿瘤微环境,以及其他尚未确定的因素。SDF-1又称为CXCL12,在HS-5细胞中呈高度表达,而其受体CXCR4在MDA-MB-231细胞中呈高度表达。本课题进一步研究BMP9对共培养体系SDF-1/CXCR4轴的影响,结果表明,BMP9降低了HS-5细胞中SDF-1的分泌,而对MDA-MB-231细胞中CXCR4的表达无影响,同时MDA-MB-231细胞下游信号分子P-Akt表达降低。
综上所述,BMP9可抑制体外模拟肿瘤微环境的共培养体系中乳腺癌MDA-MB-231细胞的迁移和侵袭,其作用可能是通过调节共培养体系中SDF-1/CXCR4-PI3K信号通路实现的,为乳腺癌的生物治疗提供了新的靶点及实验依据,下一步课题组将进行相关体内研究来进一步证实其推断。

