核糖体蛋白基因RPLP0对急性髓系白血病细胞增殖和凋亡的调控作用
郑晓燕,朱化超(西安交通大学第一附属医院血液内科,西安 710061;通讯作者,E-mail:zhuhuachao08@126.com)
急性髓系白血病(acute myelocytic leukemia,AML)是成人最常见和最严重的急性白血病[1,2]。我国成人AML的发病率世界排名第三[3]。AML的病因是多因素的,目前尚未完全阐明。AML的发生通常伴随多种编码信号蛋白、转录因子和染色质修饰物的基因缺失、突变或过表达,这些基因会影响细胞信号或其他基因的表达[4-6]。其中一些基因已经作为AML诊断或预后的标记物和潜在的治疗靶点[7]。核糖体蛋白侧柄亚单位P0(ribosomal protein lateral stalk subunit P0,RPLP0)基因编码一种保守的酸性核糖体磷酸化蛋白(P蛋白),它是60S亚基的一个组成部分。有研究报道,RPLP0在子宫内膜癌[8]、胃癌[9]、结直肠癌[10]中高表达,并且调节癌细胞的生长和转移性。Handschuh等[11]通过基因芯片方法检测了33例AML患者和15例健康志愿者外周血单个核细胞(peripheral blood mononuclear cell, PBMC)中的不同基因表达,研究显示,RPLP0在AML患者的PBMC中的表达量显著高于检测志愿者。然而,目前尚未查阅到相关文献报道RPLP0在AML中的生物学功能。因此,本研究通过观察RPLP0对AML细胞增殖和凋亡的调控作用,探讨其可能的机制,旨在为AML的诊断和治疗提供候选分子靶标。
1 材料与方法
1.1 主要试剂
RPMI-1640培养基购自美国Gibco公司。Lipofectamine 2000、SuperScriptⅡ逆转录酶购自美国Invitrogen公司。MTT试剂盒购自北京索莱宝科技有限公司。Annexin Ⅴ-FITC/PI凋亡检测试剂盒购自碧云天生物技术研究所。RNasy Mini Kit购自德国Qiagen公司。SYBR Premix Ex Taq购自日本TaKaRa公司。RIPA裂解液、BCA试剂盒购自上海吉至生化科技有限公司。RPLP0、p53、PTEN、PI3K、p-PI3K、AKT、p-AKT和β-actin一抗及HRP标记的IgG二抗购自美国Abcam公司。增强型ECL化学发光检测试剂盒购自南京诺唯赞生物科技股份有限公司。
1.2 AML患者骨髓标本的收集
收集西安交通大学第一附属医院2018年3月至2020年6月确诊的30例AML患者的骨髓样本作为AML组,其中男17例,女13例,年龄23~67岁,平均(43.25±12.33)岁;15例异基因造血干细胞移植健康供者的骨髓样本作为健康组,其中男8例,女7例,年龄29~52岁,平均(39.73±9.32)岁。收集样本后通过qRT-PCR和Western blot检测RPLP0的mRNA和蛋白表达水平。样本收集前AML患者未接受任何治疗。两组受试者的人口统计学资料差异无统计学意义(P<0.05)。本研究已获得西安交通大学第一附属医院伦理委员会的批准,所有患者均签署了知情同意书。
1.3 细胞培养
人正常外周血单个核细胞(peripheral blood mononuclear cell, PBMC)、人急性髓系白血病(AML)细胞系THP-1均购自美国ATCC。细胞均在含有10%胎牛血清、100 U/ml青霉素和100 mg/ml链霉素的RPMI-1640培养基中于37 ℃和5% CO2条件下培养。之后进行细胞分组、转染、MTT实验、流式细胞术、qRT-PCR和Western blot检测。
1.4 细胞分组及处理
将THP-1细胞接种在24孔板中培养24 h,每组设置3个复孔。为了研究下调RPLP0对细胞功能的影响,将细胞分为对照组、shRNA-NC组和shRNA-RPLP0组;为了研究上调RPLP0对细胞功能的影响,将细胞分为对照组、pcDNA3.1-NC组和pcDNA3.1-RPLP0组。细胞达到80%融合后,使用Lipofectamine 2000分别将RPLP0的短发夹RNA(shRNA-RPLP0)、shRNA阴性对照(shRNA-NC)、过表达RPLP0的质粒(pcDNA3.1-RPLP0)以及对照质粒(pcDNA3.1-NC)转染到THP-1细胞中,转染方法严格按照试剂盒说明书进行。对照组为未转染的THP-1细胞。shRNA-RPLP0、shRNA-NC、pcDNA3.1-RPLP0以及pcDNA3.1-NC均由上海吉凯基因化学技术有限公司提供。后续实验均按照上述分组实施。
1.5 MTT法测定细胞活力
THP-1细胞转染后以1×105个细胞/孔的密度接种于96孔板,每孔体积为200 μl,37 ℃孵育48 h,每孔加入20 μl的MTT溶液,继续孵育4 h。吸弃培养上清液,每孔加入150 μl DMSO,摇床振荡10 min。酶标仪检测570 nm光密度值(OD)。实验重复3次。
1.6 流式细胞术测定细胞凋亡
THP-1细胞转染后,用预冷PBS重悬细胞,2 000 r/min离心10 min,洗涤细胞。加入300 μl的结合缓冲液,然后加入5 μl Annexin Ⅴ,避光孵育15 min,上机前5 min加入5 μl的碘化丙啶(PI)并孵育5 min。通过FACS Calibur流式细胞仪检测细胞凋亡。实验重复3次。
1.7 qRT-PCR检测RPLP0的mRNA表达量
使用RNasy Mini Kit从骨髓和细胞中提取总RNA。用SuperScriptⅡ逆转录酶进行逆转录。使用SYBR Premix Ex Taq在7900HT荧光定量PCR仪扩增。PCR循环程序如下:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火/延伸1 min,50次循环。RPLP0上游引物:5′-ACGGTACCTAGGGGCAATAG-3′,下游引物:5′-AGAGGTTAGTCTGGCTCGTGA-3′;β-actin上游引物:5′-CTCCATCCTGGCCTCGCTGT-3′,下游引物:5′-GCTGTCACCTTCACCGTTCC-3′。将RPLP0的表达量标准化为β-actin的倍数(相对比值)。通过2-ΔΔCt方法确定基因相对表达量。实验重复3次。
1.8 Western blot检测RPLP0、p53、PTEN、PI3K、p-PI3K、AKT和p-AKT的蛋白表达量
将骨髓和细胞在RIPA裂解液中裂解,使用BCA试剂盒检测蛋白质浓度。通过12% SDS-PAGE分离等量的蛋白质,并转移至PVDF膜。用5%脱脂牛奶的TBST将膜在室温下封闭1 h,4 ℃下与一抗孵育过夜。一抗分别为RPLP0、p53、PTEN、PI3K、p-PI3K、AKT、p-AKT和β-actin。用TBST洗涤后,将膜与HRP标记的IgG二抗在室温孵育1 h。所有抗体稀释倍数均为1 ∶1 000。将各蛋白表达量标准化为β-actin的倍数(相对比值)。使用增强型ECL化学发光检测试剂盒进行显影。实验重复3次。
1.9 统计学分析

2 结果
2.1 RPLP0在AML患者骨髓和AML细胞中的表达
与健康组相比,AML患者骨髓中RPLP0的mRNA表达量显著升高(t=6.977,P<0.001),RPLP0的蛋白表达量也显著升高(t=8.959,P<0.001,见图1)。与PBMC相比,THP-1细胞中RPLP0的mRNA表达量显著升高(t=12.050,P<0.001),RPLP0的蛋白表达量也显著升高(t=10.881,P<0.001,见图2)。

与健康组比较,***P<0.001图1 RPLP0在AML患者骨髓中的表达Figure 1 The expression of RPLP0 in the bone marrow of AML patients

与PBMC比较,***P<0.001图2 RPLP0在PBMC和THP-1细胞中的表达Figure 2 The expression of RPLP0 in PBMC and THP-1 cells
2.2 RPLP0对THP-1细胞增殖的影响
THP-1细胞经转染shRNA-RPLP0后,各组细胞的RPLP0 mRNA表达量差异有统计学意义(F=108.300,P<0.001);与shRNA-NC组相比,shRNA-RPLP0组RPLP0 mRNA表达量降低(P<0.001,见图3)。转染shRNA-RPLP0后,各组的RPLP0蛋白表达量差异有统计学意义(F=175.621,P<0.001);与shRNA-NC组相比,shRNA-RPLP0组的RPLP0蛋白表达量降低(P<0.001,见图3)。转染pcDNA3.1-RPLP0后,各组的RPLP0 mRNA表达量差异有统计学意义(F=101.094,P<0.001);与pcDNA3.1-NC组相比,pcDNA3.1-RPLP0组的RPLP0 mRNA表达量升高(P<0.001,见图3)。转染pcDNA3.1-RPLP0后,各组的RPLP0蛋白表达量差异有统计学意义(F=131.722,P<0.001);与pcDNA3.1-NC组相比,pcDNA3.1-RPLP0组的RPLP0蛋白表达量升高(P<0.001,见图3)。

与shRNA-NC组或pcDNA3.1-NC组比较,***P<0.001图3 THP-1细胞中shRNA-RPLP0和pcDNA3.1-RPLP0的转染效率Figure 3 Transfection efficiency of shRNA-RPLP0 and pcDNA3.1-RPLP0 in THP-1 cells
转染shRNA-RPLP0后,各组THP-1细胞相对活力差异有统计学意义(F=49.373,P<0.001);与shRNA-NC组相比,shRNA-RPLP0组的相对细胞活力显著降低(P<0.001,见图4)。转染pcDNA3.1-RPLP0后,各组THP-1细胞活力差异有统计学意义(F=5.794,P=0.040);与pcDNA3.1-NC组相比,pcDNA3.1-RPLP0组的相对细胞活力显著升高(P<0.05,见图4)。
2.3 RPLP0对THP-1细胞凋亡的影响
THP-1细胞经shRNA-RPLP0转染后,各组细胞凋亡率差异有统计学意义(F=119.725,P<0.001);与shRNA-NC组相比,shRNA-RPLP0组细胞凋亡率升高(P<0.001)。转染pcDNA3.1-RPLP0后,各组THP-1细胞凋亡率差异无统计学意义(F=4.917,P=0.054,见图5)。

与shRNA-NC组或pcDNA3.1-NC组比较,*P<0.05,***P<0.001图4 RPLP0对THP-1细胞增殖的影响Figure 4 The effect of RPLP0 on the proliferation of THP-1 cells
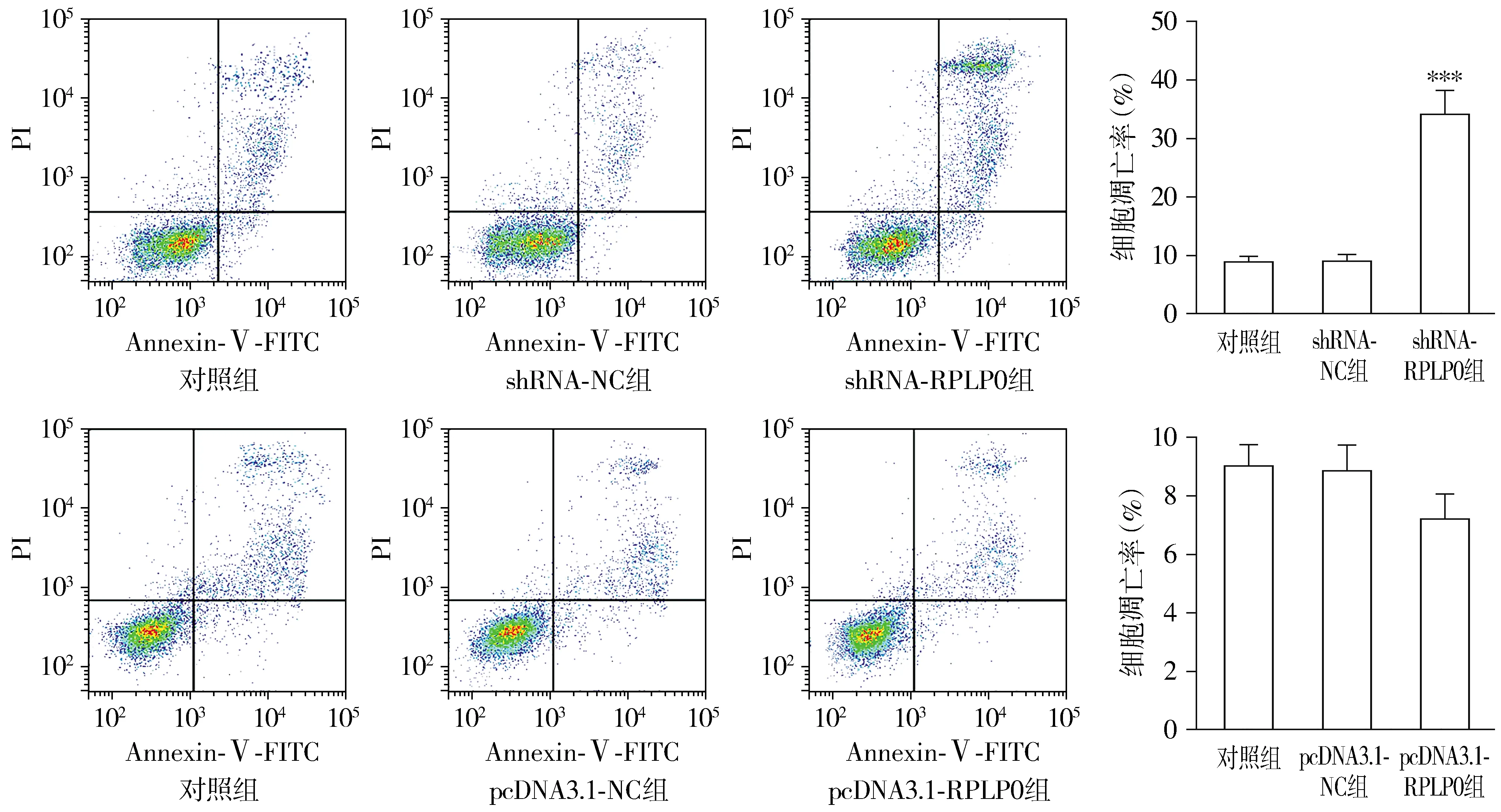
与shRNA-NC组或pcDNA3.1-NC组比较,***P<0.001图5 RPLP0对THP-1细胞凋亡的影响Figure 5 The effect of RPLP0 on THP-1 cell apoptosis
2.4 RPLP0对THP-1细胞中p53-PTEN-PI3K-AKT轴的影响
通过String数据库预测了RPLP0与TP53和PTEN的蛋白之间存在互作关系(见图6)。Western blot结果显示,转染shRNA-RPLP0后,各组THP-1细胞中p53、PTEN、p-PI3K和p-AKT的蛋白表达量差异有统计学意义(P<0.05),而PI3K和AKT蛋白表达量差异无统计学意义(P>0.05)。与shRNA-NC组相比,shRNA-RPLP0组p53和PTEN蛋白表达量显著升高,而p-PI3K和p-AKT蛋白表达量显著降低(P<0.05,见图7)。

图6 string数据库预测的RPLP0与TP53和PTEN的蛋白互作网络Figure 6 The protein interaction network of RPLP0 with TP53 and PTEN predicted by string database
转染pcDNA3.1-RPLP0后,各组THP-1细胞中p53、PTEN、p-PI3K和p-AKT的蛋白表达量差异有统计学意义(P<0.05),而PI3K和AKT蛋白表达量差异无统计学意义(P>0.05)。与pcDNA3.1-NC组相比,pcDNA3.1-RPLP0组p53和PTEN蛋白表达量显著降低,而p-PI3K和p-AKT蛋白表达量显著升高(P<0.05,见图8)。
3 讨论
核糖体是由核糖体RNA和核糖体蛋白(RPs)组成的分子复合物。在人类细胞中已经描述了大约80个RPs[12]。RPs对于稳定成熟核糖体亚基中的rRNA结构至关重要,可促进rRNA在核糖体组装过程中的正确折叠,从而满足细胞的代谢活动和对核糖体的需求[13]。RPs具有促进蛋白质合成和调控基因的转录和翻译的功能。此外,RPs还可诱导细胞增殖、凋亡和肿瘤形成等[14]。目前,有关学者已在人类肿瘤中检测到大量RP的异常表达,一些RPs的表达在肿瘤中显著增强(例如S3、S11、L7、L18、L37、RPLP0和S6),而一些RPs的表达在癌症中显著降低(例如S12、S24、L32和L35a)[15-17]。此外,一些RP的表达量在某些类型的癌症中升高,而在其他类型的癌症中没有变化[18]。RPLP0、RPLP1和RPLP2属于一组酸性RPs,称为P蛋白[13]。人核糖体P蛋白优先形成RPLP1-RPLP2异二聚体,通过RPLP1蛋白附着到RPLP0上[19]。据报道,抑制RPLP1和RPLP2可以导致几种癌细胞的增殖率下降,这表明P蛋白可以在增殖中发挥作用[20]。Handschuh等[11]研究显示,RPLP0在AML患者的PBMC中的表达量显著高于检测志愿者。在本研究中,与异基因造血干细胞移植健康供者相比,RPLP0在AML患者骨髓中的mRNA和蛋白表达量均上调,并且THP-1细胞中RPLP0的表达量明显高于PBMC,该结果与Handschuh等[11]研究结果一致。然而,目前尚不清楚RPLP0是否参与调控AML的进展。

与shRNA-NC组比较,***P<0.001图7 下调RPLP0对THP-1细胞中p53、PTEN、PI3K、p-PI3K、AKT和p-AKT蛋白表达的影响Figure 7 The effect of RPLP0 down-regulation on the expression of p53, PTEN, PI3K, p-PI3K, AKT and p-AKT protein in THP-1 cells

与pcDNA3.1-NC组比较,***P<0.001图8 上调RPLP0对THP-1细胞中p53、PTEN、PI3K、p-PI3K、AKT和p-AKT蛋白表达的影响Figure 8 The effect of RPLP0 up-regulation on the expression of p53, PTEN, PI3K, p-PI3K, AKT and p-AKT protein in THP-1 cells
控制细胞增殖和凋亡是癌症治疗的主要方向。为了考察RPLP0是否影响AML细胞的存活,本研究通过MTT法检测了上调或下调RPLP0对THP-1细胞增殖的影响,通过Annexin Ⅴ-FITC/PI染色法检测了RPLP0对细胞凋亡的影响,结果表明,下调RPLP0抑制了THP-1细胞增殖并促进了细胞凋亡,另外上调RPLP0促进了THP-1细胞增殖,但未影响细胞凋亡。在其他癌症类型中也有类似的文献报道[9]。例如,胃癌N87细胞系和胃癌组织样本中RPLP0高表达;酵母双杂交分析免疫共沉淀实验证实RPLP0与人组织蛋白酶X(cathepsin X,CTSX)蛋白存在相互作用;RPLP0基因下调导致胃癌细胞G1期阻滞并增加细胞凋亡;RPLP0基因下调可能通过下调CDK2来抑制细胞生长和细胞周期进程,进一步研究表明,RPLP0影响p21的表达[9]。还有文献报道,NONO(一种RNA/DNA结合蛋白)通过将RPLP0募集到DNA损伤位点来增强结直肠癌细胞的抗辐射能力和DNA损伤修复能力[10]。这些结果说明RPLP0在多种癌症中发挥致癌基因的功能,通过影响癌细胞增殖、凋亡等功能来调节癌症的恶性行为。
p53蛋白是由抑癌基因TP53编码的蛋白,当细胞受到外源刺激时,p53可表现出抗肿瘤活性,可以调节细胞周期停滞、衰老、凋亡等生物过程[21]。p53通过调节凋亡相关基因的转录来调节细胞凋亡,如Bcl-2家族的促凋亡成员[22]。p53依赖性凋亡途径也是癌症治疗的重要方向之一。本研究通过string数据库预测了RPLP0与TP53之间存在互作关系,因此推测RPLP0可能通过与p53蛋白相互作用来影响THP-1细胞的凋亡。进一步的研究表明,下调RPLP0促进了THP-1细胞中p53的蛋白表达,而上调RPLP0则起到了相反的作用,表明RPLP0的癌基因作用部分依赖于p53蛋白的活性。在其他文献中,Artero-Castro等[8]检测了32例子宫内膜癌患者中RPLP0、RPLP1和RPLP2的mRNA表达量。与正常组织相比,肿瘤组织中RPLP0、RPLP1和RPLP2的mRNA表达量均显著升高,并且,这些蛋白的高表达与p53表达和淋巴结转移相关[8]。因此,RPLP0可能在多种癌症类型中通过p53依赖性凋亡途径影响癌细胞的凋亡。
PTEN/PI3K/AKT信号通路通过调节细胞增殖、分化、侵袭和转移,在多种肿瘤的发生和发展中起着至关重要的作用[23]。PTEN蛋白是一种双特异性磷酸酶,其主要功能是通过将PIP3去磷酸化为PIP2来负调控PI3K/Akt信号转导[24]。失活的PTEN导致PIP3的积累,从而增加PI-3K/Akt信号,促进癌症的发生[25]。大量研究表明,PI3K/Akt信号在AML患者的原始细胞中经常被激活,并且对这些细胞的增殖、存活和耐药性有很强的促进作用[26,27]。此外,p53与PTEN均是早期发现的抑癌因子,并且两种蛋白之间存在交互作用,在大多数癌症中发生突变并影响癌症进展[28-30]。本研究结果表明,下调RPLP0促进了THP-1细胞中PTEN的蛋白表达,并抑制了下游PI3K/Akt信号的激活,而上调RPLP0则起到了相反的作用,这些结果充分说明RPLP0在AML中的作用至少部分是通过p53-PTEN-PI3K-AKT轴实现的。
综上所述,本研究结果表明下调RPLP0的表达可抑制AML细胞的增殖并诱导凋亡,RPLP0对AML细胞增殖和凋亡的影响是通过p53-PTEN-PI3K-AKT轴介导的。

