尿液中miRNA-24-3p 联合miRNA-222-3p 检测在前列腺癌中的诊断及临床意义
任超
(1.天津医科大学人民医院临床学院,天津 300121;2.天津市滨海新区大港医院检验科,天津 300270)
前列腺癌是男性第二常见的恶性肿瘤,也是第五大致死癌症。目前,血清前列腺特异性抗原(PSA)水平升高(≥10 ng/mL)和(或)可疑直肠指检(DRE)进行前列腺活检和组织病理学评估,可对前列腺癌做出诊断[2]。但PSA 对前列腺癌的特异性较低,导致许多不必要的前列腺活检和前列腺癌的过度治疗[3]。因此,迫切需要一种新的无创性分子生物标志物来准确诊断前列腺癌并预测其预后,以提高临床诊断水平及做出治疗决定。MicroRNAs(miRNAs)是一类小的非编码RNA[4],已发现超过2 500 个成熟的miRNA[5],每个miRNA 都有可能调控数百个基因[6],miRNAs 因其检测的稳定性好,被认为是很好的生物标志物。研究表明,前列腺癌患者组织和血液(血清/血浆)样本中的miRNAs 表达发生改变,可作为前列腺癌分期或诊断、预后的标志分子[7-10]。miRNA-24 与miRNA-223、-375 表达差异的变化联合可作为前列腺癌患者的诊断分子标志物[11]。此外,miRNA-222-3p 可能通过负调控SNAP91 的表达在转移性前列腺癌中发挥重要作用[12],但其是否可作为前列腺癌诊断或预后的标志分子尚无报道。本研究联合检测miRNAs 在不同前列腺癌分期患者尿液中的表达。通过进一步分析差异表达的miRNAs,寻找稳定、可靠的前列腺癌诊断标志分子,同时通过比较不同Gleason 分级组间的表达差异,以期改善前列腺癌的危险分层,指导个性化的治疗决策。
1 对象及方法
1.1 研究对象及分组 收集2016 年1 月—2021 年12 月在天津市滨海新区大港医院检验科因排尿困难、尿失禁等临床症状接受检查且PSA(4~25 ng/mL)中度升高患者的尿液和血清,初步进行miRNAs 芯片筛选组的样本分为两组:对照1 组(6 例良性前列腺增生患者)及PC1组(18 例,根据Gleason 评分进一步分为3 组,即GS16 组、GS17 组、GS18 组,各6 例)。另外,miRNAs 表达验证时样本组分为4 组:对照2组(20 例良性前列腺增生患者),PC2组59 例,PC2组根据Gleason 评分进一步分为3 组:GS26 组22例,GS27 组19 例及GS28 组18 例。PC 组患者纳入标准:经病理切片证实;首次诊断。排除标准:他处具有原发性肿瘤;术前具有放化疗治疗;不配合试验者。所有受试者在参加本研究之前均知情同意。
1.2 miRNA 提取及逆转录 收集的血清和首次排尿样本最初储存在4℃,在6 h 内将其等分并转移至-80℃冰箱储存。所有患者均行经直肠超声引导活检。用差速离心法从38.5 mL 的尿液获得无细胞尿液,在4℃,13 000 ×g 离心10 min,去上清以去除碎屑和盐。进一步将上清液超速离心13 000×g,10 min,最终获得的颗粒再用250 μL PBS 悬浮,然后储存在-80℃供以后使用。患者血清在30℃静置10 min,去除剩余细胞和细胞碎片。在13 000×g,10 min 进一步超速离心上清液后并用PBS 洗涤,重复两次,最终获得的颗粒100 μL PBS 再悬浮,然后储存在-80℃供以后使用。用miRNeasy 小试剂盒(Qiagen,Venlo,Netherlands)和净化试剂盒(Qiagen)分离miRNA 和mRNA,Nanodrop 紫外吸收测定法测定RNA 在波长260 nm 和280 nm 的吸收值,获得RNA 的浓度并通过A260/280 及A260/230 的吸收比值判断RNA 的纯度。
1.3 人类miRNA 芯片检测miRNA 表达水平 利用人类miRNA Microarray,Release 21.0(G4872A,Agilent)芯片检测技术,制备荧光标记探针,miRNA 3′端进行Cy 荧光标记,采用SurePrint 原位喷墨合成技术合成60-mer 用于与芯片杂交的荧光探针。芯片杂交,取约100 ng 量的质检达标样本,与miRNA 芯片进行杂交,检测miRNA 的表达。
1.4 qRT-PCR 验证候选miRNA 标志分子的表达水平 利用Arraystar SYBR® Green qPCR Master Mix(ROX-)(AS-MR-005-5,康成生物)进一步验证miRNA 的表达水平,反应体系为:样本200 ng(2 μL),上下游引物(10 μmol/L,1.5 μL),SYBR® Green(10 μL),DERC 水(6.5 μL)。反应程序为:95℃20 s,随之进行40 个循环:95℃10 s,60℃20 s,70℃10 s,并在7900 real-time PCR 仪上进行检测。以稳定表达的miRNA-200b-3p,miRNA-27b-3p 做内参[13]。引物序列如下:miRNA-200b-3p:上游:5′-GCTGCTGAATTCCATCTAATTTCCAAAAG-′;下游:5′-TATTATGGATCCGCCCCCAGGGCAATGGG-3′;miRNA-27b-3p:上游:5′-AGCGTTCACAGTGGCTAAG-3′,下游:5′-TCCTCCTCTCCTCTCCTCTC-3′;miRNA-24-3p:上游:5′-ACAGCAGGCACAGAGAGGGG-3′,下 游:5′-CTGGCTCAGTTCAGCAGG AACAG-3′;miRNA-222-3p;上游:5′-GGGGAGCTACAT CTGGCT-3′,下游:5′-TGCGTGTCGTGGAGTC-3′。miRNAs 表达量计算公式为:差异倍数=2-(△△Ct),其中△Ct=Ct(miRNA)-Ct(miR-200b-3p,miR-27b-3p),△△Ct=△Ct(病例组)-△Ct(对照组)
1.5 统计学处理 利用SPSS 16.0 软件进行Student t 检验用以组间差异统计学分析,正态分布的计量资料用±s 表示。计量资料采用n(%)表示,频数小于5 的数据采用Fisher 精确概率法。绘制受试者工作特征曲线(ROC 曲线),计算曲线下面积(AUC)。P<0.05 为差异有统计学意义。
2 结果
2.1 尿液中miRNAs 差异表达 针对miRNAs 筛选组样本进行miRNA 芯片检测(表1),结果发现,与对照1 组相比,PC1组(包括GS16、GS17、GS18组)年龄差异均无统计学意义(P<0.05);GS18 组PSA≥10 ng/mL 者的例数更多(P=0.03)。与对照1 组相比,各miRNAs 均一化表达量(1±0.07),共有20 个miRNAs表达发生显著差异性改变,其中11 种miRNAs 显著性下调,9 种miRNAs 显著性上调(表2),其中,表达差异最为显著的两个miRNAs:miRNA-24-3p(-2.58±0.022)及miRNA-222-3p(-2.89±0.029)表达比对照1 组显著下调。
表1 临床样本信息表[±s,n(%)]Tab 1 Clinical sample information form[±s,n(%)]

表1 临床样本信息表[±s,n(%)]Tab 1 Clinical sample information form[±s,n(%)]
注:GS:Gleason 评分;PC:前列腺癌;PSA:血清前列腺特异性抗原
组别 年龄(岁) PSA(<10 ng/mL)PSA(≥10 ng/mL) GS对照1 组(n=6) 65.5±1.5 6(100) 0(0)PC1 组GS16(n=6) 66.4±1.2 5(83) 1(17) 3+3 GS17(n=6) 74.0±2.3 3(50) 3(50) 3+4 GS18(n=6) 78.2±2.5 1(17) 5(83)a 4+4 χ2/F 10.61 10.27 21.56 P 0.09 0.07 0.03
2.2 RT-PCR 验证差异miRNA 的表达水平 利用RT-PCR 在验证样本组(表3)中进一步验证这些差异miRNAs 基因的表达水平,结果提示,与对照2 组相比,GS27 组miRNA-24-3p 显著下调,与GS27 组相比,GS28 组miRNA-24-3p 显著下调。与对照2组相比,PC2 组中miR-222-3p 都显著下调。与GS26 组、GS27 组相比组,GS28 组显著下调(图1)。
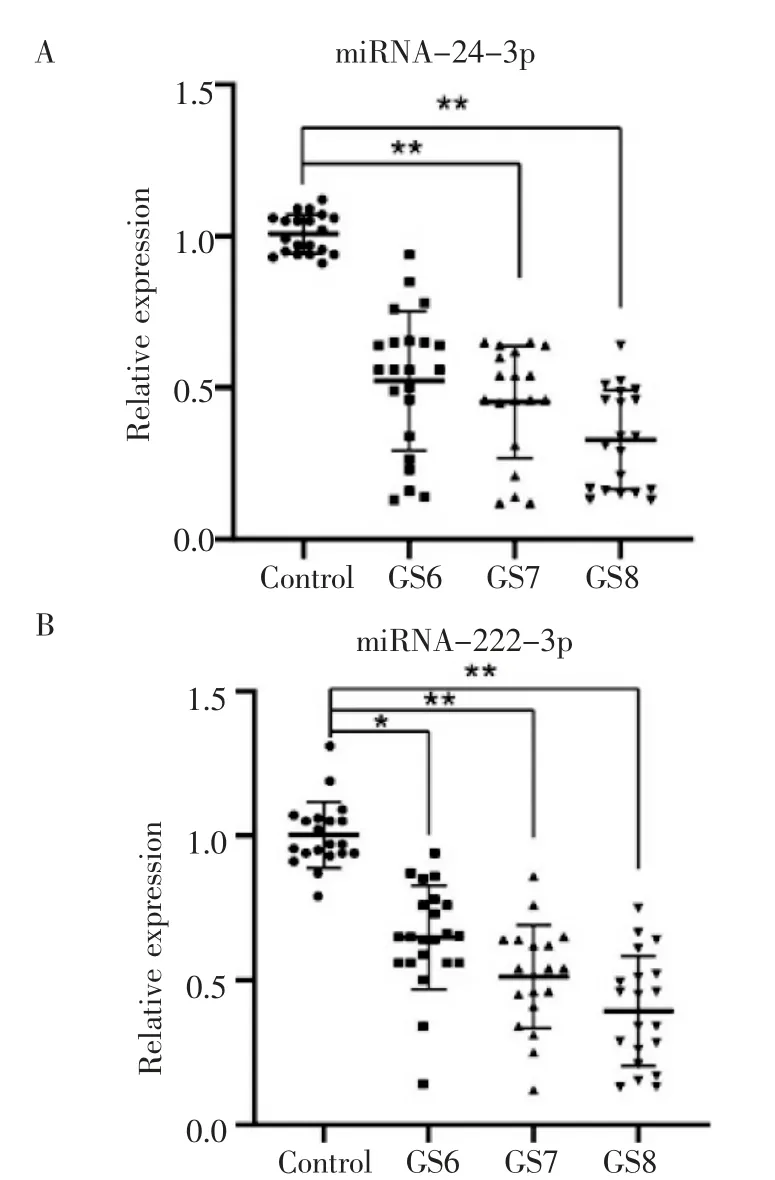
图1 RT-PCR 验证各组尿液样本中miRNAs 表达水平Fig 1 Validation of miRNAs expression levels in urine samples by RT-PCR
表3 验证miRNAs 表达的样本信息[±s,n(%)]Tab 3 Samples clinical characteristics for miRNAs expression validation[±s,n(%)]
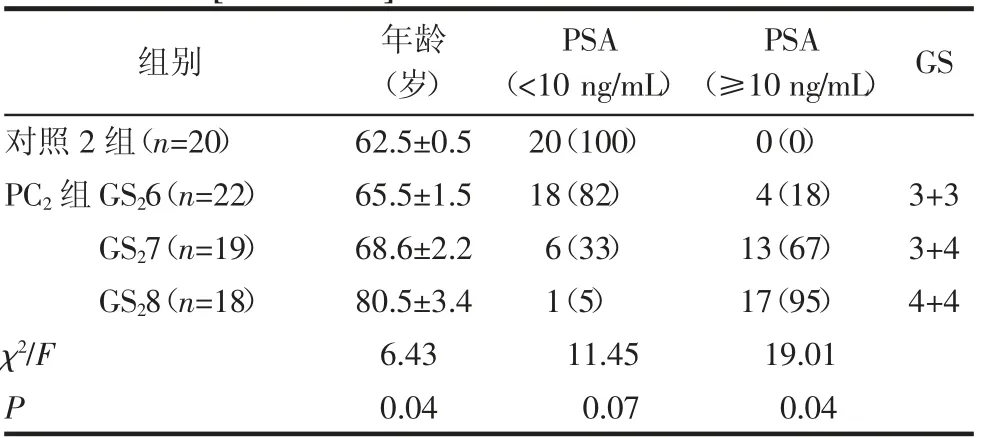
表3 验证miRNAs 表达的样本信息[±s,n(%)]Tab 3 Samples clinical characteristics for miRNAs expression validation[±s,n(%)]
注:GS:Gleason 评分;PC:前列腺癌;PSA:血清前列腺特异性抗原
组别 年龄(岁)PSA(<10 ng/mL)PSA(≥10 ng/mL) GS对照2 组(n=20) 62.5±0.5 20(100) 0(0)PC2 组GS26(n=22) 65.5±1.5 18(82) 4(18) 3+3 GS27(n=19) 68.6±2.2 6(33) 13(67) 3+4 GS28(n=18) 80.5±3.4 1(5) 17(95) 4+4 χ2/F 6.43 11.45 19.01 P 0.04 0.07 0.04
在血清样本中,利用RT-PCR 进一步检测差异miRNAs 基因的表达水平,结果表明,与对照2 组相比,GS28 组miRNA-24-3p 及miR-222-3p 显著下调(图2)。根据miRNA-24-3p 及miRNA-222-3p 作为联合诊断指标绘制ROC 曲线。如图3 所示,AUC值为0.93(OR=1.37,95% CI:0.92~1.76,P=0.02),提示miRNA-24-3p 及miRNA-222-3p 表达量改变联合诊断前列腺癌的应用价值较高。

图2 RT-PCR 验证各组血清样本中miRNAs 表达水平Fig 2 Validation of miRNAs expression levels in serum samples by RT-PCR

图3 miRNA-24-3p 及miRNA-222-3p 联合诊断前列腺癌的受试者工作特征曲线Fig 3 Receiver operating characteristic curve of the combination of miRNA-24-3p and miRNA-222-3p model as diagnostic subjects for prostate cancer
3 讨论
本研究在筛选阶段,筛选到20 个差异表达的miRNAs 后,进行了第二阶段的验证,最终鉴定出2种稳定下调的尿液、血清miRNAs(miR-24a-3p、miR-222-3p),同时比较不同GS 其表达差异,证明其在前列腺癌诊断及GS 危险分层中具有较高的准确性,可能成为未来前列腺癌诊断的分子特征。
迄今为止,越来越多miRNAs 被认为可作为前列腺癌诊断、分级、预后的标志分子。2017 年,丹麦奥胡斯大学医院研究团队针对第一组样本:20 例良性前列腺增生(BPH)及188 例前列腺癌患者的无细胞尿液,应用qRT-PCR 检测92 种miRNAs 的表达水平,结果显示,相比BPH 组,前列腺癌组14 种miRNAs 表达水平显著升高,30 种miRNAs 表达水平显著下降。进一步在第二组样本:20 例BPH 及197 例前列腺癌患者中,检测该92 种miRNAs 的表达水平,发现在前列腺癌组中,有6 种miRNAs 表达水平显著升高,22 种miRNAs 表达水平显著下降。合并分析两组样本中存在表达差异的miRNAs,筛选到miRNA-222-3p、miRNA-24-3p 及miRNA-30c-5p 这一差异表达的miRNAs 组合,在第一组中鉴别诊断前列腺癌的准确率达95%,在第二组中诊断前列腺癌准确率为89%。且在PSA<15 ng/mL 的患者中,对第一组及第二组样本队列中前列腺癌组的确诊率也可高达97%与89%,提示该miRNAs 组合可作为前列腺癌患者早期诊断的标志物[10]。在该组合中,miRNA-222-3p、miRNA-24-3p 在前列腺癌组中显著下调,而miRNA-30c-5p 则显著上调。该研究团队于2019 年,利用类似的方法分析得到包含miRNA-151a-5p、miRNA-204-5p、miRNA-222-3p、miRNA-23b-3p 和miRNA-331-3p 的组合多标志物模型,该模型与前列腺癌根治性手术后是否生化复发,及前列腺癌患者的危险分级显著相关[14]。日本大阪大学医学研究院研究团队于2021 年针对PSA 水平升高的直肠指检阳性患者及阴性患者尿液细胞外小泡,进行芯片检测分析miRNAs 表达水平,发现miRNA-30b-3p 和miRNA-126-3p 在前列腺癌患者中显著高表达,其预测前列腺癌发生的敏感性和特异性分别为46.4%和88.0%、60.7%和80.0%,优于血清PSA(分别为53.5%和64.0%),可作为预测前列腺癌的分子标志物[7]。同年,韩国一项研究对149例前列腺癌患者尿液外体miRNA 表达谱进行鉴定,发现miRNA-21、miRNA-16、miRNA-142-3p、miRNA-451 在前列腺癌中表达显著上调,而miRNA-636 显著下调。当综合评估临床因素时,miRNA-21、miRNA-451、miRNA-636,及术前PSA 水平在多因素分析中仍有显著性差异。在此基础上,该研究团队建立了前列腺癌转移风险评分(PCa-MRS)模型。PCa-MRS 显示出优于术前PSA 或临床GS 的分层能力(AUC=0.925)。得分高的患者生化无复发生存率明显低于得分低的患者[8]。此外,扬州大学研究团队检测前列腺癌患者及正常对照组外周血血清中168 种miRNAs,发现miRNA-146a-5p、miRNA-24-3p 及miRNA-93-5p 水平显著升高,可作为前列腺癌患者无创性诊断标志物[15]。
本研究提出miRNA-24-3p 可作为前列腺癌患者鉴定标志分子,其机制被认为是通过调节细胞因子通路,进而影响前列腺癌细胞的迁移、侵袭、增殖[16]。另有研究发现,miRNA-24-3p 可通过调控fascin1(FSCN1),影响前列腺癌的耐药性[17]。在高危的前列腺癌患者中,miRNA-222-3p 可靶向调控血管内皮生长因子受体2/KDR 蛋白[18]。但这两种miRNAs具体的机制及是否存在协同靶向作用需进一步明确。
综上所述,本课题组确定了一个用于前列腺癌诊断、分层的miRNA 组,今后将进一步在更大的样本中验证及统计,以期在未来的临床中准确应用。

