肿瘤相关成纤维细胞外泌体miR-34c-5p调控喉癌干细胞样生物学特性的体外实验研究△
次旺卓玛 吴春萍 柳晓进 黄强 蔡国遇 格桑 周梁 杜怀栋
(1.西藏自治区日喀则市人民医院耳鼻咽喉科 西藏 857000;2.复旦大学附属眼耳鼻喉科医院耳鼻咽喉科 上海 200031)
肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)是肿瘤微环境中最重要的基质细胞,具有明显的促进肿瘤生长效应,对于肿瘤的发生和进展起到至关重要的作用[1]。CAFs能够增强乳腺癌[2]、胃癌[3]、结肠癌[4]及肝癌[5]等多种肿瘤细胞的干细胞样生物学特性及肿瘤干细胞(cancer stem cells,CSCs)的自我更新能力[例如提高干细胞相关基因(SOX2及BMI1等)表达及增强球体形成能力等]。近年来发现CAFs可通过外泌体这一重要介质调控肿瘤细胞的生物学特性。外泌体是直径为30~150 nm的微囊泡结构,包裹着蛋白质、mRNA、miRNA、lncRNA等生物活性分子,是肿瘤微环境细胞之间信息传递的重要载体[6]。CAFs分泌的外泌体miR-34a-5p能够调控口腔癌细胞的增殖、侵袭等肿瘤干细胞样生物学特性[7]。然而,在喉癌CAFs对喉癌细胞生物学特性的调控作用中是否存在类似的调控机制以及究竟是何种miRNA起到这样的关键调控作用尚不清楚。
我们的前期预实验表明,喉癌组织中分离出来的CAFs无论是通过和喉癌细胞共培养还是用CAFs的培养液上清,都能够明显促进喉癌细胞系的体外增殖、迁移、侵袭及体内成瘤等CSC样生物学特 性[8]。因此推测,喉癌CAFs外泌体中存在异常表达的miRNAs,这类miRNAs借助于CAFs外泌体传递给喉癌细胞并对后者进行了生物学特性的调控。我们的前期高通量测序检测发现,原代培养的喉癌CAFs外泌体中存在异常表达的几个关键miRNAs,其中miR-34c-5p表达显著下调。本研究的目的为进一步验证表达下调的外泌体miR-34c-5p对喉癌细胞的增殖、侵袭、球体形成及平板克隆形成能力等CSC样生物学特性的影响。
1 材料与方法
1.1 细胞培养 喉癌CAFs的原代培养及鉴定参见文献[8]。CAFs 培养于高糖DMEM (4 500 mg/L,Hyclone,美国) +1%青链双抗(Invitrogen,美国)+10%无外泌体胎牛血清(fetal bovine serum,FBS,Invitrogen,Gibco)中。AMC-HN-8细胞系来源于复旦大学附属眼耳鼻喉科医院头颈外科课题组并且培养于DMEM或来自CAFs的不同条件培养基(conditioned medium,CM) 。2种细胞均置入37 ℃、5% CO2培养箱培养。
1.2 CAFs外泌体提取及鉴定
1.2.1 外泌体提取 本研究采用试剂盒法提取CAFs外泌体,参照课题组先前的方法[9],将CAFs培养液上清4 ℃离心(1 500×g,10 min);再取上清4 ℃离心(10 000×g,30 min);再用0.22 μm滤膜过滤去除细胞碎片以及用超滤离心(Amicon® Ultra-15 100 kDa;Merck KGaA)进行浓缩;之后用外泌体提取试剂盒(Ribo™ Exosome Isolation Reagent,锐博生物,广州),根据操作说明进行外泌体提取。收集的CAFs外泌体沉淀,加入磷酸盐缓冲液(phosphate buffer saline,PBS)后保存于_80 ℃备用。
1.2.2 外泌体鉴定 采用纳米粒径追踪分析(nanoparticle tracking analysis,NTA)检测外泌体粒子的大小和浓度。取100 μL外泌体悬液,4 ℃ PBS 稀释后加入比色皿,置入粒度电位仪样品池,布朗运动(60 s)后用粒子追踪软件分析纳米粒子的大小、分布和浓度。
采用透射电镜(transmission electron microscopy,TEM) 观察外泌体颗粒的外貌和大小。取PBS稀释后的外泌体悬液20 μL,滴加到碳覆膜铜网后吸除多余液体。室温过夜后用1%戊二醛固定及醋酸双氧铀染色(避光,30 s),吸除多余液体。室温风干后80 kV TEM观察并拍照。
采用Western印迹检测外泌体蛋白标记物。用RIPA裂解液(碧云天,南通)裂解对照细胞及外泌体,测定蛋白浓度。蛋白分离用SDS凝胶(碧云天)电泳,再转PVDF膜(Millipore,美国)。5%脱脂奶粉封闭后加入兔一抗CD63 (1∶1 000,Abcam,美国)、calnexin (1∶2 000,Abcam) 及TSG101 (1∶2 000,Abcam)4 ℃过夜孵化,随后加入辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗(1∶2 000,Jackson)室温孵化1 h。最后用BeyoECL Plus试剂盒(超敏ECL化学发光试剂盒,碧云天)显色并拍照。
1.3 miR-34c-5p过表达及转染效率评估 以真核表达载体pcDNA6.2-GW/EmGFP-miR (Invitrogen)为基础,用分子克隆的方法构建miR-34c-5过表达质粒。将CAFs接种于6孔板,密度为2×105个细胞/孔。培养24 h,用Lipofectamine 2000瞬时转染(按操作说明进行)。对照组(NC)为转染无关干扰序列的CAFs。用250μL Opti-MEM I(Invitrogen)稀释4 μg过表达/空载质粒,用250 μL Opti-MEM Ⅰ 稀释10 μL Lipo2000,室温静置5 min后将两者轻轻混匀,室温下再静置20 min后加入6孔板培养,Mock对照组为只添加Lipofectamine 2000的CAFs,空白对照组为不添加任何试剂的CAFs。miR-34c-5p过表达效果的验证采用实时聚合酶链反应 (real time polymerase chain reaction,RT-PCR)法,snRNA U6为内参。miR-34c-5p转染效率用转染后4~6 h显微镜下CAF荧光细胞计数/同一视野白光细胞计数比例进行评估。
1.4 CAFs外泌体miR-34c-5p过表达RT-PCR验证 收集以下4组不同CAFs CM培养液上清的外泌体,用RT-PCR验证各组miR-34c-5p表达水平。第①~③组:将miR-34c-5p过表达CAFs的实验组、NC组及Mock组均培养48 h,收集培养液上清,用以上试剂盒法提取外泌体备用。第④组为不做任何处理的CAFs,培养48 h。提取培养液上清中的外泌体备用,作为空白对照。TRIzol法提取4组外泌体提取物中的RNA,用PrimeScriptTM RT reagent Kit 试剂盒(Takara,大连)逆转录RNA,PCR扩增用SYBR® Premix Ex TaqTM 试剂盒(Takara,大连) 根据说明操作。snRNA U6为内参,2-ΔCT法计算miR-34c-5p的相对表达水平。热循环条件:95 ℃ 预变性30 s,40个循环(95 ℃ 变性5 s及60 ℃退火延伸34 s),溶解曲线(95 ℃ 15 s,65 ℃ 1 min,95 ℃ 15 s)。引物序列见表1。

表1 miRNAs引物序列
1.5 2种CAF外泌体CM的制备 将未处理CAFs及过表达miR-34c-5p的CAFs培养48 h后收集培养液上清,按照以上1.2.1试剂盒法提取外泌体。以5 mL CAFs培养液上清所提取外泌体加200 μL PBS作为后续实验的外泌体母液制备CM,保存于-80 ℃。分别命名为未处理CAF exosome CM及miR-34c-5p 过表达CAF exosome CM。
1.6 增殖实验 用CCK-8试剂盒实验来检测各组喉癌细胞增殖能力的差异。将喉癌AMC-HN-8细胞消化后悬浮于高糖DMEM +1%青链双抗+10%无外泌体FBS培养液中。向培养液中分别加入以上2种不同的CAFs外泌体母液,每5 mL培养液中加入以上2种不同外泌体母液400 μL,调整细胞浓度为104个细胞/mL,取0.2 mL接种于96孔培养板,密度为2 000个细胞/孔。以不加外泌体CM的AMC-HN-8细胞为对照。在细胞培养的0、24、48、72、96 h分别用CCK-8试剂盒检测,按照说明书操作,37°C孵化 3 h,每组设置6个复孔,并设置只加培养液不加细胞的6个孔为空白对照,酶标仪检测波长为450 nm的吸光度值。
1.7 侵袭实验 用Transwell检测各组喉癌细胞的侵袭能力。将喉癌AMC-HN-8细胞消化后悬浮于高糖DMEM +1%青链双抗培养液(不含FBS)中,调整细胞浓度为104个细胞/mL,取0.2 mL接种于底部含基质胶的Transwell上室(Corning,美国,孔径8 μm),向每孔上室中加入50 μL 以上2种不同的CAFs外泌体母液。Transwell下室中加入600 μL无外泌体10%FBS血DMEM。以不加外泌体CM的AMC-HN-8细胞为对照。培养24 h后从培养箱取出上室,弃培养液后PBS 洗涤,用棉签擦净上室底部上表面喉癌细胞。将上室底部用多聚甲醛固定20 min后再用0.25% 结晶紫染液染色15 min。显微镜下观察上室底部下表面穿过Transwell 小孔的喉癌细胞个数,取10个随机视野进行计数。
1.8 无血清球体实验 将喉癌AMC-HN-8细胞消化后悬浮于无血清培养液StemPro NSC SFM kit (A10509-01,Invitrogen),密度为5 000个细胞/mL,接种于6孔板,每孔2 mL。向每孔培养液中分别加入以上2种不同的CAFs外泌体母液160 μL,以不加外泌体CM的AMC-HN-8细胞为对照。置入培养箱培养 10 d后在相差显微镜下观察3组细胞的球体形成情况。1.9 平板克隆实验 将喉癌AMC-HN-8细胞消化后悬浮于高糖DMEM +1%青链双抗+10%无外泌体FBS培养液。向培养液中分别加入以上2种不同的CAFs外泌体母液,每5 mL培养液中加入母液400 μL,调整细胞浓度为150个细胞/mL,取2 mL接种于6孔培养板,密度为300个细胞/孔。以不加外泌体CM的AMC-HN-8细胞为对照。3组细胞培养2周后PBS洗涤,甲醇固定15 min,0.1% 结晶紫染色15 min,PBS洗涤后在相差显微镜下观察拍照,超过50个细胞的克隆为有效克隆。克隆形成率用如下公式计算:(有效克隆数/300)×100%。
1.10 RT-PCR检测干细胞基因mRNA表达水平 将喉癌AMC-HN-8细胞培养于加入2种不同CM(未处理CAF exosome CM和miR-34c-5p 过表达CAF exosome CM)的DMEM培养液48 h,每5 mL培养液中加入以上2种不同外泌体母液400 μL,以单独培养于相同DMEM培养基(含10%无外泌体FBS及1%青链双抗)中的喉癌AMCHN-8细胞为对照。检测3组喉癌细胞的干细胞相关基因(OCT4、SOX2、BMI1及NANOG)表达水平。TRIzol提取总RNA,PrimeScript®RT逆转录试剂盒(Takara,大连)逆转录,SYBR®Premix Ex TaqTM 试剂盒 (Takara) 根据操作说明进行PCR扩展。热循环条件:预变性 95 ℃ 10 min,40个循环(95 ℃变性15 s,60 ℃退火延伸60 s)。熔解曲线(60 ℃→95 ℃,每20 s升温1 ℃)。内参为GAPDH。采用2-ΔΔCT法计算mRNA的相对表达水平。引物序列见表2。

表2 RTPCR 引物序列
1.11 Western印迹检测干细胞基因蛋白表达水平 将3组喉癌AMC-HN-8细胞用与1.10相同的方法培养48 h。再用RIPA裂解液裂解,后续蛋白浓度检测、电泳、抗体孵化等步骤同前1.2.2。所用一抗为兔OCT4 (BIOSS,1∶1 000)、兔BMI1(Arigo,1∶1 000)、小鼠SOX2 (Arigo,1∶1 000)及兔NANOG (Abcam,1∶1 000)、兔β-actin(Abcam,1∶6 000),二抗为羊抗兔/小鼠辣根过氧化物酶 (KPL,1∶50 000) 。
1.12 统计学处理 每组实验数据至少3次重复,用均数±标准差表示。2组数据之间比较用独立样本成组t检验,设置P<0.05为差异有统计学意义。采用GraphPad Prism 9 (GraphPad Software,美国)软件 绘图。
2 结果
2.1 CAFs外泌体鉴定、miR-34c-5p过表达及转染效率评估 TEM观察发现包膜完整、直径为50~300 nm的颗粒,其中大部分颗粒直径为100~200 nm (图1A)。Western印迹结果提示CD63及 CD81阳性,这是2个经典的外泌体阳性蛋白指标。另外,蛋白标记物calnexin表达为阴性(图1B)。NTA检查结果提示粒径分布范围为(125.7±50.4)nm(图1C)。miR-34c-5p过表达转染效率为85%~90%(图1D~F)。
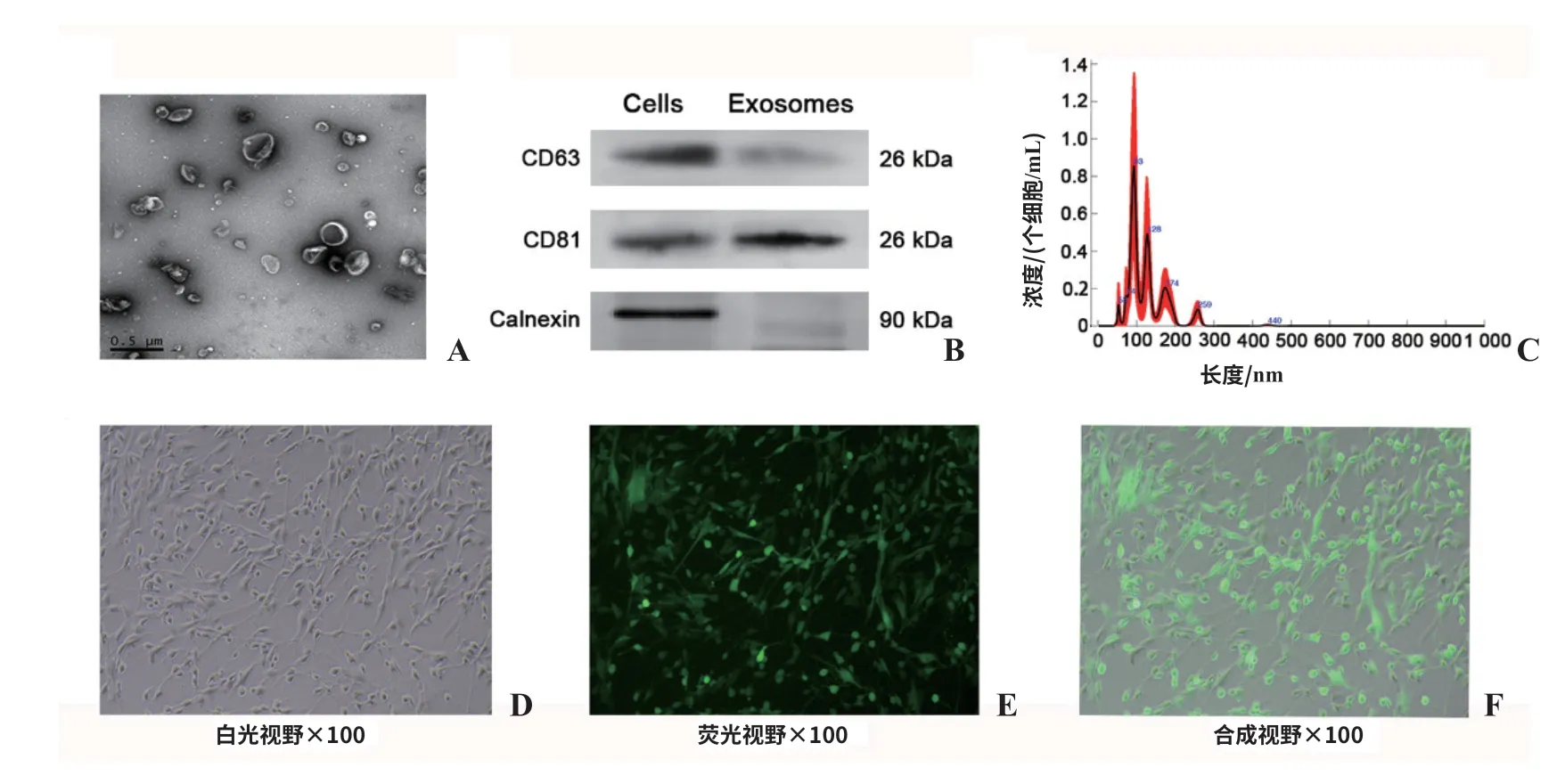
图1 CAFs外泌体鉴定及转染效率评估 A.TEM观察发现大部分颗粒的直径为100~200 nm(比例尺:500 nm);B.Western印迹发现外泌体为CD63及CD81阳性,calnexin阴性;C.NTA检查提示粒径分布直径均数为125 nm;D~F.分别为miR-34c-5p转染效率评估的白光视野、荧光视野和合成视野。
2.2 CAFs外泌体miR-34c-5p表达RT-PCR验证 miR-34c-5p表达水平最高的是miR-34c-5p过表达实验组CAFs外泌体RNA的提取物,而3个对照组(NC组、Mock组及空白对照组)CAFs外泌体RNA中miR-34c-5p表达水平均很低,3组表达水平差异无统计学意义。详见图2。

图2 4组CAFs外泌体miR-34c-5p表达RT-PCR结果 miR-34c-5p过表达实验组CAFs外泌体RNA的提取物中miR-34c-5p表达水平最高,而NC组、Mock组及空白对照组miR-34c-5p表达水平均较低。n.s.示P>0.05,**示P<0.01。
2.3 CCK8增殖及Transwell侵袭实验 CCK8增殖实验结果提示:加入未处理CAF外泌体CM后,AMCHN-8喉癌细胞的增殖能力明显增强,提示CAFs外泌体的加入明显增强了喉癌细胞的体外增殖能力。当加入miR-34c-5p过表达CAFs的外泌体CM后,CAFs的这一促增殖能力明显下降,提示外泌体miR-34c-5p的过表达抑制了这一促增殖作用(图3A、B)。
类似的,Transwell侵袭结果提示:加入未处理CAF外泌体CM后,AMC-HN-8喉癌细胞的侵袭能力明显增强,提示CAFs外泌体的加入明显增强了喉癌细胞的体外侵袭能力。当加入miR-34c-5p过表达CAFs外泌体CM后,CAFs的这一促侵袭能力明显下降,提示外泌体miR-34c-5p的过表达抑制了这一促侵袭作用(图3C)。喉癌细胞穿透基质胶的数量从多到少依次为:未处理CAF外泌体CM组(81.20±4.482)个细胞,miR-34c-5p过表达CAFs外泌体CM组(52.50±3.14)个细胞以及对照组(31.80±2.394)个细胞。详见图3D~F。
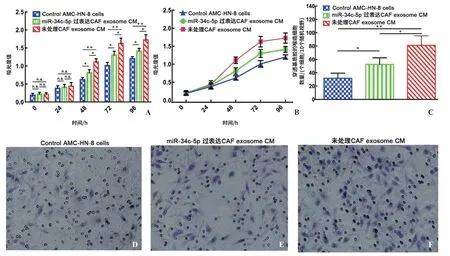
图3 CAFs外泌体miR-34c-5p调控AMC-HN-8喉癌细胞增殖和侵袭能力 A、B.3组AMC-HN-8细胞增殖能力比较统计图;C.3组AMC-HN-8细胞侵袭能力比较统计图;D~F.分别为未处理CAF外泌体CM组,miR-3c-5p过表达CAF外泌体CM组和对照组喉癌细胞Transwell侵袭实验典型低倍镜视野(×100)。*示P<0.05,**示P<0.01。
2.4 无血清球体形成及平板克隆实验 无血清球体形成实验表明,加入未处理CAF外泌体CM后,AMC-HN-8喉癌细胞的球体形成能力(球体的数量和大小)明显增强(图4C),提示CAFs外泌体的加入明显增强了喉癌细胞无血清球体的形成能力。当加入miR-34c-5p过表达CAFs的外泌体CM后,CAFs的这一促球体形成能力明显下降(图4B),提示外泌体miR-34c-5p的过表达抑制了这一促球体形成作用。
类似的,未处理CAF外泌体CM加入组AMCHN-8喉癌细胞的平板克隆形成能力也明显增强,有效克隆数量明显增多。而miR-34c-5p过表达CAFs的外泌体CM的加入能够对未处理CAF外泌体 CM的这一促进克隆形成作用起到抑制效果,平板克隆形成的数量下降。3组细胞克隆形成率依次为:对照组10.76%(32.3/300),未处理CAF外泌体CM组24.9%(74.7/300)和miR-34c-5p过表达CAFs CM组16.23%(48.7/300),见图4E、F。
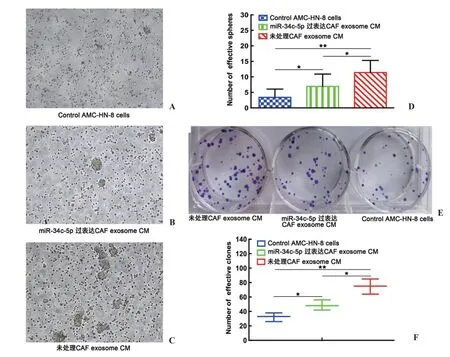
图4 CAFs外泌体miR-34c-5p调控AMC-HN-8喉癌细胞无血清球体和平板克隆形成能力 A~D.3组AMC-HN-8细胞无血清球体形成能力比较典型低倍镜视野(×100)及统计分析图;E、F.3组AMC-HN-8细胞平板克隆形成能力比较及统计处理。*示P<0.05,**示P<0.01。
2.5 CAFs外泌体miR-34c-5p调控喉癌细胞干细胞基因mRNA及蛋白表达 为了寻找CAFs外泌体miR-34c-5p CM对喉癌细胞干细胞样生物学特性调控作用的分子生物学机制,我们检测了3组喉癌细胞干细胞相关基因(OCT4、SOX2、BMI1及NANOG)的表达水平。结果发现,加入未处理CAF外泌体 CM后,AMC-HN-8喉癌细胞4个干细胞相关基因的表达水平均有所提高,提示CAFs外泌体CM的加入可以增强喉癌细胞的干细胞相关基因的表达。当加入miR-34c-5p过表达CAFs外泌体CM后,喉癌细胞4个干细胞相关基因的表达水平明显下降,提示外泌体miR-34c-5p的过表达对喉癌干细胞相关基因的表达具有抑制作用(图5A)。
同时用Western印迹验证以上4个基因蛋白表达水平的改变。结果发现了总体类似的结果,除了OCT4的对照组及miR-34c-5p过表达组之间以及BMI1的未处理CAF外泌体CM组及miR-34c-5p过表达CAF外泌体CM组之间蛋白表达水平差异无统计学意义外,4个干细胞相关基因蛋白表达水平的改变趋势基本一致。未处理CAF外泌体CM能够明显提高喉癌细胞4个干细胞相关基因的蛋白表达水平,差异有统计学意义,而miR-34c-5p过表达后CAFs外泌体CM促进以上干细胞相关基因表达的效果被抑制。详见图5B、C。
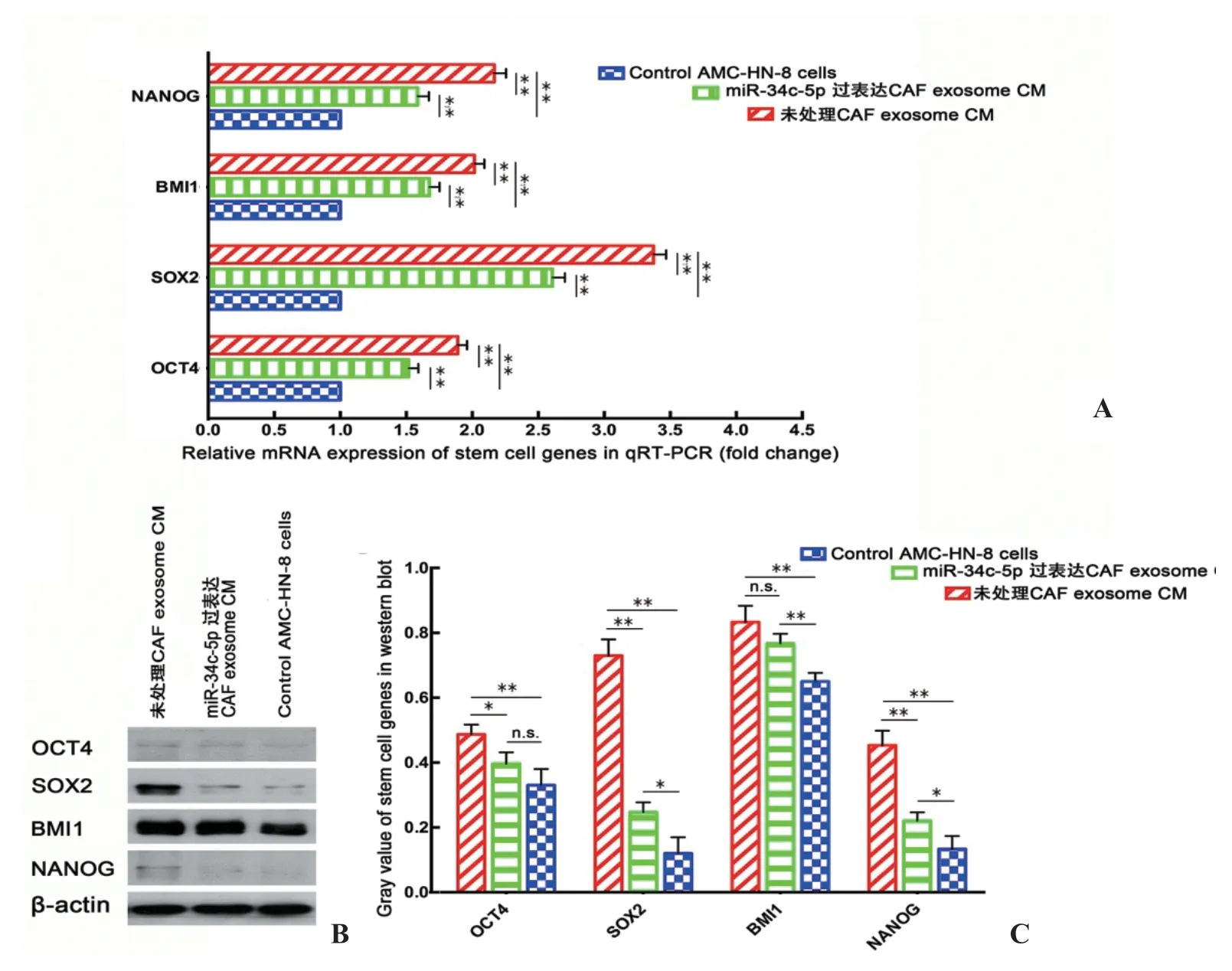
图5 CAFs外泌体miR-34c-5p调控AMC-HN-8喉癌细胞干细胞相关基因表达 A.3组AMC-HN-8细胞干细胞相关基因表达RT-PCR检测结果统计分析;B、C.3组AMC-HN-8细胞干细胞相关基因表达Western印迹检测结果及统计分析。n.s.示P>0.05,*示P<0.05,**示P<0.01。
3 讨论
外泌体是直径为30~100 nm的细胞外递质,在肿瘤细胞之间以及肿瘤细胞与其他细胞之间的信息沟通中起到关键作用。其内包裹着miRNAs、蛋白质、mRNA、lncRNA等生物活性分子[10]。肿瘤微环境中最重要的基质细胞是CAFs,CAFs产生大量的外泌体调控肿瘤细胞所处的微环境,并调控肿瘤细胞的生物学特性,促进肿瘤的侵袭和转移[11]。本研究观察到喉癌CAFs来源的外泌体对喉癌细胞增殖、侵袭、球体及平板克隆形成以及干细胞相关基因表达水平的改变等干细胞样生物学特性的调控作用,并发现这一调控作用的机制可能为CAFs外泌体中的miR-34c-5p。
外泌体的常用提取方法目前有:超速离心法、沉淀法及试剂盒法等[12]。本研究所用方法为试剂盒提取法[9]。外泌体的鉴定采用目前标准的TEM观察大小和形态,Western印迹检测蛋白标记物以及NTA检测粒径大小和浓度。结果TEM检测发现了典型的外泌体形态,Western印迹检测发现CD63及CD81表达阳性,而calnexin表达阴性,与文献报道[13-14]一致。而NTA检测发现粒径直径为(125.7±50.4)nm[15]。这3个实验结果表明,我们所提取的外泌体为合格的外泌体。
我们的前期预试验发现,miR-34c-5p在喉癌CAFs中表达很低,为了验证这样的表达水平是否对喉癌细胞的生物学特性起到关键的调控作用,我们把miR-34c-5p进行过表达,并进行了表达水平的验证。
本研究检测了CAFs外泌体miR-34c-5p对AMCHN-8喉癌细胞增殖和侵袭能力的调控作用。结果发现,未处理CAF外泌体CM的加入能够明显提高喉癌细胞的体外增殖和侵袭能力,但是如果把CAFs外泌体中的miR-34c-5p过表达,那么CAF外泌体对喉癌细胞的促进增殖和侵袭能力将明显减弱。进一步检测了CAFs外泌体miR-34c-5p对AMC-HN-8喉癌细胞体外无血清球体形成能力和平板克隆形成能力的调控作用。结果发现,未处理CAF外泌体CM的加入能够明显提高喉癌细胞的体外无血清球体形成能力以及平板克隆形成能力,但是如果把CAFs外泌体中的miR-34c-5p过表达,那么CAF外泌体对喉癌细胞的促进球体形成和平板克隆形成能力将明显减弱。
为了证实CAFs外泌体miR-34c-5p对AMC-HN-8喉癌细胞以上诸多干细胞样生物学特性(增殖、侵袭、球体及平板克隆形成)的调控作用是否存在内在的分子机制,我们进一步检测了CSCs最重要的4个基因(OCT4、SOX2、BMI1及NANOG)表达水平的改变。结果发现,加入未处理CAF外泌体CM后,AMC-HN-8喉癌细胞4个干细胞相关基因的表达水平在mRNA及蛋白层面均有不同程度提高。而当加入miR-34c-5p过表达CAFs外泌体CM后,喉癌细胞4个干细胞相关基因的表达水平明显下降,提示外泌体miR-34c-5p的过表达对喉癌干细胞相关基因的表达具有抑制作用。
综上所述,本研究观察了喉癌组织CAFs外泌体中miR-34c-3p对喉癌干细胞样生物学特性的调控作用,发现CAFs外泌体中miR-34c-3p的低表达对于喉癌细胞干细胞样生物学特性的维持至关重要。如果改变CAFs外泌体miR-34c-3p的低表达状态,喉癌干细胞样生物学特性就会受到明显抑制,包括增殖、侵袭能力,以及无血清球体形成及平板克隆形成能力。此外,CAFs外泌体miR-34c-3p的低表达状态还能够直接影响喉癌细胞干细胞相关重要基因的表达水平,如OCT4、SOX2、BMI1及NANOG。这可能是CAFs外泌体miR-656-3p对喉癌细胞干细胞样生物学特性调控的内在分子机制,为进一步的深入研究奠定了基础。

