四神丸对IBS-D模型大鼠脑肠组织Ghrelin及其受体GHSR阳性表达的影响
蔺晓源,邓娜,夏旭婷,刘富林
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208)
肠易激综合征(Irritable Bowel Syndrome,IBS)是一种以腹痛不适,排便习惯或大便性状改变为主要表现的功能性胃肠病。其全球患病率约为9%~20%,我国IBS的患病率地区差异较大,约在7%~11%[1]。临床以腹泻型肠易激综合征(Diarrhea irritable bowel syndrome,IBS-D)最为常见,占整个IBS的74%[2]。IBS-D属中医“泄泻”的范畴,发病机制尚不明确,至今亦无最佳治疗方案。目前一致认为,脑肠轴调控紊乱在IBS-D的发病中起主要作用[3],而四神丸临床用于治疗IBS-D效果显著[4-5]。因此,为了进一步明确四神丸治疗IBS-D的脑肠调控机制,本研究观察了四神丸对IBS-D模型大鼠脑肠组织中脑肠肽胃促生长素(Ghrelin)及其受体GHSR表达的影响。
1 材料与方法
1.1 动物与药物
SPF级雄性SD大鼠,60只,体质量(200±20)g,由湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK(湘)2016-002。
四神丸,北京同仁堂天然药物唐山有限公司生产(国药准字Z13020656),用蒸馏水配制成浓度分别为0.732、0.366、0.183 g/mL的混悬液冰箱保存。得舒特,法国苏威制药公司生产(注册证号H20120127),用蒸馏水配制成浓度为1.523 mg/mL的混悬液冰箱保存。番泻叶,购自湖南中医药大学第一附属医院(符合国家药典标准),传统方法煎煮后浓缩成1.0 g/mL的药液冰箱保存。
1.2 主要试剂与仪器
Ghrelin、GHSR兔抗多克隆抗体(Abcam,GR71314-1、GR80260-1),PV-6001兔二步法试剂盒、ZLI-9018 DAB显色试剂盒(中杉金桥)。赛默飞HistoStar包埋机、HM325轮转式切片机,奥林巴斯BX43荧光显微镜,海尔DW-86L386超低温冰箱。
1.3 动物分组与模型制备
先随机取10只大鼠为正常组,其余设为造模组,参考文献方法[6]采用番泻叶灌胃加避水应激法建立IBS-D大鼠模型。每天番泻叶灌胃(10 mL/kg),连续28 d后进行避水应激:每天上午将大鼠置于玻璃水槽内的中央平台上1 h,连续10 d。造模结束后再将模型大鼠随机分为模型组、得舒特组和四神丸高、中、低剂量组,每组10只。
1.4 给药与标本采集
四神丸低、中、高剂量组给予1、2、4倍临床等效剂量(1.83 mg/kg、3.66 mg/kg、 7.32 mg/kg)的四神丸混悬液灌胃,得舒特组给予临床等效剂量(15.23 mg/kg)的得舒特混悬液灌胃,模型组给予蒸馏水灌胃,正常组常规喂养。连续给药14 d。大鼠末次给药后10%水合氯醛麻醉,冰盒上开颅取脑,后腹腔剪取小段十二指肠,PBS液漂洗后放入4%多聚甲醛固定液中。
1.5 指标检测
1.5.1 大鼠的排便情况观察
在给药前后将所有大鼠单独放入垫有滤纸的小饲养笼内,记录每只在上午8—12时期间的稀便数和正常粪便数,并计算稀便率,稀便率=稀便数/(稀便数+正常粪便数)×100%[7]。
1.5.2 大鼠的肠道动力检测
给药前后各组大鼠禁食不禁水24 h,10%水合氯醛麻醉,将直径为3 mm的玻璃小球放入距肛门 3 cm处的直肠内,待大鼠苏醒后放入垫有滤纸的笼内单独饲养,观察并记录大鼠直肠内玻璃小球的排出时间[8]。
1.5.3 大鼠脑肠组织Ghrelin、GHSR的阳性表达检测
每组随机取出5个脑肠组织标本,石蜡包埋、切片脱蜡,灭活内源性过氧化酶,微波抗原热修复、封闭,依次滴加一抗(Ghrelin、GHSR)4 ℃过夜、滴加二抗37 ℃孵育30 min、滴加SABC 37 ℃孵育30 min,DAB显色,苏木素复染、封片。使用图像分析软件拍摄200倍镜下图像,选取400倍镜下阳性表达不重复的5个视野,分析Ghrelin、GHSR免疫阳性染色的平均OD值。
1.6 统计学方法

2 结果
2.1 四神丸对稀便率的影响
给药前与正常组比较,各组大鼠的稀便率均升高(P<0.01),且组间差异不显著(P>0.05)。给药后与正常组比较,模型组大鼠的稀便率升高(P<0.01);与模型组比较,各给药组的稀便率均明显下降(P<0.01) ,且以四神丸高剂量组下降最为明显(P<0.01),其余治疗组之间差异不显著(P>0.05),见表1。

表1 各组大鼠稀便率比较
2.2 四神丸对玻璃小球排出时间的影响
给药前与正常组比较,各组大鼠的玻璃小球排出时间均减少(P<0.01),且组间差异不显著(P>0.05)。给药后与正常组比较,模型组大鼠的玻璃小球排出时间显著减少(P<0.01);与模型组比较,各给药组的玻璃小球排出时间均明显增加(P<0.01) ,给药组之间的差异不显著(P>0.05),见表2。

表2 各组大鼠玻璃小球排出时间比较
2.3 四神丸对下丘脑Ghrelin、GHSR表达的影响
Ghrelin、GHSR免疫阳性细胞表达在下丘脑中为棕黄色或棕褐色染色。模型组Ghrelin、GHSR表达均较正常组明显升高(P<0.01);与模型组比较,各给药组均可下调Ghrelin、GHSR的阳性表达(P<0.05),且四神丸高剂量组的Ghrelin表达低于低剂量组(P<0.05);而四神丸高、中剂量组与得舒特组的Ghrelin表达比较差异不显著(P>0.05),各给药组的GHSR表达之间比较差异亦不显著(P>0.05),见表3,图1、2。

表3 各组大鼠下丘脑Ghrelin、GHSR表达比较
2.4 四神丸对十二指肠Ghrelin、GHSR表达的影响
Ghrelin、GHSR免疫阳性表达在十二指肠组织中分布广泛,在黏膜固有层、肌层平滑肌中均匀分布,呈棕黄色染色,其在模型组中的表达均显著高于正常组(P<0.01)。各给药组Ghrelin表达减少,与模型组比较差异均有统计学意义(P<0.05,P<0.01),且四神丸高剂量组和得舒特组优于低剂量组(P<0.05)。除四神丸低剂量组外,其余各给药组GHSR表达减少,与模型组比较差异均有显著性(P<0.05),且四神丸高、中剂量组和得舒特组优于低剂量组(P<0.05)。对Ghrelin、GHSR阳性表达的影响,四神丸高、中剂量组与得舒特组比较差异均不显著(P>0.05),见表4,图3、4。

图1 各组大鼠下丘脑Ghrelin阳性表达(×200)

图2 各组大鼠下丘脑GHSR阳性表达(×200)

图3 各组大鼠十二指肠Ghrelin阳性表达(×200)
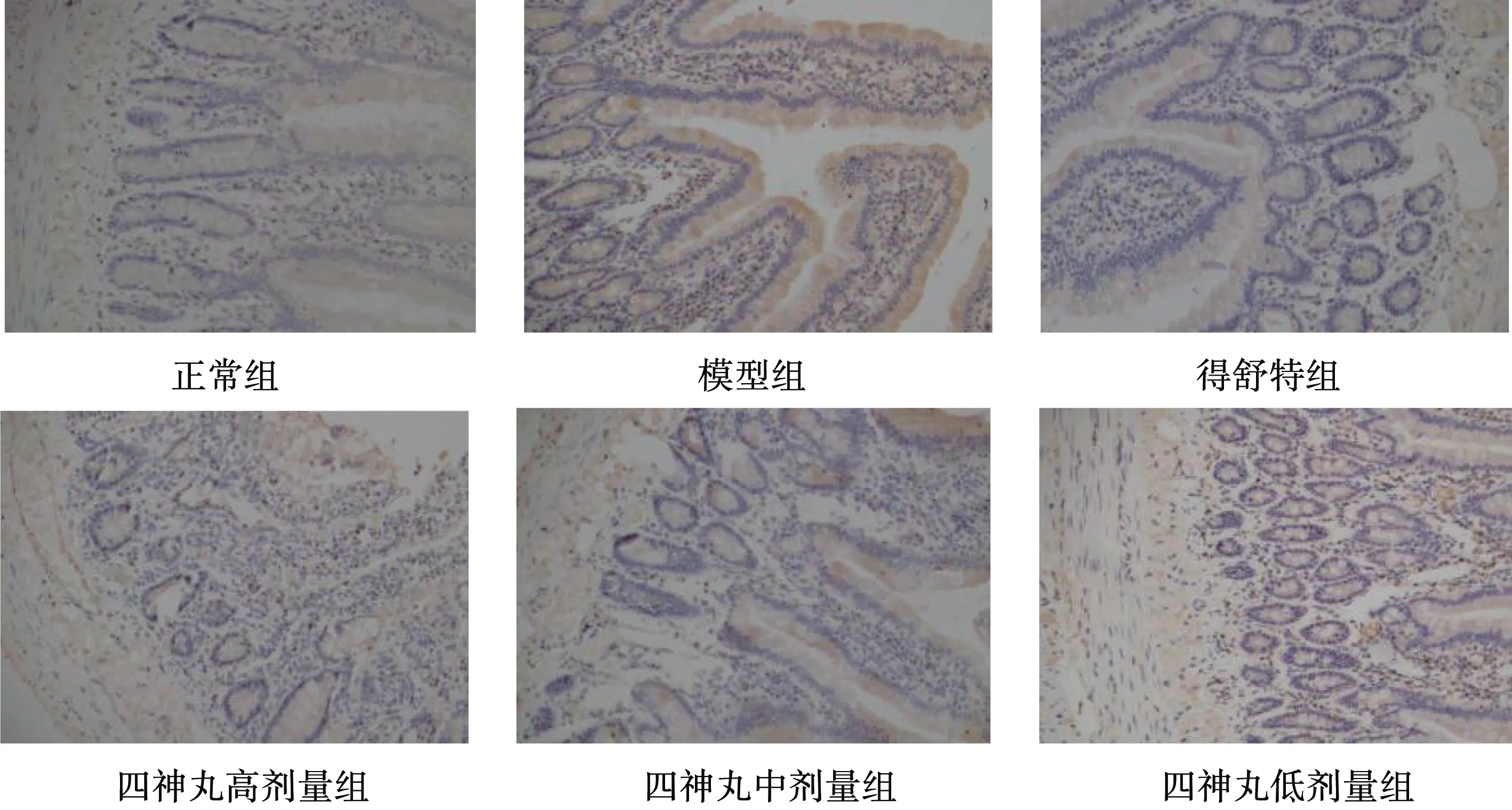
图4 各组大鼠十二指肠GHSR阳性表达(×200)

表4 各组大鼠十二指肠Ghrelin、GHSR阳性表达的平均OD值比较
3 讨论
目前虽然IBS-D的病因病机尚不明确,但多数研究已证实其与内脏高敏感、肠道动力改变及脑肠轴异常等多因素有关。肠道动力改变一直被视为IBS病发病机制的主要环节,与脑肠轴调节失衡、肠道菌群失调等因素有关,是IBS-D出现大便稀薄、次数增多的重要原因[9]。而脑肠轴调控障碍又可通过兼具神经递质与内分泌激素双重身份的脑肠肽在外周和中枢水平形成一个协调统一的整体,调节着胃肠运动、感觉及分泌等复杂功能[10]。正基于此,罗马Ⅳ标准将包括IBS在内的功能性胃肠病,重新定义为脑-肠互动异常。有临床研究发现,脾虚型IBS-D患者血清中促胃肠动力的脑肠肽5-HT、SP含量增加,而抑胃肠动力的脑肠肽VIP含量减少,说明脑肠肽调控在IBS-D的发病中起重要作用[11]。
Ghrelin是一种主要由胃组织X/A 样细胞分泌的脑肠肽,在肠道、下丘脑、垂体等组织中也有合成,其调节摄食、胃肠动力等多种胃肠道生理作用主要由其受体GHSR所介导,可经旁分泌、自分泌、远距分泌等方式,通过脑肠轴间的神经内分泌网络直接或间接地参与胃肠道活动[12]。有研究表明,IBS-D模型大鼠血清Ghrelin含量明显增加[13];GHSR缺陷(Ghsr-/-)小鼠胃排空的延迟可能与其GHSR的缺失及胃肌层中神经细胞数量的减少有关[14]。我们前期研究发现,脾肾阳虚型IBS-D大鼠脊髓组织中Ghrelin、GHSR的阳性细胞数增多,其mRNA表达也明显增加[6]。本研究结果显示,IBS-D大鼠下丘脑、十二指肠组织中Ghrelin、GHSR的阳性表达也均明显增强。
IBS-D属中医“泄泻”范畴,病位在肠,脾失健运是其关键,同时与肾密切相关。我们通过研究泄泻的中医证型、证候等分布规律发现,泄泻中脾肾阳虚证的证型比例在9.21%以上[15-16]。四神丸是治疗脾肾阳虚型泄泻的经典名方。方中君以补骨脂温肾助阳、壮火益土、暖脾止泻;臣以肉豆蔻温中涩肠;佐以吴茱萸助阳止泻,五味子收敛固涩。我们的Meta分析结果表明,四神丸治疗IBS-D临床有效率优于西药组,且安全性更高[17]。也有研究显示,四神丸治疗IBS-D的作用与保护肠黏膜屏障、改善肠道运动和内在敏感性有关[18]。我们前期研究发现,四神丸可影响脾肾阳虚型IBS-D大鼠结肠CRF的蛋白和mRNA表达[19],亦可降低模型大鼠脊髓组织中Ghrelin、GHSR的阳性细胞数和mRNA表达[6]。
本研究采用番泻叶灌胃加避水应激法建立大鼠模型,发现模型大鼠的稀便率升高,玻璃小球排出时间减少,表明该模型改变了大鼠的肠道功能,与IBS-D患者的临床症状相似。模型组的稀便率升高提示模型大鼠呈腹泻状态,四神丸各剂量组的稀便率均明显下降,表明四神丸能改善IBS-D模型大鼠的腹泻状态。模型组的玻璃小球排出时间减少提示模型大鼠的肠道转运功能发生改变,四神丸各剂量组的玻璃小球排出时间均明显增加,表明四神丸能改善IBS-D模型大鼠的肠道转运功能。此外,四神丸各剂量均可下调下丘脑中Ghrelin、GHSR和十二指肠中Ghrelin的阳性表达(P<0.01),且四神丸高剂量优于其低剂量(P<0.05);四神丸高、中剂量亦均可降低十二指肠中GHSR的阳性表达(P<0.05),且优于其低剂量(P<0.05)。该结果表明四神丸治疗IBS-D具有一定的剂量依赖性,其对IBS-D肠道运动的调控作用可能与调节Ghrelin及其受体GHSR在脑肠互动中的表达密切有关,可为探明四神丸治疗IBS-D的脑肠肽胃肠运动调控机制提供实验依据。

