核糖体合成调控因子1对人乳腺癌细胞顺铂抗性的影响及作用机制
彭翠修 王润泽 宋军莹 侯琳
(青岛大学基础医学院生物化学与分子生物学系,山东 青岛 266071)
根据2020年发布的全球癌症负担数据显示,乳腺癌的发病人数首次超过肺癌,成为全球第一大癌症,占所有新增癌症患者的12%[1]。顺铂是一种广谱抗癌药,用于包括乳腺癌在内的多种恶性肿瘤的化学治疗[2]。由于铂类药物的固有耐药性和获得性耐药性[3],致其临床应用受限[4-5]。因此,探讨乳腺癌细胞顺铂抗性的分子机制,寻找调控化疗耐药的关键性分子靶点尤为重要。
核糖体合成调控因子1(RRS1)在核糖体的生物合成过程中主要参与25S rRNA的成熟和60S核糖体大亚基的装配[6]。近年来的研究显示,RRS1基因在乳腺癌[7-9]、视网膜母细胞瘤[10]、结直肠癌[11]和肝细胞癌[12]等多种恶性肿瘤中的表达水平显著升高,且与癌细胞的增殖和凋亡密切相关[8]。研究表明RRS1与乳腺癌细胞的阿霉素抗性有关[13]。然而,尚未发现关于RRS1与顺铂抗性的研究报道。磷酸化的细胞外信号调节激酶(P-ERK)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2关联X(BAX)是调控细胞凋亡的重要蛋白。本研究采用敲降RRS1基因的方法对细胞顺铂化疗敏感性和细胞凋亡率进行分析,通过检测MCF-7/DDP细胞中ERK、P-ERK、Bcl-2和BAX蛋白的相对表达水平,探讨RRS1基因对乳腺癌细胞顺铂抗性的影响及其作用的分子机制。现将结果报告如下。
1 材料与方法
1.1 主要材料
人乳腺癌MCF-7细胞系以及人耐顺铂乳腺癌MCF-7(MCF-7/DDP)细胞系(上海传秋生物科技有限公司),Cell counting kit-8(CCK8)试剂盒、BCA蛋白质定量试剂盒、顺铂(北京索莱宝科技有限公司),Trizol Reagent、RT-qPCR试剂盒(南京诺唯赞生物有限公司),RRS1基因干扰慢病毒(上海吉凯公司),鼠抗人GAPDH单克隆抗体和兔抗人RRS1、ERK、P-ERK、Bcl-2、BAX单克隆抗体(英国Abcam公司)。
1.2 细胞培养及处理
以含体积分数0.10胎牛血清和0.01青链霉素溶液的DMEM培养基常规培养MCF-7细胞,以含体积分数0.15胎牛血清、0.01青链霉素溶液和浓度为0.15 μg/L顺铂的RPMI-1640培养基常规培养MCF-7/DDP细胞,将两种细胞均置于37 ℃、含体积分数0.05的CO2细胞培养箱内培养,待细胞生长至融合度约达80%~90%时进行传代及后续操作。
1.3 实验方法
1.3.1实时荧光定量PCR(RT-qPCR)方法检测RRS1 mRNA在MCF-7和MCF-7/DDP细胞中的表达 采用Trizol法提取细胞融合度达80%~90%细胞的总RNA,根据RT-qPCR试剂盒说明书配制相应的反应体系并进行RT-qPCR,以GAPDH作为内参照,每个样品设置3个复孔,实验重复3次,最后采用2-△△CT计算MCF-7以及MCF-7/DDP细胞中RRS1 mRNA的相对表达水平。引物序列见表1。
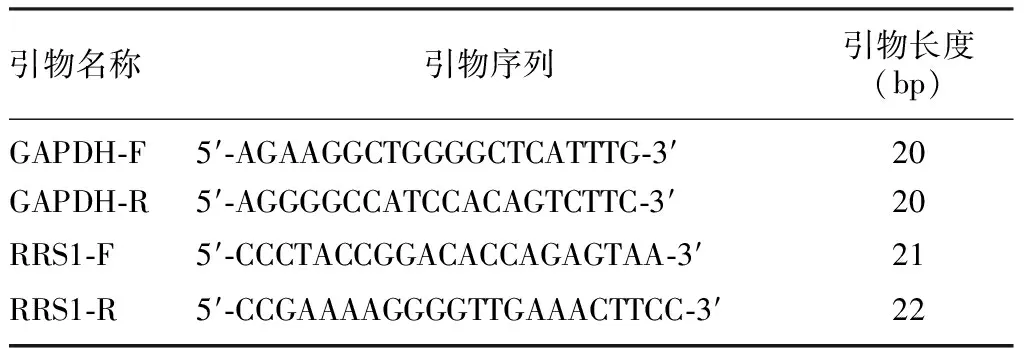
表1 RT-qPCR引物序列
1.3.2Western blot法检测MCF-7以及MCF-7/DDP细胞中RRS1的表达水平 当乳腺癌MCF-7和MCF-7/DDP细胞融合度达到80%~90%时,收集细胞并采用RIPA裂解法分别提取两种细胞的总蛋白。使用BCA法测定蛋白浓度以后,进行SDS-PAGE电泳、转膜,以体积分数为0.05的脱脂奶粉室温封闭2 h,分别以GAPDH和RRS1蛋白单克隆抗体(1∶1 000)4 ℃孵育过夜。TBST洗膜3次以后,加入相应种属的二抗溶液,室温孵育1 h,再用TBST洗膜3次。加入ECL发光液,放入成像系统显影并拍照。以GAPDH条带结果作为为内参蛋白,使用Image J软件分析蛋白条带灰度值,计算目的蛋白的相对表达量,目的蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。实验重复3次,结果取均值。
1.3.3慢病毒感染技术敲降RRS1基因效率的检测 取对数生长期的MCF-7/DDP细胞,接种于6孔板中,每孔接种2×105个细胞,待细胞培养至融合度约30%时,分别感染慢病毒shRNA-Ctrl(对照组)和shRNA-RRS1(RRS1-shRNA组),72 h后收集细胞并分别提取总RNA以及蛋白质,分别采用Western blot和RT-qPCR方法检测两组细胞中RRS1蛋白及mRNA表达水平,并计算RRS1-shRNA组细胞RRS1基因的敲降效率。
1.3.4CCK8法检测顺铂对MCF-7/DDP细胞的半数抑制浓度(IC50) 取稳定感染的对照组和RRS1-shRNA组细胞,分别在96孔板中每孔接种2 000个细胞,分别加入浓度为0.05、0.10、0.15、0.20、0.40、0.80、1.50、2.50、3.50、4.50、6.00 mg/L的顺铂。每个浓度设置3个复孔,正常条件下培养48 h后,每孔加入10 μL的CCK8试剂培养2 h,用酶标仪测定波长450 nm处各孔的吸光度值,分别计算两组细胞的IC50值。
1.3.5CCK8法检测MCF-7/DDP细胞的增殖能力取稳定感染的对照组和RRS1-shRNA组细胞,分别在96孔板中每孔接种2 000个细胞,每组设置3个复孔,共铺5个板。置于细胞培养箱中正常培养,每天任取一板检测细胞增殖能力,连续5 d。在培养结束前2 h,每孔加入10 μL的CCK8试剂培养2 h,用酶标仪测定波长450 nm处各孔的吸光度值,分别计算两组细胞的增殖能力。
1.3.6细胞周期实验检测细胞周期分布 分别收集稳定感染的对照组和RRS1-shRNA组细胞上清液,并将消化后的细胞和冲洗细胞后的PBS合并,以1 000 r/min离心5 min,弃上清液,以预冷的PBS清洗细胞1次。弃上清液,加入1.5 mL预冷的PBS和3.5 mL无水乙醇,混匀后,4 ℃固定过夜。离心弃上清液,沉淀加PBS清洗1次。沉淀物加入200 μL PBS和2 μL浓度为250 mg/L的RNA酶,置于37 ℃孵育30 min。后加入0.5 mL浓度为50 mg/L的PI溶液,室温避光孵育30 min。混匀后,用300目的尼龙筛网将细胞悬液过滤至空EP管中,立即以流式细胞仪检测两组细胞的细胞周期分布。
1.3.7Annexin V-APC/PI双染法检测细胞凋亡率分别收集稳定感染的对照组和RRS1-shRNA组细胞,计数以后每组取约5×105个细胞,置于离心机中,以600 r/min离心5 min以后,弃上清液,以预冷的PBS清洗细胞1次。加入500 μL稀释的1×Annexin V Binding Buffer工作液重悬细胞;再加入2.5 μL的Annexin V-APC染液和2.5 μL的PI染液,混匀后,室温避光孵育15~20 min。用300目的尼龙筛网将细胞悬液过滤至空EP管中,立即以流式细胞仪检测两组细胞的细胞凋亡率。
1.3.8Western blot法检测细胞中ERK、P-ERK、Bcl-2、BAX蛋白相对表达水平 取稳定感染的对照组和RRS1-shRNA组细胞,以RIPA裂解法分别提取两组细胞总蛋白。使用BCA法测定蛋白浓度后,进行SDS-PAGE电泳、转膜,以体积分数0.05的脱脂奶粉室温封闭2 h,分别以GAPDH以及RRS1蛋白单克隆抗体(1∶1 000)4 ℃孵育过夜。使用TBST洗膜3次后,加入相应种属的二抗溶液,室温孵育1 h,再用TBST洗膜3次。加入ECL发光液,放入成像系统显影并拍照。以GAPDH条带结果为内参蛋白。使用Image J软件分析蛋白条带灰度值,计算目的蛋白的相对表达量。实验重复3次,结果取均值。
1.4 统计学分析
采用Graphpad Prism 8.0进行统计学分析。计量资料以均数±标准差表示,两组比较采用t检验,多组不同时间的比较采用重复测量设计的方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 MCF-7和MCF-7/DDP细胞中RRS1 mRNA和蛋白表达水平比较
RT-qPCR检测结果显示,MCF-7细胞和MCF-7/DDP细胞中RRS1 mRNA的相对表达水平分别为1.00±0.01、3.42±0.31,两者比较差异具有显著性(t=13.50,P<0.05)。Western blot检测结果显示,MCF-7和MCF-7/DDP细胞中RRS1蛋白的相对表达水平分别为0.64±0.05、0.95±0.04,两者比较差异有显著性(t=8.29,P<0.05)。见图1。

图1 MCF-7和MCF-7/DDP细胞中RRS1蛋白表达水平
2.2 慢病毒感染MCF-7/DDP细胞的RRS1基因敲降效率
RT-qPCR检测结果显示,对照组以及RRS1-shRNA组细胞中RRS1 mRNA的表达水平分别为1.00±0.01和0.15±0.01,两组比较差异有显著性(t=86.83,P<0.05)。Western blot检测结果显示,对照组和RRS1-shRNA组细胞中RRS1蛋白的相对表达水平分别为1.04±0.16、0.31±0.10,两组比较差异有显著性(t=6.55,P<0.05)。慢病毒感染MCF-7/DDP细胞的RRS1基因敲降效率约为70%以上,可以进行后续实验。
2.3 两组MCF-7/DDP细胞对顺铂敏感性比较
对照组和RRS1-shRNA组细胞的IC50分别为(3.39±0.26)、(1.62±0.27)mg/L,两组比较差异有显著性(t=8.22,P<0.05)。
2.4 两组MCF-7/DDP细胞增殖能力比较
重复测量设计的方差分析结果显示,时间、组别和时间组别交互作用对细胞增殖能力均有显著影响(F时间=2 164.95,F组别=41.00,F交互=12.30,P<0.05)。单独效应分析结果显示,与第1天相比,对照组和RRS1-shRNA组细胞增殖能力均明显增强(F=1 241.34、935.90,P<0.05);但是RRS1-shRNA组细胞第4天和第5天的增殖能力均明显低于对照组细胞(F=17.33、70.35,P<0.05)。见表2。

表2 两组细胞的增殖能力比较
2.5 两组MCF-7/DDP细胞细胞周期分布比较
对照组和RRS1-shRNA组G1期细胞构成比分别为(33.81±2.63)%、(54.4±4.68)%,S期细胞构成比分别为(37.51±2.70)%、(18.61±2.54)%,G2期的细胞构成比分别为(28.71±2.34)%、(27.55±6.88)%,其中,两组细胞的G1期和S期细胞构成比比较,差异均具有显著性(t=6.64、8.83,P<0.05)。而两组间G2期细胞构成比比较差异无统计学意义(P>0.05)。
2.6 两组MCF-7/DDP细胞凋亡率比较
对照组和RRS1-shRNA组细胞的细胞凋亡率分别为(8.93±0.32)%、(22.50±6.77)%,两组比较差异有显著性(t=3.47,P<0.05)。细胞凋亡率的变化见图2。

图2 两组细胞的凋亡率比较
2.7 两组细胞中ERK、p-ERK、Bcl-2、BAX蛋白相对表达水平比较
Western blot检测结果显示,对照组和RRS1-shRNA组细胞中ERK蛋白相对表达水平比较差异无显著(P>0.05),P-ERK、Bcl-2、BAX蛋白相对表达水平比较差异均有显著性(t=3.06~4.92,P<0.05)。见表3。

表3 两组细胞中ERK、P-ERK、Bcl-2、BAX蛋白相对表达水平比较
3 讨 论
2020年,中国女性新发癌症209万例,其中新发乳腺癌约42万例,发病率位居所有癌症中的第一位[1]。目前乳腺癌常规的治疗方法是手术切除局部病灶和化疗消除全身扩散。作为乳腺癌标准治疗的重要组成部分,化疗可以明显改善乳腺癌患者的预后[14]。铂类化疗药物主要用于治疗乳腺癌晚期的患者[2]。然而,铂类药物的固有耐药性及获得耐药性,易引发肿瘤细胞生存活力增加和转移潜能增强,导致患者预后不良[15-16]。因此探究乳腺癌细胞对顺铂产生抗性的机制,寻找调控乳腺癌顺铂耐药的关键性分子靶点,对乳腺癌综合治疗和提高顺铂疗效都有重要意义。
核糖体大小亚基中,与rRNA合成相关的蛋白质有70多种,RRS1是其中之一,其参与25S rRNA的成熟和60S核糖体大亚基的装配过程[6]。越来越多的证据表明,除了参与核糖体的装配过程外,核糖体蛋白还参与细胞周期阻滞、免疫信号转导和癌症发展等[16-19]。此外,在肿瘤的多药耐药中也有重要作用[20-21],如对人类头颈癌细胞UMSCC10b与其顺铂耐药细胞UMSCC10b/Pt-S15的差异表达基因图谱进行分析显示,核糖体蛋白S28(RPS28)和延伸因子1α(EF1α)是与顺铂获得性耐药相关的2个上调基因[22]。本课题组前期从数据库中筛选出了与细胞增殖、迁移和侵袭等生物特性相关的基因RRS1,并首次报道了RRS1基因可能通过RPL11/MDM2通路激活p53,进而促进乳腺癌细胞的增殖[7-8]。此外,RRS1基因在肝癌、结直肠癌和甲状腺癌细胞中均呈现异常高表达[10-11,23],干扰RRS1基因表达后,可明显促进细胞凋亡。凋亡抵抗则是各种癌细胞产生化疗药物抗性的原因之一[24-25],因此我们推测RRS1基因或许与癌细胞的化疗耐药有关。我们课题组前期的实验结果验证了RRS1基因与乳腺癌细胞的阿霉素抗性相关[12],但是目前并没有RRS1基因与乳腺癌细胞顺铂抗性的任何报道,也没有RRS1基因在乳腺癌细胞顺铂抗性产生过程中作用机制的相关研究。
本研究首次比较人乳腺癌MCF-7细胞和人耐顺铂乳腺癌MCF-7/DDP细胞的RRS1 mRNA和蛋白表达水平,结果显示与MCF-7细胞相比,MCF-7/DDP细胞中RRS1 mRNA和蛋白的相对表达水平均明显增加,说明RRS1基因在MCF-7/DDP细胞中的高表达与乳腺癌细胞顺铂抗性的产生有关。为进一步探究RRS1基因参与细胞顺铂耐药的分子机制,本研究通过构建慢病毒RRS1-shRNA沉默MCF-7/DDP细胞中RRS1基因的表达,检测顺铂在敲降RRS1基因前后的两组细胞中IC50值的变化,其结果显示,在沉默RRS1基因后,可使顺铂在MCF-7/DDP细胞的IC50值明显降低,提示RRS1基因表达水平的升高与顺铂抗性产生相关。流式细胞仪检测结果显示,沉默RRS1基因后,细胞凋亡率明显增加;分布在G1期的细胞数目明显增加,分布在S期的细胞数目明显减少,而分布在G2期的细胞数目无明显变化,提示敲降RRS1基因后,将细胞主要阻滞在G1期。Western blot检测结果显示,沉默RRS1基因后,P-ERK和凋亡抑制蛋白Bcl-2蛋白的相对表达水平明显下降,促凋亡蛋白BAX的相对表达水平明显升高。表明RRS1基因很可能通过激活ERK相关信号通路促进癌细胞增殖,引起细胞的凋亡抵抗进而参与乳腺癌细胞的顺铂抗性。然而,此研究只是在细胞水平上验证了RRS1基因与乳腺癌细胞MCF-7/DDP顺铂抗性的相关作用,RRS1基因在其他类型乳腺癌细胞药物抗性的作用和体内验证试验仍值得我们进一步探索。
综上所述,本研究首次证实了RRS1基因与乳腺癌细胞的顺铂抗性有关,且其可能是通过激活ERK-BAX-Bcl-2信号通路来发挥作用,对临床上提高顺铂疗效具有重要意义。

