阿替普酶序贯丁苯酞治疗急性脑梗死的疗效及对血管内皮生长因子的影响
王伟 宫秀群 余亮
急性脑梗死具有高发病率、高致残率、高死亡率的特点,严重危害人类健康[1]。积极治疗缺血半暗带,恢复闭塞的脑动脉血液供应是急性脑梗死治疗的核心。阿替普酶(Alteplase,rt-PA)是目前唯一被批准用于脑梗死早期溶栓治疗的药物[2]。然而rt-PA溶栓治疗后仍有相当部分患者会遗留中-重度残疾,同时溶栓后的再灌注损伤亦不容忽视。再灌注损伤由血脑屏障破坏引起,往往会减弱或抵消溶栓治疗带来的益处,甚至会导致患者原有症状加重,如出现脑水肿、脑出血等。
血管内皮生长因子(Vascular endothelial growth factor,VEGF)是一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性、血管内皮细胞迁移、增殖和血管形成等作用。脑缺血时VEGF的表达迅速上调,增加血管通透性,促进血脑屏障的渗漏[3]。脑梗死后血清VEGF含量与脑梗死体积[4]、神经功能损伤程度、预后[5,6]及梗死后认知功能损伤呈正相关[7]。抑制VEGF可减轻梗死引起的血脑屏障破坏和神经功能的缺损[4,8],提示VEGF可作为急性脑梗死治疗的靶点。多个临床试验证实丁苯酞具有改善急性脑梗死患者神经损伤和减少梗死面积的作用[9,10],基础研究证实丁苯酞对急性脑梗死的神经保护机制包含多个方面,如抗炎、抗氧化、抗凋亡、线粒体保护等[11]。本研究旨在观察阿替普酶序贯丁苯酞治疗对急性脑梗死患者的疗效及对血清VEGF的影响。
1 材料与方法
1.1 研究对象 选取2018年10月~2019年9月淮南市第一人民医院神经内科住院行溶栓治疗的急性脑梗死患者57例,其中采用阿替普酶溶栓治疗的31例作为溶栓组,阿替普酶溶栓序贯丁苯酞治疗的26例作为序贯组。
1.2 患者筛选标准 纳入标准:①年龄18~80岁;②临床诊断为急性脑梗死;③首次发病;④NIHSS评分≤25分;⑤发病4.5h内给予阿替普酶静脉溶栓治疗,阿替普酶的剂量为标准剂量(0.9mg/kg,上限90mg)。排除标准:①发病3个月内有头部外伤史、心肌梗死病史;②近3个月内有头颅外伤史,近3周有胃肠道或泌尿道出血史,近2周进行过大型外科手术;③近1周有不易压迫部位的动脉穿刺;④有严重的心、肝、肾功能不全;⑤收缩压>180mmHg或舒张压>110mmHg(药物干预后仍未达标);⑥已知为出血体质或口服抗凝药,48h内接受过肝素治疗,且凝血酶原时间高于实验室正常上限;⑦血小板计数<100×109/L,血糖<2.7mmol/L;⑧急性脑梗死伴癫痫发作者;⑨对丁苯酞成分过敏者;⑩研究者认为不适合的情况。所有患者在溶栓前均行头颅CT排除颅内出血性疾病。本研究方案通过淮南市第一人民医院伦理委员会批准,研究对象或监护人知情同意并签署知情同意书。
1.3 治疗方法 所有患者均接受阿替普酶(生产厂家:上海勃林格殷格翰药业有限公司;商品名:爱通立;规格:50mg/支、20mg/支)治疗。将阿替普酶冻干粉溶于专用溶剂中配成1mg/ml溶液,根据0.9mg/kg、最大不超过90mg计算出总药量,总量的10%在1min内由外周静脉注射,剩余90%在1h内缓慢静滴。溶栓后24h进行CT或MRI检查,颅内出血后启动抗血小板、活血化瘀等治疗。序贯组加用丁苯酞氯化钠注射液(生产厂家:石药集团恩必普药业,规格:100ml/瓶)100ml bid静脉滴注治疗,其他治疗两组相同。
1.4 临床资料 收集患者性别、年龄、个人史(吸烟、饮酒)、既往史(高血压、糖尿病、心房颤动)、实验室检查空腹血糖、甘油三酯、总胆固醇、同型半胱氨酸(Hcy)、低密度脂蛋白(LDL)、VEGF等。
1.5 临床评价 使用美国国立卫生院神经功能缺损评分量表(National institute of health stroke scale,NIHSS)评价患者急性脑梗死严重程度。使用改良Rankin量表(Modified rankin scale,mRS)评价临床转归,0~2分为预后良好,>2分为预后不良。
1.6 标本采集 急性脑梗死患者分别于入院时和溶栓结束后3天、7天采集静脉血3ml,以含EDTA的抗凝管收集,采用3 000r/min离心15min,留取上清液置于-80℃冰箱冷冻待测。
1.7 检测方法 ELISA法检测血清VEGF含量,试剂盒购自博士德生物工程有限公司(EK0539),检测步骤严格按照说明书操作。
1.8 统计学方法 使用SPSS 19.0软件对临床数据进行统计学分析处理。正态分布的计量资料以±s表示,两组间均数比较采用独立样本t检验,非正态分布的计量资料采用中位数和四分位数间距表示,两组间采用曼-惠特尼U检验(Mann-Whitney U test)。计数资料用频数和百分率表示,组间比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较 两组患者年龄、性别、高血压病史、糖尿病史、心房颤动、吸烟史、饮酒史、甘油三酯、总胆固醇、LDL、空腹血糖、Hcy比较,差异均无统计学意义(P>0.05)。见表1。

表1 两组临床资料比较
2.2 两组NIHSS评分比较 溶栓组和序贯组治疗前、溶栓后3天的NIHSS评分比较,差异无统计学意义(P>0.05);溶栓后7天序贯组NIHSS评分显著低于溶栓组,差异有统计学意义(P<0.05)。见表2。
2.3 两组治疗前后血清VEGF水平比较 治疗前两组VEGF水平比较,差异无统计学意义(P>0.05);溶栓后3天和7天,序贯组血清VEGF水平均低于溶栓组,差异有统计学意义(P<0.05)。见表3。
2.4 两组治疗90天后mRS评分比较 治疗90天后溶栓组mRS评分0~2分12例,2~6分14例;序贯组mRS评分0~2分23例,2~6分8例,两组比较差异有统计学意义(χ2=4.691,P=0.030)。

表2 两组NIHSS评分比较[M(IQR)]
表3 两组不同时间点血清VEGF水平比较(pg/ml,±s)
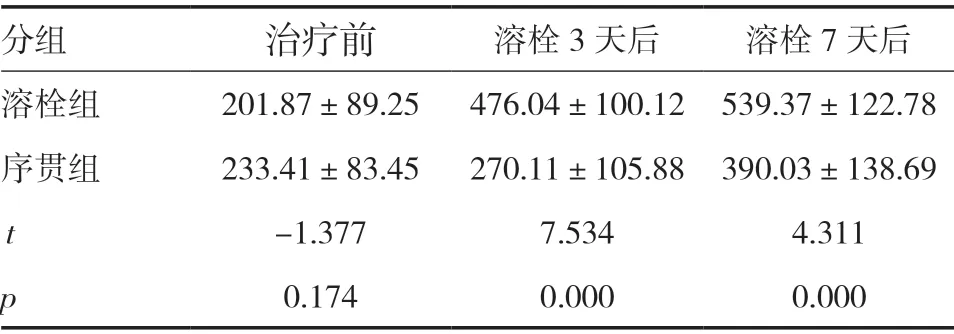
表3 两组不同时间点血清VEGF水平比较(pg/ml,±s)
分组 治疗前 溶栓3天后 溶栓7天后溶栓组 201.87±89.25 476.04±100.12 539.37±122.78序贯组 233.41±83.45 270.11±105.88 390.03±138.69 t-1.377 7.534 4.311 p 0.174 0.000 0.000
3 讨论
卒中严重威胁着人们的健康和生活质量[1]。急性脑梗死是最常见的卒中类型,约占全部卒中病例的70%[2]。已知多种因素会增加中风的发生率,如高血压病、糖尿病、血脂异常、吸烟、凝血功能异常等。积极治疗缺血半暗带,恢复闭塞的脑动脉血液供应,防止脑组织不可逆的缺血损伤以及继发损伤是急性脑梗死治疗的核心。脑梗死早期溶栓治疗是最有效的治疗手段,阿替普酶是唯一一种被美国食品和药品监督管理局(FDA)批准的用于治疗急性脑梗死的药物。1995年发表的NINDS rt-PA研究是阿替普酶临床应用的基础,该研究证实符合入组条件的急性脑梗死患者3h内应用阿替普酶会改善长期预后。欧洲急性卒中协作研究(European cooperative acute stroke study,ECASS)-3在2008年将急性脑梗死阿替普酶静脉溶栓时间拓展至发病4.5h内。然而尽管给予rtPA治疗,仍有一部分患者疗效不佳,甚至出现梗死体积增加、脑水肿、症状性颅内出血、脑疝等,这与脑梗死急性期血脑屏障的破坏有关。血脑屏障破坏不仅导致脑水肿,还使得正常生理情况下被分隔的吞噬细胞、红细胞和代谢产物等透过血脑屏障,诱导炎症反应和神经元细胞死亡,共同促成了急性脑梗死的高死亡率。VEGF是维持血脑屏障的重要分子。脑组织缺血后VEGF的表达迅速上调,且持续数周,血清VEGF含量与脑梗死体积、神经功能损伤程度呈正相关[4~7]。
本研究显示丁苯酞序贯治疗组患者第3天、第7天血清VEGF含量均较单纯溶栓治疗组降低,并改善了急性脑梗死患者的远期预后,提示丁苯酞治疗保护急性脑梗死患者的血脑屏障。丁苯酞最初从芹菜籽中提取,后由我国科学家于20世纪80年代化学合成,2002年被中国国家药品监督管理局批准上市。研究证实丁苯酞对急性脑梗死的神经保护机制包含多个方面,如抗炎、抗氧化、抗凋亡、线粒体保护等[11]。体外研究表明,丁苯酞可以通过减少内皮细胞内ROS的生成来保护血脑屏障完整性减轻继发性脑损伤。丁苯酞还可降低VEGF表达保护血脑屏障的功能和结构的完整性,这与我们的研究结果一致。因此,脑梗死后血脑屏障的保护可能成为治疗的新方向。在之后的研究中应纳入更多病例,对比VEGF水平的动态变化及上下游通路的作用机制以期对临床治疗提供更多证据。
综上所述,急性脑梗死患者采用阿替普酶溶栓后序贯丁苯酞治疗可降低VEGF,有助于保护血脑屏障功能,减轻急性脑梗死后神经功能损伤,改善患者生活质量,利于疾病的更好恢复。

