胸腺基质淋巴细胞生成素在特应性皮炎的作用机制及临床应用
王思航,左亚刚
特应性皮炎(atopic dermatitis,AD)是一种慢性复发性炎症性皮肤病,以湿疹样皮损、剧烈瘙痒、慢性或复发性病程为特征,常并发食物过敏、过敏性鼻炎、哮喘和心理疾病。AD病理生理机制非常复杂,包括遗传易感性、皮肤屏障损伤、表皮微生态改变和免疫炎症等。这些因素相互作用,共同促进AD的发生发展。编码丝聚蛋白(filaggrin)基因缺陷可导致皮肤屏障功能损伤,进而促使炎症发生和T细胞浸润。局部T细胞介导的免疫反应可以进一步损害皮肤屏障并引起瘙痒,促使表皮微生态失衡和金黄色葡萄球菌定植。该菌定植和感染又可损害皮肤屏障,加重炎症反应。在AD的皮损区域有着广泛的基因表达失调,主要与角质形成细胞活性和T细胞浸润有关,尤其是2型免疫反应(包括T helper 2,Th2以及T helper 22,Th22)的相关基因,白细胞介素(interleukin,IL)- 22可通过下调表皮丝聚蛋白和兜甲蛋白(loricrin)的水平,上调S100A7、S100A8和S100A9表达,从而干扰角质形成细胞的正常分化,促进表皮增生,降低皮肤屏障功能。除Th2和Th22反应外,Th1免疫反应及其相关分子如肿瘤坏死因子α(TNF-α)、IL- 1、IL- 6和IL- 8,也参与了慢性AD的发生和发展。Th2免疫反应是AD免疫病理机制中的主导者。Th2免疫反应及其相关的细胞因子IL- 4和IL- 13可以促进B细胞抗体类别向IgE转化,并促进B细胞抗原特异性IgE产生以及嗜酸性粒细胞激活,且与AD慢性瘙痒症状密切相关。胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)在多种免疫相关性皮肤病,如寻常型银屑病、大疱性类天疱疮、硬皮病等有着不同的病理生理作用,是联系天然免疫和获得性免疫的桥梁。研究表明TSLP与AD瘙痒、严重程度、持续时间及表皮屏障功能密切相关。本文综述TSLP在AD的作用机制及靶向抑制TSLP及其相关分子治疗AD最新的临床应用。
1 TSLP的基本特征和功能
TSLP是四螺旋束细胞因子家族中的一员,也是细胞因子IL- 7的远亲。TSLP最初是在小鼠胸腺基质细胞系的上清液中被发现,能够支持未成熟B细胞和胸腺细胞的增殖和发育,这也是其全名的由来。人类TSLP基因位于染色体5q22.1上,紧邻其他特应性细胞因子基因簇。人类TSLP分两种亚型,即长形TSLP(long-form TSLP,lfTSLP)和短型TSLP(short-form TSLP,sfTSLP)。lfTSLP由159个氨基酸组成,sfTSLP缺少lfTSLP氨基端的一部分肽链但保留了羧基端69个氨基酸。尽管sfTSLP mRNA在皮肤组织中组成性表达,但在蛋白质水平的表达和生理功能目前尚未完全阐明。实验证明sfTSLP和lfTSLP有着不同的调控机制和生理作用,sfTSLP可能存在抗微生物和抗炎作用,但其在炎症反应中下调。lfTSLP则在炎症反应中上调,作为警报素之一主要与Th2型免疫反应相关,是联系天然免疫和获得性免疫的桥梁。本文提到的TSLP均指lfTSLP。鉴于TSLP的两个亚型有着不同的表达方式和生理功能,分别研究sfTSLP和lfTSLP十分必要。小鼠TSLP无分型,由140个氨基酸组成,其基因位于18号染色体。虽然鼠源性TSLP和人型TSLP同源性并不高,但其与人类的lfTSLP具有相似的生物学特性和功能。单独的TSLP受体(TSLP receptor,TSLPR)与TSLP的亲和力很低,但其与IL- 7受体α形成异二聚体复合物后可与TSLP高亲和力结合,进而启动下游信号转导通路,促进细胞增殖分化和细胞因子的产生。在炎症反应中,微生物、变应原及理化损伤等刺激表皮产生TSLP、IL- 33、IL- 25等警报素,进而启动下游Th2免疫反应。TSLP主要由肠上皮细胞、肺上皮细胞、角质形成细胞、肥大细胞、成纤维细胞等产生。功能性TSLPR则在树突状细胞(dendritic cells,DCs)、固有淋巴样细胞(innate lymphoid cell,ILC)、肥大细胞、巨噬细胞、嗜酸性粒细胞、B细胞、T细胞及感觉神经纤维末梢等上调表达。过去研究一致认为表皮来源的TSLP主要通过与DCs相互作用,通过上调CD80、CD86及OX40L进而引起T细胞向Th2方向极化,并分泌IL- 4,IL- 5和IL- 13。TSLP在AD、食物过敏和哮喘等过敏性疾病中的作用得到了广泛关注。
2 TSLP在AD免疫病理中的作用
2.1 触发TSLP释放的因素
TSLP的过度表达是AD重要的免疫学特征。遗传因素、表皮屏障功能缺陷、Th2/Th22相关细胞因子环境、“瘙痒-搔抓循环”、Notch信号通路、表皮微生态及Toll样识别受体(Toll-like receptor,TLR)和蛋白酶激活受体(protease activated receptor,PAR)的激活等均参与了AD的发生发展(图1)。
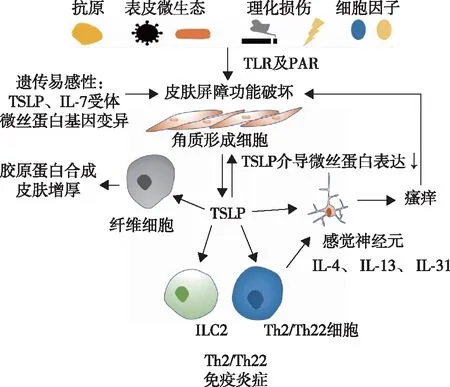
图 1 TSLP在特应性皮炎中的作用机制
2.1.1 TSLP及相关分子基因多态性与AD发生发展密切相关:目前已经确定几个与AD相关的TSLP基因变异,如rs2289278、rs1898671和rs1837253会增加患特应性疾病的风险。最近一项大规模的纵向队列研究发现,IL- 7R唯一变异体rs11567725可调节多种TSLP变异体的功能,进而影响慢性AD的病程,Berna等提出TSLP可作为AD慢性遗传风险模型评估指标。
2.1.2 表皮屏障功能缺陷和蛋白酶激活引起TSLP释放:多种内源性或外源性因素都可能参与表皮角质形成细胞TSLP的产生和释放。编码丝聚蛋白基因突变引起皮肤屏障破坏是AD的主要易感因素之一。丝聚蛋白参与表皮角蛋白形成致密的屏障结构。丝聚蛋白基因缺陷通过增强蛋白酶活性并激活角质形成细胞中的PAR- 2触发TSLP的产生。另一项研究使用相同小鼠模型进一步阐明了角质层 pH维持缺陷早于蛋白酶的激活。表皮pH可能是调节蛋白酶活性的关键因素,皮肤碱化通过PAR- 2依赖和潜在的PAR- 2非依赖途径参与激肽释放酶5介导的TSLP的产生和皮肤屏障的损伤。Nax是一种非典型电压门控钠通道,可感受细胞外钠离子浓度并调控炎症反应。一项最新的研究发现,在兔耳皮炎模型中,使用RNAi技术敲除Nax显著减少了表皮PAR- 2和TSLP的表达,同时减少了Th2相关细胞因子如IL- 4的产生,说明Nax启动并维持了由皮肤屏障破坏导致的皮肤过度炎症反应,进而加速皮炎的发生,并可能与AD中PAR- 2-TSLP信号通路的激活相关。
2.1.3 机械损伤诱导TSLP的产生:瘙痒是AD的标志性症状之一,会导致患者反复搔抓。既往一项研究用胶带剥离实验模拟由慢性搔抓造成的机械损伤,发现机械损伤可显著增加皮肤中TSLP的水平,从野生型小鼠皮肤中分离出的DCs能显著提高辅助性T细胞向Th2免疫极化的过程,产生更多的IL- 4和IL- 13,而TSLP受体缺陷小鼠则不能。
2.1.4 Notch信号通路参与表皮TSLP的产生:Notch信号通路抑制皮肤角质形成细胞中TSLP的产生,AD患者皮肤中Notch受体的表达显著降低。在小鼠模型中,通过抑制Notch信号通路可诱发严重的AD,以黑棘皮病、海绵水肿、角化过度以及真皮中嗜酸性粒细胞和肥大细胞浸润为特征。角质形成细胞中Notch信号通路的缺失也可导致AD的临床症状和血清TSLP浓度显著增加。此外,在Notch信号通路缺陷的小鼠模型中,无菌突变小鼠表达更高水平的TSLP,这表明表皮微生物群落(表皮微生态)可能在角质形成细胞相关的应激信号(如TSLP)的调节中发挥潜在作用。然而,角质形成细胞中Notch信号通路激活的机制尚未完全阐明。
2.1.5 TLR及组胺受体激活诱导TSLP产生:通过TLR途径产生TSLP在启动Th2免疫中也是必不可少的,Poly(I-C)、双酰化脂肽FSL- 1和鞭毛蛋白以及促炎细胞因子(IL- 1、IL- 4、IL- 13和TNF-α)等可以通过TLR途径诱导上皮TSLP的产生。定植在AD皮损处的金黄色葡萄球菌可触发角质形成细胞释放TSLP。人角质形成细胞暴露于双链RNA(TLR- 3配体)、鞭毛蛋白(TLR- 5配体)和双酰化脂肽(TLR- 2-TLR- 6配体),可诱导TSLP的表达。然而在半抗原2,4-二硝基氯苯(DNCB)诱导的AD小鼠模型中,TLR- 4缺陷小鼠展现出更强的Th2免疫反应,并表达更高水平的TSLP,这可能与TLR的配体种类及细胞因子微环境相关。最新研究表明,组织胺可通过组胺受体4上调角质形成细胞TSLP的表达,并增强poly(I-C)诱导的TSLP产生,因此阻断组胺受体4可能通过减少TSLP产生,而减轻Th2免疫炎症及瘙痒症状,但仍需进一步临床研究证实。
2.1.6 角质形成细胞中调节TSLP释放的因素:特应性细胞因子的环境也促进了TLR介导的TSLP产生。在其他特应性模型(如正常人支气管上皮细胞)中,Th2细胞因子IL- 4和IL- 13协同诱导上皮细胞TSLP的释放,提示产生这种细胞因子的细胞募集以及Th2免疫微环境可能通过正反馈放大Th2反应。也有报道称在AD患者中存在潜在的TSLP自分泌环路。DeltaNp63是一种p53相关分子,可调节角质形成细胞中TSLPR表达。此外,另一种p53相关分子DeltaNp73也在AD表皮中显著表达,并促进TLR- 3介导的TSLP释放。
2.2 TSLP参与AD免疫炎症和皮肤屏障功能损害
2.2.1 TSLP促进Th0向Th2/22极化作用:表皮来源的TSLP主要通过与DCs相互作用,上调CD80、CD86及OX40L进而引起T细胞向Th2方向极化,并分泌IL- 4,IL- 5和IL- 13。此外TSLP还可激活ILCs、肥大细胞、巨噬细胞、原始T细胞等引起Th2免疫反应。此外,TSLP还可引起T细胞向Th22方向极化产生IL- 22,这些细胞因子均参与AD皮肤屏障功能的损害(图1)。
2.2.2 TSLP与AD的严重程度、表皮屏障功能和持续时间相关:早在2002年,Soumelis等首次报道了TSLP在变态反应性疾病中的作用。通过免疫组织化学分析,鉴别出TSLP在急、慢性AD患者皮损中高表达,而在非皮损中不表达。TSLP在AD患者角质层中的表达较正常人更为显著,与皮肤干燥评分呈正相关,与角质层水合程度呈负相关,这表明其过度表达与AD严重程度和表皮屏障功能紧密联系。最近一项队列研究发现 TSLPrs1898671纯合子患儿AD病情持续时间较短,而有两个丝聚蛋白功能缺失突变的患者皮损清除的可能性较小,使用糖皮质激素的风险较高,表明丝聚蛋白和TSLP的多态性可能与AD的维持和持续时间密切相关。TSLP激活的DCs引起下游Th2和Th22型细胞因子的释放均可降低表皮微丝蛋白的表达,共同参与皮肤屏障功能的损害。
2.2.3 TSLP诱发AD瘙痒症状及“瘙痒-搔抓循环”:瘙痒严重影响了AD患者的生活质量。TSLP可能通过诱导Th2免疫和相关的Th2细胞因子(如IL- 4、IL- 13和IL- 31)激活感觉神经元而间接引起瘙痒。TSLP还会直接作用于表达TSLP受体复合物的脊髓背根节神经元,通过瞬时受体电位阳离子通道A1的激活引起瘙痒症状。最近一项研究表明,TSLP可诱导角质形成细胞中的骨膜蛋白分泌,从而通过在感觉神经元亚群上表达的骨膜蛋白受体引起瘙痒。这些研究说明TSLP参与了AD患者的“瘙痒-搔抓”循环,进一步破坏皮肤屏障,引起慢性损害。皮肤免疫炎症和皮肤屏障功能破坏息息相关,并相互作用,通过正反馈机制共同促进AD的发生发展及慢性化。打破这一恶性循环对于慢性AD患者尤为重要。
3 靶向TSLP及其相关分子药物可以缓解AD临床症状
AD的传统治疗药物包括保湿剂、局部糖皮质激素和钙调神经磷酸酶抑制剂,对于中重度AD患者,也可应用光疗和免疫抑制剂。一种局部磷酸二酯酶4抑制剂克立硼罗乳膏已经被美国食品和药物管理局批准用于AD治疗,并已在中国上市。度普利尤单抗(一种针对IL- 4受体α亚单位,同时阻断IL- 4和IL- 13通路的单克隆抗体)已进入中国市场,并进入医保目录。OX40是TNF受体超家族的成员,TSLP激活DCs表达其配体(OX40 ligand,OX40L),与CD4T细胞上的OX40相互作用,使其向Th2型细胞极化,并进一步增强Th2型炎症细胞因子的产生。针对TSLP-OX40L-OX40轴治疗AD的药物也已进入临床试验阶段。GBR830是一种人源化OX40单克隆抗体,可阻断OX40-OX40L相互作用。一项IIa期临床试验测试了GBR830在64例中重度AD患者中的安全性和有效性。在这项试验中,试验组患者接受了两剂GBR830静脉注射,间隔四周,并在注射前、第4周、第10周收集皮肤组织活检标本。患者表现出良好的耐受性,GBR830显著降低了患者湿疹面积严重程度指数(eczema area and severity index,EASI评分),表皮增生明显减少,并降低了病变皮肤中Th1、Th2、Th17/22相关细胞因子和趋化因子mRNA的表达。这项研究首次证明了OX40在AD中的致病作用,并为拮抗AD患者中OX40L-OX40信号通路提供了有力证据。日本一项小型的I期临床试验测试了另一种OX40单克隆抗体KHK4083在22例中重度AD患者中的安全性和有效性。这些患者接受了静脉注射3剂KHK4083,每次间隔两周,11例患者出现轻中度发热,8例患者出现轻度感冒症状,未见严重不良反应发生,患者有良好的耐受性。EASI评分持续减少,Th2相关趋化因子也持续降低直到第22周。Tezepelumab是一种人源化TSLP的单克隆抗体,可阻断TSLP与其受体复合物的结合。近期一项随机、双盲、安慰剂对照Ⅱa期临床研究评估了Tezepelumab在113例轻中度成人AD患者的有效性和安全性。在该试验中,试验组接受Tezepelumab 280 mg皮下注射,每两周1次,并联合局部外用中效糖皮质激素。在第12周时,试验组64.7%的患者达到ESAI- 50,而安慰剂组仅为48.2%,但差异无统计学意义(=0.091),局部外用糖皮质激素可能是该试验的混杂因素之一。单药Tezepelumab治疗AD的IIb期临床试验(NCT03809663)已终结,但其结果尚未发表。
综上,TSLP作为警报素之一在AD免疫病理中发挥重要作用,是促使固有和获得性Th2免疫反应的天然免疫分子,并且与AD瘙痒和表皮屏障功能障碍及AD严重程度、持续时间密切相关。虽然TSLP表达由环境和感染因素诱导,并在AD发生中发挥着多方面作用,但尚需要更多研究阐明这些诱发因素的相互作用,包括TSLP及其相关分子的基因多态性、Notch信号通路的改变、免疫微环境、皮肤屏障功能损伤以及物理化学损伤和表皮微生态的改变等。TSLP可能通过引起“瘙痒-搔抓循环”和皮肤屏障功能降低而更早地参与AD的发展。此外,TSLP还推动了特应性进程(从AD到食物过敏及哮喘)的发生和进展。抑制TSLP及其相关细胞因子的药物对AD患者的瘙痒及皮损改善均具有一定的的疗效。综上所述,靶向AD患者Th2免疫反应除IL- 4和IL- 13以外的重要细胞因子,如TSLP-OX40轴,剖析TSLP-OX40通路的每个组成部分的致病作用及其治疗潜力,可为今后治疗中重度AD患者提供更多较为安全的治疗选择。