流行性出血病的全球流行及分布
罗倩敏,韦丽,韩佃刚,叶玲玲,杨云庆,董俊,张冲,李静,尹尚莲,李瑶瑶,何昌霖,董仙兰,李丹丹,唐晓萍,艾军
(1.昆明海关技术中心,云南昆明 650200;2.昆明海关技术中心大理分中心,云南大理 671000;3.海口海关技术中心,海南海口 570311;4.昆明市技术合同认定登记站,云南昆明 650021)
流行性出血病(epizootic haemorrhagic disease,EHD)是由流行性出血病病毒(epizootic haemorrhagic disease virus,EHDV)引起的,经库蠓叮咬传播的非接触性反刍动物传染病[1]。EHD主要影响野生和家养反刍动物。白尾鹿(Odocoileus virginianus)感染EHDV 后可发生严重的出血性疾病,临床表现为发热、乏力、食欲不振、流涎过多、面部水肿以及结膜和口腔黏膜充血、冠状炎和口炎,发病率和死亡率很高,是影响白尾鹿健康的重要疾病之一;骡鹿、黑尾鹿和叉角羚羊等感染EHDV后发生的症状较轻,死亡率低;牛、绵羊感染后,产奶量减少,发生流产或产畸形胎,从而引起巨大生产损失[2]。世界动物卫生组织(WOAH)将EHD 列入了须通报动物疫病名录[1]。本文对EHD的病原学特征及流行特征进行综述,以期为EHD防控提供借鉴。
1 病原学特征及传播媒介
1.1 病原学特征
EHDV 属于呼肠孤病毒科环状病毒属,在遗传学和形态学上都与蓝舌病病毒(BTV)相似。EHDV 基因组包含10 段线性双链(ds)RNA(Seg-1—Seg-10),编码7 种结构蛋白(VP1—VP7)和4 种非结构蛋白(NS1、NS2 和NS3/NS3a)。结构蛋白VP1、VP3、VP4、VP6 和VP7 形成病毒核心颗粒,而VP2 和VP5 形成病毒粒子外壳层。VP2 和VP7 分别是决定血清型和血清群的两种主要蛋白质[3]。Seg-3将EHDV 毒株分为两种地域型(topotype),中国、日本和澳大利亚毒株属东方型(eastern),美洲和非洲毒株属西方型(western)[4]。不同地域型同一种毒株在致病性方面也存在差异。例如,在日本出现的EHDV-2 毒株对牛有致病性,而在北美洲流行的同源毒株则没有[5]。
EHDV 在高温下极不稳定,50 ℃ 3 h,60 ℃15 min 即可失活;在pH6.0~8.0 下敏感,pH6.8~9.5稳定,pH4.0 以下以及pH10 以上迅速失活;对乙醚和氯仿等脂质溶剂具有抗性,容易被β-丙内酯、2%戊二醛、酸、2%氢氧化钠、2%~3%次氯酸钠、碘伏和酚类化合物灭活;试验[5]发现:在不同温度条件下,EHDV在血液和组织样本中有不同反应,-70、4 和20 ℃条件下EHDV 表现稳定,可长期保存活力,-20 ℃时表现不稳定;对紫外线和γ 辐射线具有抵抗力。
EHDV 最初在淋巴管内皮细胞和引流部位感染的淋巴结中复制。然后,通过血流传播到其他部位复制,如淋巴结和脾脏。体外研究[5]表明,EHDV 复制可能依赖于单核细胞。目前,全球各地分离到的EHDV 血清型至少有9 种,包括EHDV-1、EHDV-2、EHDV-4—EHDV-10(表1)。
1.2 传播媒介
EHD 是虫媒传染病,多种因素会影响虫媒摄入、维持和传播病原体的能力。雌性库蠓C.sonorensis可能会在吸食感染鹿的血液时摄入EHDV,但并非所有蠓都会传播病毒(表2 列出的为已经确认能够传播EHDV 的库蠓属)。虫媒携带并传播EHDV 的可能性受许多遗传和环境因素影响,如摄入的病原体数量、昆虫的免疫反应和媒介-病原体基因型相互作用等[12]。
2 全球流行及分布
2.1 美洲
据报告,在已知的血清型中,美洲仅存在EHDV-1、2 和6 型。C.sonorensis是北美洲唯一被确认的EHDV 传播媒介。EHDV 于1955 年首次在美国新泽西州的白尾鹿中被分离到,同年在美国密歇根州,1956 年在美国南达科他州,1962 年在加拿大艾伯塔省,1967 年在美国华盛顿州,1971 年在美国西南部的白尾鹿中均分离到该病毒[13]。

表1 全球EHDV 血清型分离情况[6-11]
2006 年在美国印第安纳州和伊利诺伊州发现的EHDV-6,是澳大利亚EHDV-6(CSIRO 753)和北美EHDV-2(艾伯塔省)组合的一种新型重组毒株[14]。2008 年在美国堪萨斯州和德克萨斯州,2009 年在美国密苏里州和密歇根州,2010 年在法属瓜德罗普,均分离到EHDV-6,表明该病毒已经越冬[5,15]。2012 年美国15 个州发生了大规模的多血清型EHDV 感染疫情,导致牛临床发病和死亡;随后,2013 年又暴发了小范围疫情,病死率高达26%[6]。
2013 年,在进口到特立尼达加勒比岛的无症状牛中发现EHDV-6。该病毒的10 个片段中,有8个来自于美国EHDV-6 印第安纳毒株(该毒株是含有澳大利亚EHDV-6 片段的重组毒株),另外的第4 段来自澳大利亚的EHDV-2 毒株,第8 段与美国新泽西EHDV-1 毒株核苷酸同源性最高(90.4%)。这种重组病毒可能来自美洲,在那里它从一种局部循环的EHDV 毒株中获得了第8 片段。经分析发现,该毒株在与美国当地流行的EHDV-2 毒株重组之前,就已在加勒比海地区传播,并可能从加勒比海或南美洲向北传播至北美洲[16]。
Allen等[17]对加拿大安大略省(2016—2019年)家畜血清进行EHDV 抗体检测,检出15 头牛(9.0%)呈EHDV-2 血清阳性。在法属圭亚那,分离出EHDV-1、EHDV-6;在厄瓜多尔,295 头牛血液样本中检测到EHDV 抗体,阳性率为81.3%,血清型为EHDV-1 和EHDV-6[18]。在墨西哥的白尾鹿中,EHDV 抗体阳性率为72%;在美国德克萨斯州的白尾鹿中,EHDV 抗体阳性率为90%[19]。在美国佛罗里达州,使用RT-qPCR 方法对2016—2020 年死亡的养殖白尾鹿进行EHDV 血清型鉴定,发现EHDV-1 占19%,EHDV-2 占55%,EHDV-6占27%(表3)。
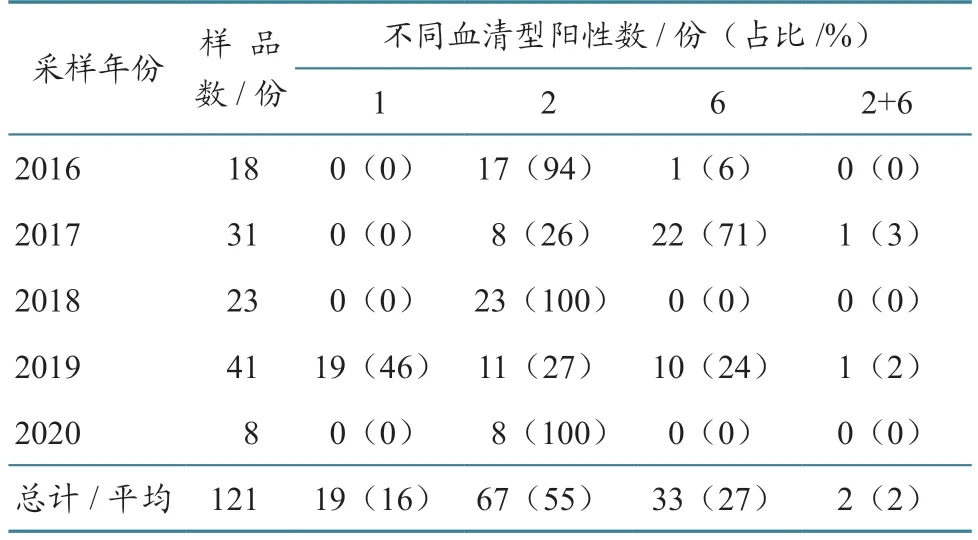
表3 2016—2020 年对佛罗里达州鹿场死亡白尾鹿EHDV 的血清型鉴定[20]
据WOAH-WAHIS 数据库统计,2010 年以来美洲有4 个国家或地区报告发生EHD,分别是法属瓜德罗普、法属圭亚那、加拿大、巴西(表4)。
根据WOAH 报告和相关文献报道,美洲EHDV 主要流行于北美洲南部和南美洲北部的加勒比地区,包括美国、加拿大、法属圭亚那、墨西哥等国家或地区。这与它们发达的牛羊养殖业以及湿润的大陆性气候有关。美洲是白尾鹿原产地,其中北美洲国家不仅有野生白尾鹿,还有提供鹿角等传统装饰物的小型农场人工饲养白尾鹿。这是美洲地区EHDV 流行并向外传播的重要因素之一。
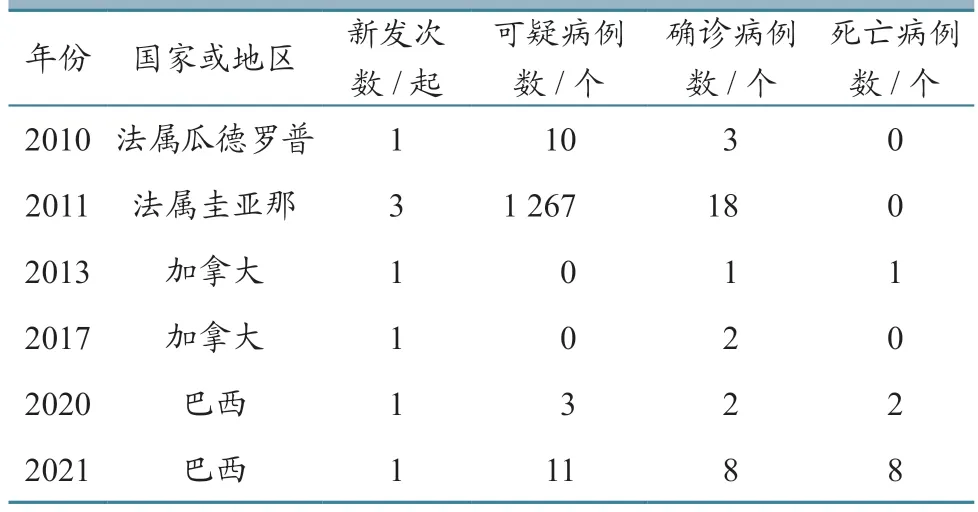
表4 EHDV 在美洲的流行情况统计
2.2 亚洲
1959 年在日本分离的EHDV-2(茨城)是首次证明对牛有致病性的EHDV 毒株[14]。当时该病毒导致4 000 头牛感染死亡,并在受影响地区的39 000 头牛身上造成高发病率[21]。2006 年从以色列牛中分离出来的EHDV-7 被证实起源于非洲[22]。该病毒由西、北向南传播至位于以色列、巴勒斯坦、约旦交界处的死海,并沿约旦裂谷向北传播[5]。2015 年、2016 年在以色列分别发现了EHDV-6 和EHDV-1,其中EHDV-1 与尼日利亚毒株亲缘关系密切[23]。EHDV-2(茨城)、EHDV-6和EHDV-7 分别在日本、土耳其和以色列引起牛病,而相同血清型在澳大利亚则不能引发牛病[5,24]。有报道[15]称,在巴林分离到的EHDV-6(318 株)与“西方型”病毒同源性较高,而与“东方型”病毒同源性较低。
和东华等[25]对我国云南省边境地区牛进行EHDV 血清学调查,发现8 个市(县)的抗体阳性率为72.7%~98.75%,检出6 种血清型,分别为EHDV-1、2、5、6、7、8。寇美玲等[26]对云南省进行EHDV 流行调查,发现11 个县(市)的抗体阳性率为49.3%~91.3%,检出6 种血清型,分别为EHDV-2、5、6、7、8、10。我国分离到的EHDV-1、6、10 与日本毒株亲缘关系较近[4,10,27]。研究人员对土耳其南部的绵羊和牛进行了血清调查,发现EHDV-1 阳性率分别为0.4%和0.9%,EHDV-2阳性率分别为6.5%和4.5%[19]。
据WOAH-WAHIS 数据库统计,2006 年以来,亚洲通报EHDV 感染的国家共有3 个,分别是土耳其(乌沙克、穆拉、马尼萨、伊兹密尔、代尼兹利、布尔杜尔、艾丁、安塔利亚)、以色列(耶路撒冷区、耶路撒冷分区、塔拉巴、以色列专属经济区、北部区、中央区、海法、南部区、戈兰)和日本(熊本、鹿儿岛)。具体数据见表5。
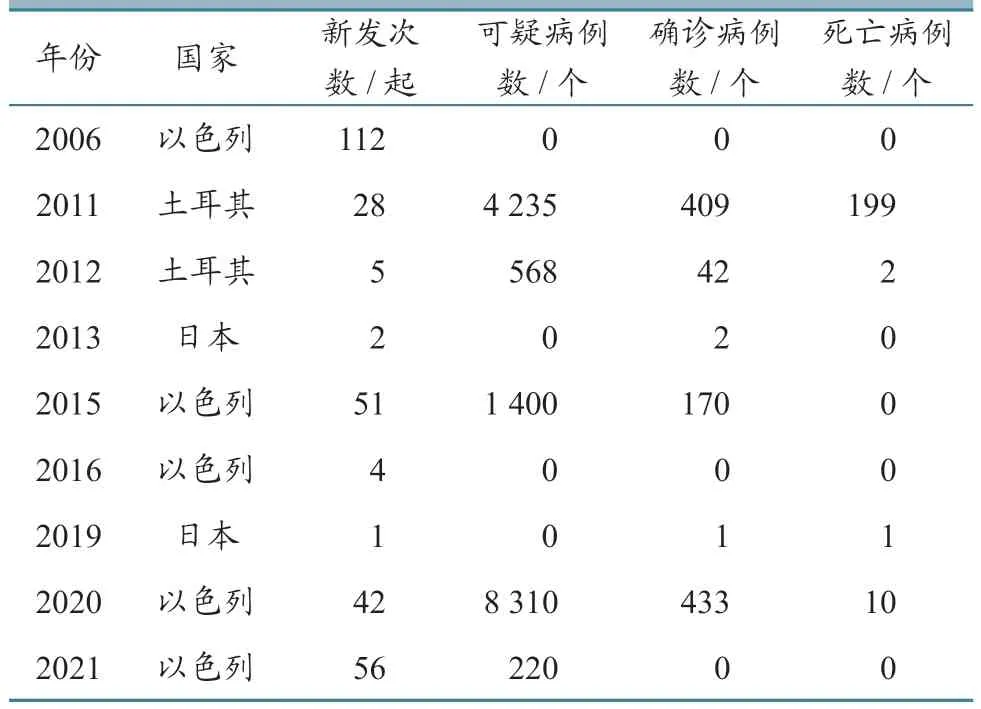
表5 EHDV 在亚洲的流行情况统计
综上,亚洲EHDV 流行主要集中在日本、以色列、土耳其,它们都是亚洲牛羊养殖业发达的国家。疫情也佐证了EHDV 能够大规模侵袭牛羊,造成疫病发生和死亡的事实。我国在云南省边境地区,从牛体内分离到6 个EHDV 血清型,牛抗体阳性率也较高,表明我国边境地区已遭受境外EDHV 侵袭。
2.3 非洲
2004 年,摩洛哥报告了由EHDV-6(318 株)引起的疫情。2006 年,同一血清型导致该国再次暴发疫情,发病率为18.0%,病死率为2.2%;同年EHDV-6 在阿尔及利亚和突尼斯引起疫情[5]。2006 年对在突尼斯传播的EHDV-6 毒株S2、S3、S6、S7和S10核苷酸序列比较发现,这5 个片段与在同一地理区域(非洲、阿拉伯半岛和印度洋)分离的EHDV 毒株具有共同的起源[28]。Sailleau等[15]对留尼汪岛分离到的EHDV-6 毒株基因组第2 段序列进行分析,发现2003 年与2009 年在该岛引起流行的毒株有高度同源性。这些数据表明,相同的毒株已经在岛上传播了7 年。经序列比较发现,留尼汪岛流行的EHDV-6 毒株与2006—2007 年在地中海盆地流行的EHDV-6 毒株密切相关。
肯尼亚小牛中的EHDV 抗体阳性率为64%,留尼汪岛牛羊中的EHDV 抗体阳性率为38%[29]。2016 年在埃及牛群中检出了EHDV 阳性抗体,血清型为EHDV-1[30]。Cosseddu等[31]研究发现,毛里塔尼亚骆驼中的EHDV 阳性率高达73%。Mahmoud等[14]调查了利比亚的EHDV 血清流行情况,检测了2015 年采集的855 份血液样本,发现EHDV 总体血清流行率约为4%,其中小型反刍动物血清阳性率显著高于牛,绵羊的血清流行率高于其他物种,由此可知绵羊可能在EHDV 流行中发挥重要作用。Mejri等[32]在突尼斯不同地区采集了牛和单峰驼血清样本进行EHDV 抗体筛查,发现2012—2013 年采集的牛样品中EHDV 抗体阳性率最高(表6)[32]。
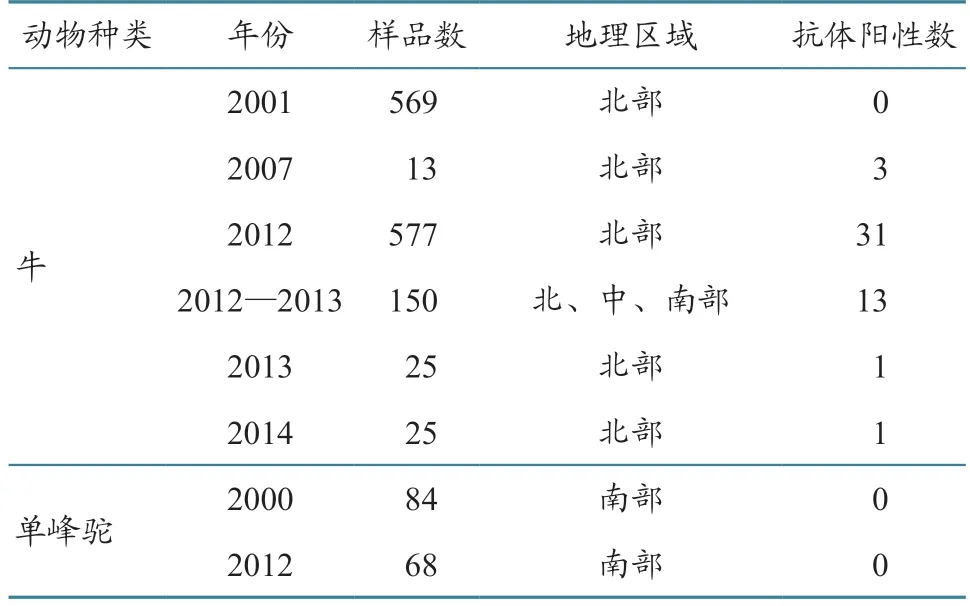
表6 突尼斯2007—2014 年EHDV 流行情况[32] 单位:份
依据WOAH-WAHIS 数据统计,非洲共有5个国家或地区通报发生EHDV 感染,分别是突尼斯(宰格万、托泽尔、希里亚奈、西迪布兹德、斯法克斯、斯贝特拉、尼拜尔、莫娜斯提尔、马努巴、马赫迪那、卡赛林、凯鲁万、坚杜巴、比泽太、本阿鲁斯、巴贾、阿里亚纳)、摩洛哥(东部区、中南区、中北区)、阿尔及利亚(麦迪亚、拉格瓦特、杰勒法)、法属留尼汪、纳米比亚(哈达普)。具体数据见表7。
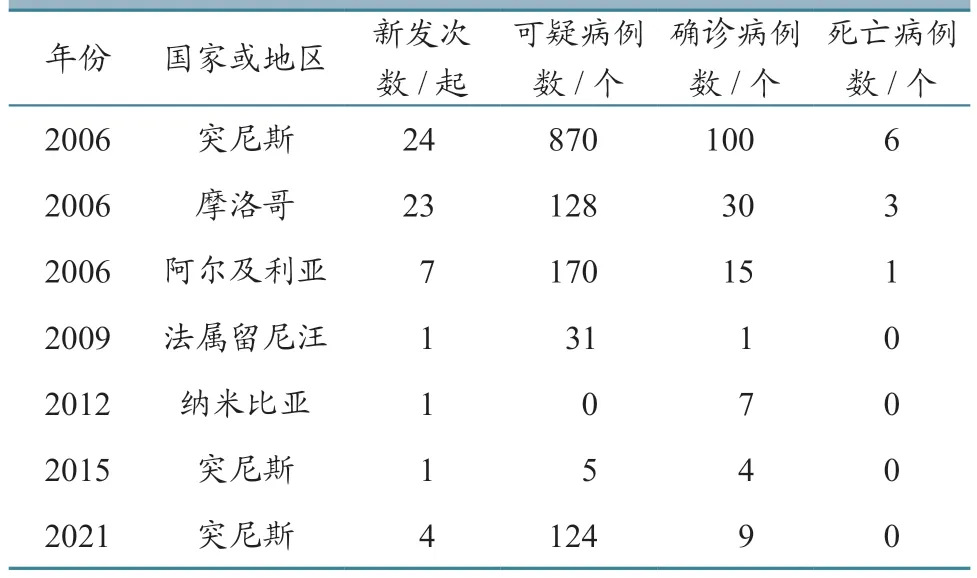
表7 EHDV 在非洲的流行情况统计
综上所述,非洲EHDV 流行集中在北非地区的地中海沿岸国家,主要影响牛、骆驼和小型农场的绵羊。北非地区EHDV 的流行对地中海周边国家和欧洲其他区域形成严重威胁。在印度洋的法属留尼汪,EHDV-6 流行时间很长,它与地中海盆地国家流行毒株具有同源性。
2.4 欧洲和大洋洲
至今,WOAH-WAHIS 数据库中未有欧洲和大洋洲通报发生EHDV 感染的相关数据。但据相关文献记载,澳大利亚目前存在6 种EHDV 血清型,包括EHDV-1、2、5、6、7 和8[16,33]。库蠓C.imicola是较常见的传播EHDV 的媒介物种,其虽然是一种亚非物种,但已在南欧建立了自己的地位,目前广泛分布于葡萄牙,西班牙巴利阿里群岛,法国南部大陆、科西嘉岛,意大利大陆、撒丁岛、西西里岛,希腊大陆,土耳其安纳托利亚以及附近的几个希腊岛屿。C.obsoletus和C.punctatus广泛分布于北欧和中欧的大部分地区。C.schultzei在非洲和中东广泛分布,但在欧洲,只有希腊南部大陆的南阿提卡才有记录[5]。
欧洲虽然没有EHD 病例报告,但在其周边亚非国家却有疫情发生,对欧洲形成传入风险。在地中海盆地以及留尼汪岛流行的EHDV-6 和EHDV-7对牛具有高致病性,表明除EHDV-2 外,其他血清型也可能对家畜致病,并可能产生相当大的经济损失[21]。此外,在地中海盆地,已报告了4 种EHDV 血清型,如土耳其的EHDV-1、EHDV-2 和EHDV-6,阿尔及利亚、摩洛哥和突尼斯的EHDV-6,以色列和约旦的EHDV-7[14]。这些血清型在地中海盆地的出现也显著增加了EHDV 入侵中欧和北欧的风险[20]。
值得注意的是,EHDV 与20 世纪90 年代末流行的BTV 存在惊人的相似性。在此期间,一些最初在阿尔及利亚、突尼斯、土耳其和以色列传播的BTV 血清型能够穿越地中海,通过西部、东部和南部走廊入侵南欧[5]。
2.5 全球分布变化
EHDV 在世界范围内广泛传播,2011 年以前EHDV 影响北美洲和中美洲,南非和中非,以及中东、大洋洲的澳大利亚和东南亚地区[5]。截至目前,EHDV 在原有区域不断向外扩散。据现有数据[5]以及上述情况汇总:北美洲的EHDV 由美国向北扩散到加拿大达艾伯塔省、安大略省;在南美洲,EHDV 已经扩散至厄瓜多尔、法属瓜德罗普、特立尼达和多巴哥、法属圭亚那和巴西,流行的3 种EHDV 血清型至今未变(表8)。在非洲,EHDV已扩散至法属留尼汪、西非毛里塔尼亚以及北非东北部的埃及和利比亚,血清型由原来的3 种增加至4 种。在亚洲,EHDV 已扩散至中国、日本、以色列,血清型由原来的3 种增加至7 种。在大洋洲,EHDV 目前仍局限在澳大利亚,没有扩散现象,血清型也没有增加。全球EHDV 血清型流行变化见表8。
3 全球传播风险因素
3.1 野生宿主种群规模扩大
最初,EHDV 的易感宿主主要是野生鹿,尤其是北美洲的白尾鹿。白尾鹿原产于美洲,曾濒临灭绝,2015 年被列入《世界自然保护联盟濒危物种红色名录》。目前白尾鹿在南美洲数量仍然稀少,但在北美洲如美国、加拿大,由于对白尾鹿的保护,其数量逐渐增多,增加了感染和传播EHDV的风险。
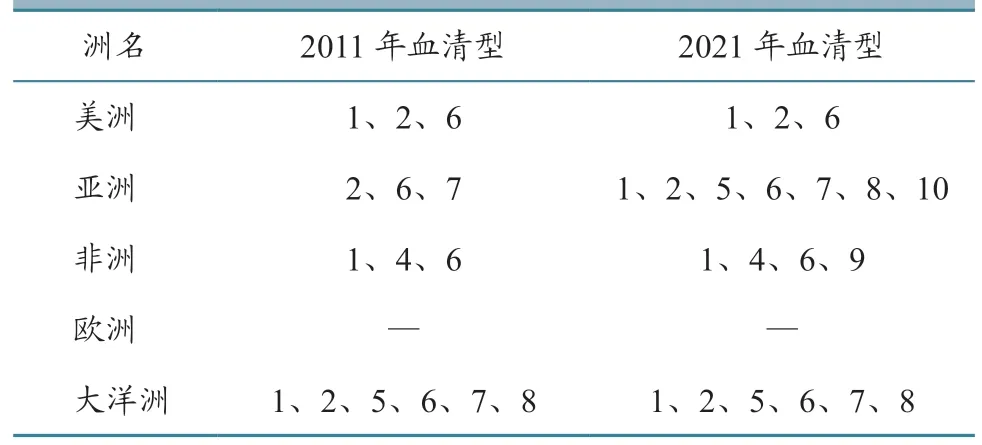
表8 全球EHDV 血清型流行分布变化
3.2 传播方式发生变化
EHDV与BTV在全球的传播区域和传播媒介相似,两者的共同媒介包括C.imicola、C.brevitarsis、C.bolitinos、C.obsoletus、C.gulbenkiani、C.magnus、C.sonorensis和C.stellifer。随着EHDV 在全球的持续流行传播,这两种疫病在一个国家的共同传播正频繁发生[5]。由于虫媒种群扩大,病毒血清型增加,EHDV 对牛羊的致病性也开始提高。牛羊规模化养殖量大、养殖密集,随商业贸易可远距离调运,一旦染疫,EHDV 不仅可在区域内迅速传播,也可跨洲传播,因此养殖牛羊将成为其主要传染源和传播主体。
3.3 病毒基因发生重配
EHDV 属于环状病毒。环状病毒具有巨大的遗传多样性以及相似遗传基因序列,不仅本身可发生变异产生新的病毒,而且其他入侵的基因与病毒本身存在的基因发生重组,促进了新重组子代的出现和传播。
3.4 人为因素促进病毒变异
人类对病毒病的防控行为,如使用减毒活疫苗,过度环境消杀等,可促使病毒变异或出现流行特征变化,以适应新环境生存。这包括:病毒通过媒介蠓传播能力的变化,与地方性病毒重新组合,产生新的遗传变异后代,毒株变异表现新的流行特性,等等。
3.5 气候变化引起传播媒介活跃、范围变广
气候变暖导致EHDV 传播媒介地理范围分布变广,EHDV 在原有区域不断向外扩散,使原来没有节肢动物传播病毒的地区也出现了EHDV,从而导致EHD 全球分布加速。
4 全球控制措施
人类行为导致的动物迁徙和全球贸易流通的加速,使EHDV 迅速形成了全球流行传播趋势。WOAH-WAHIS 数据库收集汇总了2017—2021 年全球对EHD 的15 项控制措施:宰前宰后检 疫(ante and post-mortem inspections)、疫 病报告(disease notification)、常规监测(general surveillance)、监测(monitoring)、移动控制(movement control)、筛检(Screening)、野生动物宿主控制(control of wildlife reservoirs)、病媒控制(control of vectors)、病媒生物监测(vector surveillance)、目的性监测(targeted surveillance)、区域区划(zoning)、边境防控(precautions at the borders)、清群和无害化处理(selective killing and disposal)、扑杀(stamping out)、宰杀(slaughter)。不同国家或地区实施的措施略有不同(图1),其中日本实施的措施最多(8项),多项措施的综合利用使日本长期未发生过大规模疫情;其次澳大利亚为7 项,自1977—1992年分离出6 种血清型以来,至今的30 年内,血清型没有发生任何变化,有效阻断了新血清型EHDV侵入。
5 启示

图1 2017—2021 年EHDV 在全球国家/地区层面的控制措施
近年来,EHDV 在全球流行传播,各种EHDV 血清型及其载体的地理分布范围不断扩大,感染的严重程度和频率逐渐增加,给反刍动物养殖带来了新挑战。目前我国边境地区已发现牛羊EHDV 感染,为有效防范EHDV 传入,建议我国:(1)强化EHDV野生宿主动物活动区域管控监测,防止野生动物与家养动物接触;(2)加强低洼灌木天然草场改造,削弱传播媒介生存环境;(3)加强边境地区的EHD 监测,严厉打击动物走私、逃检行为,降低病毒传入风险;(4)研发EHDV检测技术,提高检测水平,做好EHDV 灭活疫苗研发储备。

