大乌泡抗炎药效部位的筛选及其有效成分含量测定的研究
唐念,王群*,张美丽,王娇娇,李雯君,汤瑾,金阳
(1.贵州中医药大学,贵州 贵阳 550025;2.贵州医科大学,贵州 贵阳 550001)
0 引言
大乌泡为蔷薇科悬钩子属(Rubus multibracteatus Levl.&Vant.),以根及全株入药,味微苦,性凉,入肝、脾二经,主产于贵州、云南、四川等地,为我省苗族常用药,具有祛风除湿、清热解毒、接骨、凉血、止血的功效,常被当地苗族用于感冒、发热、肠炎、痢疾、鼻出血等疾病的治疗[1]。以大乌泡为主药的龋齿宁含片,具有治疗牙周炎,牙龈炎,龋齿痛疗效[2]。大乌泡治疗不同病症时使用的药用部位有所不同,例如用大乌泡治疗痢疾、倒经常用大乌泡的根和茎入药,清热解毒时常用大乌泡叶入药[3,4]。因此,有必要对大乌泡进行药效部位的筛选。文献报道[5],槲皮素和山奈酚可能为大乌泡抗炎镇痛的药效物质。芦丁属于黄酮类化合物,具有抗自由基活性[6-9],抗脂质过氧化作用[10,11]。因此,测定这三种活性成分含量对大乌泡的质量控制具有重要意义。鉴于此,本研究对大乌泡抗炎药效部位进行筛选,并采用HPLC、UV法对大乌泡药效部位中山奈酚、槲皮素及芦丁等成分进行含量测定。
1 材料
1.1 仪器
电热鼓风干燥器(201-2AB,天津市泰斯特仪器有限公司),水浴恒温振荡器(THZ-82,常州市中贝仪器有限公司),数据恒温水浴锅(DRHH-S4,上海市双捷实验设备有限公司),高效液相色谱仪(lc-2040C3D,岛津中国有限公司),紫外可见分光光度计(UV-5900,岛津中国有限公司),电子分析天平(JA2003,上海舜宇恒平科学仪器有限公司),罗氏全自动生化分析仪(cobacc501,Roche)。
1.2 试药
芦丁(100080-202012,中国食品药品检定院,纯度>98%),槲皮素(100081-201010,中国食品药品检定院,纯度>98%),山奈酚(110861-202013,中国食品药品检定院,纯度>98%),吲哚美辛(H12035637,河北山姆士药业有限公司)乙腈,甲醇(色谱级),其余试剂均为分析纯。
1.3 实验动物
昆明种雄性小鼠(18.39±2.82)g,购自贵州医科大学实验动物所,饲养于通风良好,室温18℃~25℃,按常规定期消的动物房,按每笼8只分装。由专人饲养管理。小鼠人性化饲养,自由饮水及饲料。动物实验经贵州中医药大学实验动物伦理委员会许可,实验操作和处理严格遵循国际准则。
1.4 大乌泡不同部位提取物的制备
取1 kg大乌泡用10倍量70%乙醇回流提取3次,每次为3 h,3 h,2 h,合并滤液,回收乙醇至无味,浓缩至1 g/mL,即得大乌泡乙醇提取物。取适量乙醇提取物,依次用4倍量的石油醚、乙酸乙酯、正丁醇分别萃取3次,收集萃取液,回收溶剂,制备干浸膏,即得大乌泡石油醚,乙酸乙酯,正丁醇提取部位。
2 实验方法
2.1 有效部位的筛选
2.1.1 分组与给药
分别将小鼠随机分为6组,每组8只。大乌泡服用量为30g/天[3],根据人服用剂量换算小鼠剂量,大乌泡70%乙醇提组(780 mg/kg)、石油醚组(90.17 mg/kg)、乙酸乙酯组(144.30 mg/kg )、正丁醇组(267.54 mg/kg)为给药组,吲哚美辛为阳性药对照组(6.5 mg /kg),正常小鼠为空白对照组。各组均连续给药7天,空白对照组给予同体积蒸馏水。
2.1.2 样本收集
各组小鼠末次给药后l h于小鼠右耳前后两面涂抹二甲苯,致耳肿胀后,取血,采用酶联免疫法(ELISA)检测小鼠血清中炎症因子TNF-α、IL-1β、TGF-β水平。取血后处死,剪下双耳,用直径9 mm自动打孔器,在两耳廓中间部位同一位置打下耳片,称重。
小鼠耳肿胀度计算:肿胀度=右耳重-左耳重
2.1.3 数据统计分析
2.2 HPLC测定大乌泡中槲皮素、山奈酚的含量测定
2.2.1 色谱条件
色谱柱为ACE Excel 5 C18-AR(250×4.6 mm,5µm);流动相以0.3%磷酸-甲醇(30:70)等度洗脱,检测的波长为360nm,柱温为30℃;流速为0.8mL/min;进样体积为10μL。
2.2.2 对照品与样品溶液的制备
分别精密称取槲皮素对照品1.85 mg、山奈酚对照品1.25 mg,用甲醇定容至10 mL容量瓶中,制成槲皮素浓度为0.185 mg/mL;山奈酚浓度为0.125 mg/mL的对照品溶液。取大乌泡乙酸乙酯,正丁醇部位干浸膏混合均匀,得有效成分提取物,精密称取此提取物1 g,转移至50 mL锥形瓶中,加入盐酸甲醇溶液(含10%盐酸)25mL,称定重量,冷浸30min后,超声提取60 min(80HZ,60℃),取提取液放至室温,补量,过滤,即得大乌泡提取物样品溶液。
2.2.3 线性关系的考察
吸取不同浓度的槲皮素(4.60、9.25、18.50、37.00、74.00、111.00μg/mL)和山奈酚(1.25、6.25、12.50、25.00、75.00、125.00μg/mL)对照品溶液,按“2.2.1”项下色谱条件进行测定。将测得的峰面积与相应的浓度作线性方程。
2.2.4 专属性、精密度、重复性、稳定性试验
分别精密吸取“2.2.2”项下槲皮素和山奈酚标准溶液,及供试品溶液。按“2.2.1”项下色谱条件,分别进行6次测定,对仪器精密度及方法重复性进行考察。并考察样品24小时内的稳定性。
2.2.5 加样回收率实验
精密称取1 g已知含量槲皮素和山奈酚的大乌泡有效部位提取物样品6份,加入对照品,按“2.2.2”项下的方法制备,按照“2.2.1”的色谱条件检测。
2.2.6 样品含量测定
按“2.2.2”项的方法制备样品溶液,在“2.2.1”项色谱条件下进样分析,记录槲皮素和山奈酚的峰面积,采用外标一点法计算出大乌泡药效部位中槲皮素和山奈酚的含量。
2.3 UV测定大乌泡中芦丁的含量
2.3.1 对照品与样品溶液的制备
精密量取芦丁对照品10.00mg,用60%乙醇溶液定容至50mL容量瓶中,制备成浓度为0.2mg/mL的对照品溶液。精密称取大乌泡有效部位提取物1 g,移至锥形瓶中,加入25mL甲醇溶液,称重,超声提取50min(80HZ,60℃),冷至室温,补重,静置滤过,为供试品溶液。
2.3.2 检测波长的选择
精密吸取芦丁对照品溶液2mL,用60%乙醇溶液稀释至10mL。精密吸取大乌泡供试品溶液1mL,将其转移至10mL的容量瓶中,甲醇溶液稀释至刻度。对照品及试品溶液分别进行200~800nm波长范围内的全波长扫描。
2.3.4 线性关系考察
精密吸取芦丁对照品溶液稀释成一系列浓度(0.00501、0.01002、0.01503、0.02004、0.02505、0.03006mg/mL),375nm波长下测定吸光度。以浓度及其吸光度作线性回归,得线性回归方程。
2.3.5 精密度、重复性、稳定性试验
精密吸取芦丁标准溶液5mL,转移至25mL容量瓶中,加入60%乙醇稀释至刻度。375nm波长下测定吸光度,重复6次,计算其吸光度的RSD%。制备6份供试品溶液,每份精密吸取2 mL,加入甲醇溶液稀释至10mL,计算其吸光度的RSD%。并考察样品24小时内芦丁含量的稳定性。
2.3.6 加样回收试验
称取大乌泡有效部位提取物6份,每份约0.5 g,分别精密加入芦丁对照品溶液,按“2.3.2”项下方法制备,375nm波长下测定吸光度,测定其含量的RSD%。
3 实验结果
3.1 药效试验
与模型组比较,大乌泡70%乙醇提取物组、正丁醇、乙酸乙酯提取部位组能显著缓解二甲苯对小鼠耳朵刺激而产生的肿胀,降低炎症小鼠血清中肿瘤坏死因子-α(TNF-α)、白介素1β(IL-1β)、转化生长因子-β(TGF-β)水平。结果见图1。

图1 各组小鼠各项指标的检测结果(±sD,n=8)
3.2 HPLC测定大乌泡中槲皮素、山奈酚的含量测定
3.2.1 线性关系的考察
结果见图2。槲皮素回归方程为:y=16334x+30160,r=0.9997,浓度在4.600~111.000μg/mL范围内线性关系良好;山奈酚回归方程为:y=14148x+2623.3,r=0.9996。浓度在1.250~125.000μg/mL范围内线性关系良好。
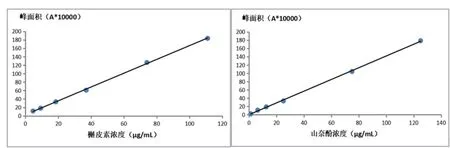
图2 槲皮素、山奈酚的线性回归曲线
3.2.2 专属性、精密度、重复性、稳定性试验
色谱图见图3,对照品及样品在相同色谱条件下进行测定,结果表明含量测定方法专属性好。对照品及6份样品溶液,测得槲皮素、山奈酚含量RSD%<3%,实验精密度、重复性良好,结果见表1。24小时内,所测定有效成分槲皮素和山奈酚含量RSD<3%,样品稳定性好,结果见表2。

表1 精密度和重复性结果(n=6)

表2 供试品溶液稳定性试验结果(n=6)
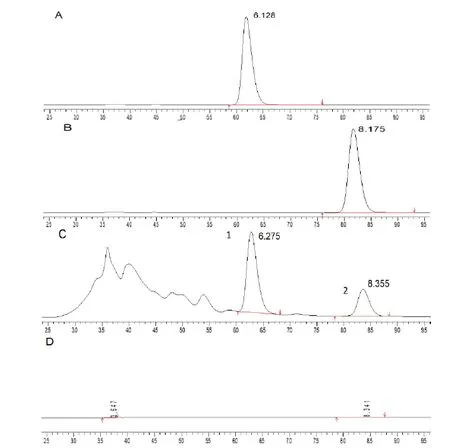
图3 山奈酚、槲皮素对照品和供试品溶液HPLC谱图
3.2.3 加样回收率实验
结果见表3,大乌泡样品含量测定方法回收率性良好。
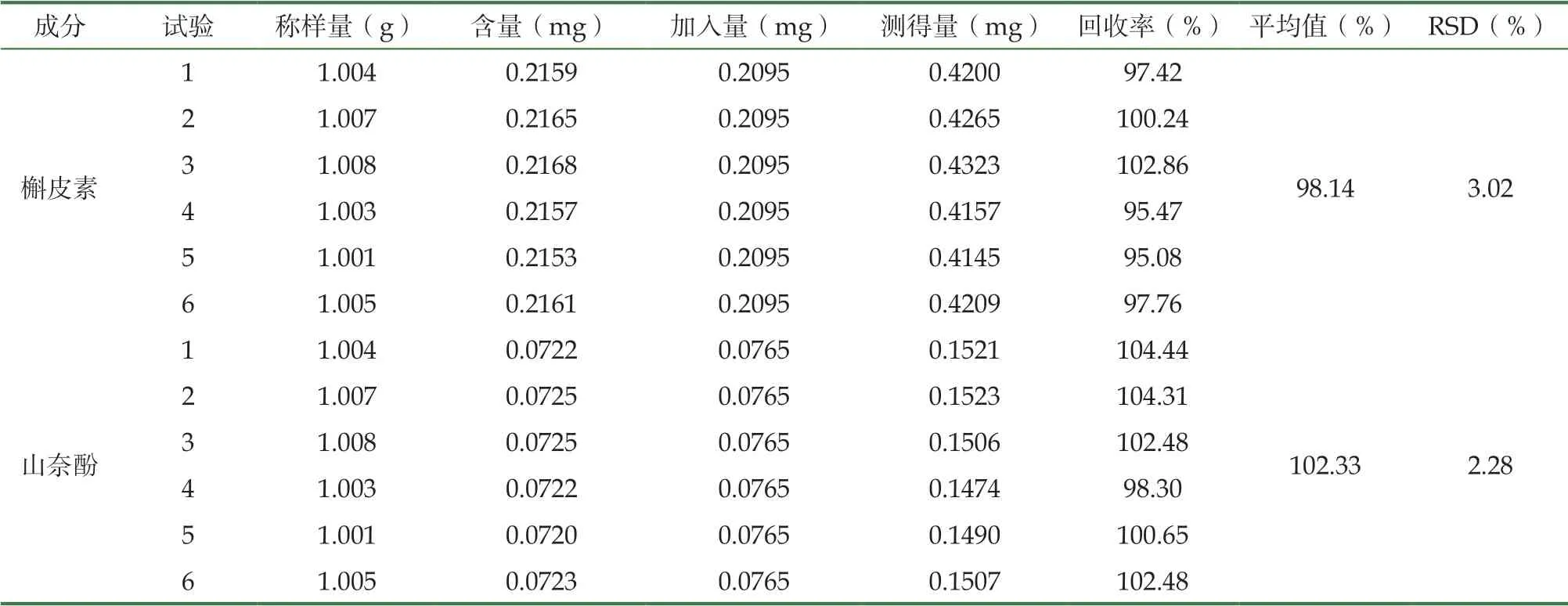
表3 槲皮素、山奈酚加样回收率(n=6)
3.2.4 样品含量测定
三批大乌泡药效提取部位槲皮素、山奈酚的含量见表4。

表4 大乌泡药效部位中槲皮素和山奈酚含量测定的结果(n=3)
3.3 UV测定大乌泡中芦丁的含量
3.3.1 线性关系考察
结果见图4。槲皮素回归方程为:y=24.511x +0.014,r=0.9994,浓度在0.00501~0.03006mg/mL范围内线性关系良好。

图4 芦丁线性回归曲线
3.3.2 精密度试验
对照品重复进样6次,及6份样品溶液测得芦丁峰面积RSD(%)<3%,实验精密度、重复性良好,结果见表5。24小时内,所测定有效成分芦丁含量RSD<3%,样品稳定性好,稳定性结果见表6。
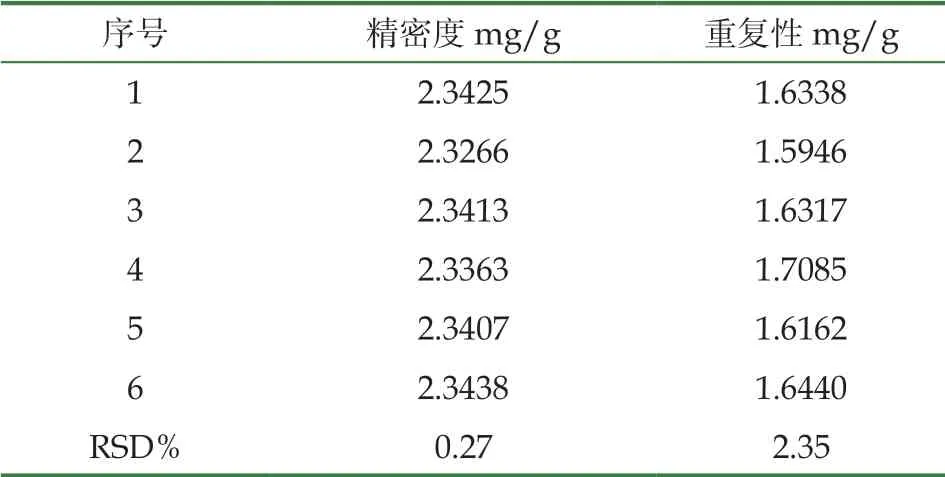
表5 精密度和重复性结果(n=6)

表6 稳定性考察(n=6)
3.3.3 加样回收试验
结果见表7,大乌泡药效提取部位中芦丁的含量测定方法回收率性良好。
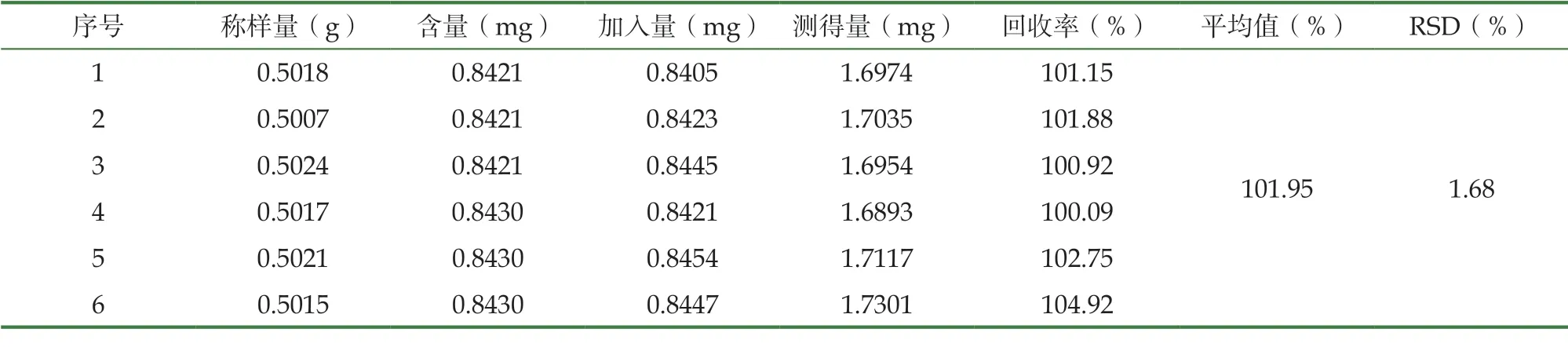
表7 芦丁加样回收率考察(n=6)
3.3.4 大乌泡药效提取部位中芦丁的含量测定
三批大乌泡药效提取部位中芦丁含量见表8。

表8 芦丁的含量(n=3)
4 讨论
本课题通过抗炎药效筛选实验,筛选出正丁醇部位、乙酸乙酯部位为主要抗炎活性部位,而这两个部位是黄酮类化合物聚集的主要部位,因此,大乌泡抗炎药效物质基础可能是黄酮类物质。本实验以黄酮类成分槲皮素、山奈酚、芦丁为指标成分,采用高效液相色谱法对山奈酚与槲皮素进行含量测定,采用紫外线-可见光分光度法对芦丁进行含量检测,槲皮素和山奈酚均在360~365nm波长处有较好的检测效能。经过对检测方法的专属性、线性关系、精密度、重复性、稳定性、回收率等进行考察,结果显示,大乌泡中有效成分的含量检测方法,稳定可靠、重复性良好。
孟鑫、刘瑶等[12,13]根据大乌泡化合物的1H-NMR、13C-NMR谱图进行综合解析后发现,大乌泡正丁醇萃取部位化学成分主要为槲皮素和山奈酚。槲皮素具有抗病毒、抗炎、抗肿瘤、抗氧化、免疫调节等多种药理活性[14-19]。司天雷[20]在槲皮素体内外抗炎作用研究中发现,槲皮素体外能有效抑制前列腺素E2和一氧化氮表达,调控诱导型一氧化氮合成酶表达,抑制促炎细胞因子产生的作用;对内毒素血症小鼠模型中促炎因子的基因表达有抑制作用,能够有效控制促炎因子的合成与释放。山奈酚能明显抑制LPS诱导的人单核细胞MAPK通路的表达[21]。也可阻断哮喘小鼠气道上皮细胞Tyk-STAT信号通路,抑制STAT3的激活,有效抑制炎症的发生[22]。芦丁则可以通过抑制一些参与炎症的细胞信号通路和关键酶的表达,产生抗炎作用[23]。综上所述,槲皮素、山奈酚、芦丁等成分可能是大乌泡发挥抗炎作用的关键活性成分。

