人EGFL7真核表达载体的构建及稳定转染EA.hy926细胞系的建立
丁 悦,黄为民,唐丽君
(南方医科大学南方医院新生儿科,广东 广州 510515)
支气管肺发育不良(broncho-pulmonary dysplasia,BPD)是极低出生体重儿长期氧疗、机械通气常见的肺部并发症,有较高的致残率及死亡率[1],存活儿常遗留肺功能损伤及神经系统后遗症[2],是早产极低体重儿并发症中救治耗费最高的疾病。随着肺表面活性物质及无创呼吸机等的应用[3-4],BPD在病理特征表现上,以肺泡以及肺微血管不良发育为基础[5]。调控肺血管发育的生长因子紊乱可导致肺血管发育受阻进而影响肺泡正常发育。人类表皮生长因子样结构域7(EGFL7)是一种血管内皮特异分泌的新型蛋白,在高氧致新生大鼠BPD中表达下调,有可能对BPD的发生发展有影响[6]。基于此,本研究建立针对人的真核表达EGFL7的载体,在此基础上进一步评价该载体是否能稳定地转染EA.hy926细胞系,从而为探究EGFL7对BPD的影响提供参考借鉴。
1 材料与方法
1.1 材料EA.hy926细胞购自广州励德生物科技有限公司,胎牛血清购自美国Gibco公司;质粒提取试剂盒、G418购自美国invitrogen公司;DNA凝胶回收试剂盒购自美国OMEGA公司;免抗人EGFL7多克隆抗体购自美国santa cruz公司;β-actin抗体购于美国Affinity公司;实时荧光定量PCR(RT-PCR)试剂盒购于QIAGEN公司。
1.2 方法
1.2.1 RT-PCR扩增mTSARG3基因开放阅读框设计EGFL7引物,扩增含EGFL7开放阅读框的822bp序列,琼脂糖凝胶通过电泳仪(美国伯乐公司,型号:164-5050)进行电泳,然后对收回后的胶进行分析。
1.2.2 pEGFP-N1-EGFL7重组质粒的构建及鉴定利用HindⅢ以及BamHI对已经纯化后的PCR产物和pEGFP-N1质粒进行双酶切,将其转化成为E coli DH5ɑ的感受态细菌,借助药物筛选后以获得显示为阳性的克隆,通过PCR扩增并进一步双酶切鉴定获得的阳性克隆,在进行测序后就可以具体对载体命名为pEGFP-N1-EGFL7。
1.2.3 pEGFP-N1-EGFL7在EA.hy26细胞系中的瞬时转染EA.hy926细胞融合至80%~90%时,将pEGFP-N1-EGFL7质粒通过电转仪(日本BEX公司,型号:BEX系列CUY21EDIT Ⅱ型)转染EA.hy926细胞。荧光显微镜下观察转染情况。
1.2.4 建立稳定转染人EGFL7的EA.hy926细胞系筛选G418浓度即细胞全部死亡的最低浓度(500 μg/mL)。EA.hy926细胞转染后48 h,改含G418的DMEM培养基培养,从中筛选出克隆物质,为获得单克隆的细胞系对上述克隆物进行扩增培养。将pEGFP-N1空白质粒导入EA.hy926细胞中,并将此细胞作为阴性对照组。
1.2.5 RT-PCR检测转染细胞中EGFL7基因使用Trizol试剂盒进行RNA提取,利用微量分光光度法测定RNA含量及纯度。利用琼脂糖凝胶电泳的检测方式,对18S RNA、28S RNA进行测定,测定的内容主要是证实RNA序列完整性。借助逆转录的方式,合成cDNA的第一链,利用这种参考模板做荧光定量RT-PCR工作。实时(Real-time)PCR数据采用2-△CT相对定量方法处理。
1.2.6 免疫印迹法(WB)鉴定EGFL7蛋白表达总蛋白加入到10 μL的5 × 样品缓冲液(比例为4∶1),煮沸后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜,50 g.L-1 BSA室温封闭2 h后加入EGFL7抗体(稀释浓度为l∶400),4 ℃冷库孵育过夜,用含TwEEN20的TBST在摇床上充分洗涤PVDF膜,每次10 min,前后共3次。然后加入经l∶10 000稀释的二抗,将稀释好的二抗置入22 ℃~26 ℃室温下,摇床上持续摇晃约60 min,借助TBST洗涤PVDF膜3次,利用电化学发光法测定并且做显色处理,之后针对结果予以吸光度的扫描检查。
1.2.7 统计学方法用SPSS 21.0统计学软件进行数据处理。数据均进行正态检验,两样本间比较采用t检验;两样本以上之间的比较,则检验方差是否齐性,若方差齐性,则采用方差分析,组内多重间比较行LSD检验,反之则用Welch检验。P<0.05表示差异有统计学意义。
2 结果
2.1 RT-PCR扩增mTSARG3基因开放阅读框结果从脐静脉内皮细胞的cDNA文库中扩增EGFL7的开放阅读框,电泳分析琼脂糖凝胶发现:819bp为基因片段的大小,这一结果与预期的基本一致,见图1。
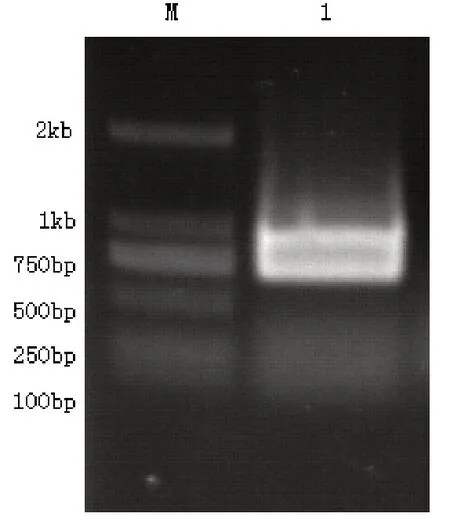
图1 泳道M:DL1kb DNA Marker
2.2 pEGFP-N1-EGFL7重组质粒双酶切及测序鉴定pEGFP-N1-EGFL7重组质粒1、2借助双酶切下7kd左右、819bp左右条带(图2),经测序后证实DNA序列与GenBank中EGFL7序列一致,表明重组质粒构建成功。
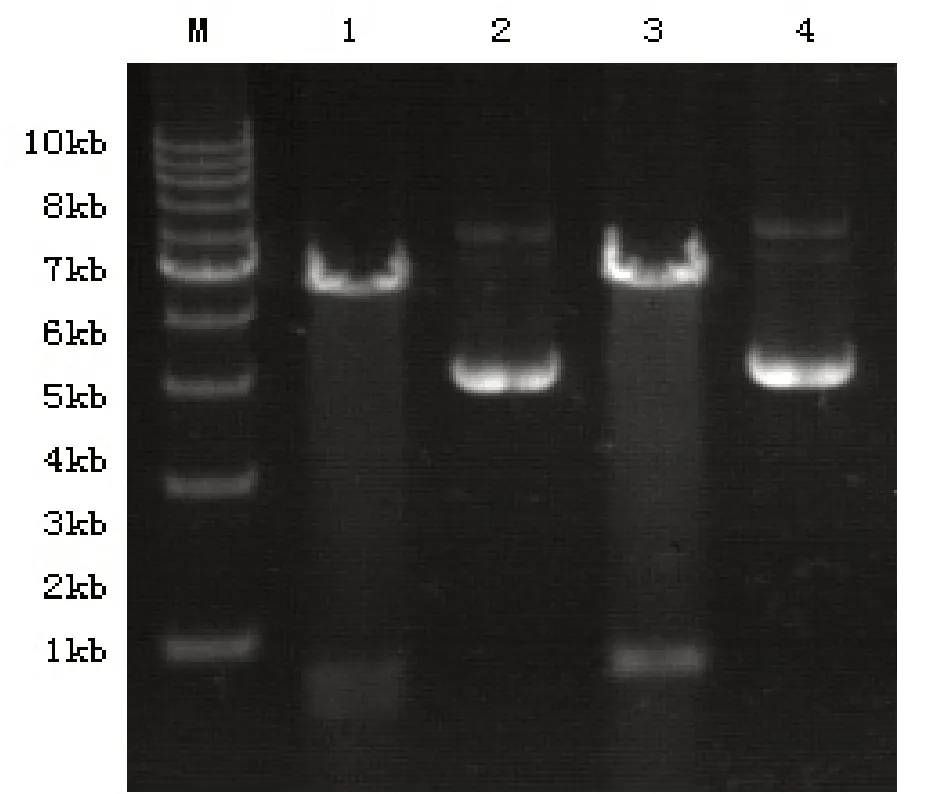
图2 泳道M:1kb DNA 梯度标志
2.3 稳定转染细胞系的鉴定
2.3.1 RT-PCR检测EGFL7mRNA设对照质粒转染的EA.hy926细胞EGFL7mRNA相对表达量(relativequantity,RQ)为l,N1-EA.hy926和hEGFL7-EA.hy926两组差异有统计学意义(t=-5.975,P=0.028),见表1。
表1 不同细胞组间EGFL7mRNA的比较( ±s)

表1 不同细胞组间EGFL7mRNA的比较( ±s)
组别 例数 2△△CT值 t值 P值N1-EA.hy926 3 1.0124±0.0472 -5.975 0.028 hEGFL7-EA.hy926 3 8.6167±2.2337
2.3.2 WB检测EGFL7蛋白量hEGFL7-EA.hy926组EGFL7蛋白量明显高于空白对照组和N1-EA.hy926组,经过统计学方法,差异均有统计学意义(P<0.001),见图3、表2。

图3 转染细胞的EA.hy926蛋白表达
表2 不同细胞组间EGFL7蛋白表达量的比较( ±s)
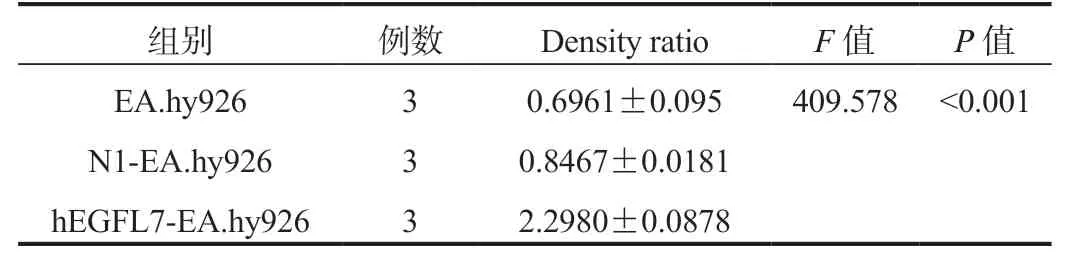
表2 不同细胞组间EGFL7蛋白表达量的比较( ±s)
注:方差齐(P=0.107),故采用方差分析,组内多重比较采用LSD法,EA.hy926与N1-EA.hy926两组间差异无统计学意义(P=0.051);hEGFL7-EA.hy926组明显高于EA.hy926组和N1-EA.hy926组(P<0.001)。
组别 例数 Density ratio F值 P值EA.hy926 3 0.6961±0.095 409.578<0.001 N1-EA.hy926 3 0.8467±0.0181 hEGFL7-EA.hy926 3 2.2980±0.0878
3 讨论
BPD是早产儿比较严重的慢性呼吸系统疾病,可导致患儿长时间脱氧困难,对肺部及气道造成持续的慢性损伤,严重者可出现肺动脉高压甚至死亡[1]。即使存活,后期可能因感染或哮喘等原因反复住院从而导致预防不良。BPD的确切病因及机制尚未明确。因此,迫切需了解BPD的发生机制从而寻求有效的防治措施减少早产儿BPD发生率。肺血管发育紊乱及肺泡化阻滞是BPD发生发展的关键事件。既往学者们关注的主要领域是肺泡化损伤,但对BPD的预防及治疗并未取得明显成效。近年来认为BPD是由于肺微血管发育不良导致肺泡发育异常的“血管发育障碍假说”[7]。因此,目前认为肺血管分泌的多种因子在肺微血管和肺泡正常发育中起重要作用。探索血管生长因子在BPD中的作用可望为BPD的防治开辟新的途径。EGFL7是新近发现的在肺血管形成和生成的过程中均起重要作用的蛋白,在血管内皮细胞中特异表达,通过自主分泌或者旁边组织分泌刺激血管生成[8]。EGFL7可以抑制平滑肌细胞迁移,促进血管内皮细胞迁移、黏附、增殖在正常血管管腔形成中发挥了关键作用[9]。EGFL7敲除小鼠会出现外周出血、循环发育缺陷[10]。EGFL7过表达则导致血管结构异常及血管稳态受损[9]。这提示EGFL7是血管发育中的关键蛋白,其是否参与了BPD的发病过程,国内外报道较少。
我们从人的脐静脉内皮细胞cDNA文库中获得扩增EGFL7的ORF,经过双酶切将其克隆到pEGFP-N1中,得到重组表达质粒pEGFP-N1-EGFL7。利用电穿孔法最终建立稳定转染的EA.hy926细胞系。使用RT-PCR及蛋白质印迹法检测EGFL7在稳定转染EA.hy926细胞系中的基因及蛋白水平。这一结果显示:研究成功地建立了稳定整合pEGFP-N1-EGFL7载体的EA.hy926细胞系。我们前期研究发现:新生鼠在60%的氧气中持续暴露14 d可以模拟BPD的发生发展过程,通过建立此模型我们观察到肺部EGFL7基因和蛋白表达水平明显低于正常组,下调值同肺部微血管的密度降低有紧密相关性,这一结果则提示EGFL7可能同肺部的微血管发育存在障碍有较大联系[6]。此外,在高氧的暴露下,血管内皮细胞的EGFL7蛋白表达量明显低于正常组并且高氧组的内皮细胞凋亡明显增加,EGFL7蛋白表达增加可避免血管内皮细胞发生凋亡[11]。高表达EGFL7是否可减少内皮细胞凋亡进而促进血管发育,需深入研究明确。EGFL7在多种炎症及血管生成中也扮演了重要的角色。在EGFL7敲除的体外血管模型中,EGFL7敲除后会抑制血管生成,同时血管屏障功能受损并导致炎症反应[12]。EGFL7敲除鼠可导致神经系统免疫反应,重组EGFL7蛋白治疗则可减轻上述炎症反应[13]。在脂多糖诱导的炎症反应中,鼠肺组织血管内皮细胞中的EGFL7表达减少,上调EGFL7可减少白细胞在内皮细胞的黏附[14]。这表明EGFL7有可能通过减轻炎症反应增加血管生成。肺部高表达EGFL7是否能减轻炎症反应促进血管及肺泡发育进而发挥对BPD的保护作用,国内外尚未见报道。
综上所述,本研究通过建立能高表达EGFL7蛋白的EA.hy926细胞系,为下一步在体内外实验中探讨EGFL7在BPD中的作用及机制奠定基础。

