银杏叶提取物改善高脂血症大鼠肝损伤的机制
王 昱,何九军
(1.陇南师范高等专科学校,甘肃 成县 742500;2.陇南特色农业生物资源研究开发中心,甘肃 成县 742500)
现代医学认为,高脂血症指人体脂质代谢异常,血浆里的脂质浓度异常升高,并超过正常参考值范围的疾病[1],该病对身体的损害是隐匿而进行性和全身性的,是引发脂肪肝以及动脉粥样硬化、冠心病等心脑血管疾病的元凶[2],因此,调节脂质代谢对预防和治疗高脂血症尤为重要.研究表明,甘油三酯水解酶(ATGL)和激素敏感性甘油三酯脂肪酶(HSL)是水解脂肪的关键酶[3],过氧化物酶体增殖物激活受体γ(PPARγ)是调节脂肪细胞分化和能量代谢的关键性转录因子[4],蛋白磷酸酶1(PP1)、DNA依赖的蛋白激酶(DNA-PK)和上游刺激因子1(USF1)脂肪酸合成的重要调控因子[5-6],而固醇调节元件结合蛋白-1c(SREBP-1c)是调控脂肪合成和葡萄糖代谢相关酶基因表达的决定因子,腺苷酸活化蛋白激酶(AMPK)则是调控SREBP-1c的上游因子之一[7].这几类因子可能共同调控着机体内脂类代谢途径的稳态.目前,临床上常用的一线降脂药物为他汀类和贝特类,但此类药物会引起恶心、腹泻、肝毒性等严重不良反应[8-9],而传统中药或天然产物中含有大量具有降血脂作用的活性成分,这种活性因具有多靶点、多层次、副作用少的特点用来预防高脂血症及相关疾病而成为了现代生物研究的热点[10].
银杏叶提取物(GBE)的主要有效成分为黄酮类和萜内酯类[11],它具有抗炎、抑制神经细胞凋亡和兴奋性氨基酸的释放、抗氧化和氧自由基损伤等多种生物效应[12].近年来研究发现,GBE对高脂血症大鼠的血脂水平有显著改善[13-15],但对它确切的分子机制仍未知.本研究拟利用生物显微技术、酶联免疫吸附、定量PCR及Western blot等,探讨GBE是否对高脂血症模型大鼠肝损伤具有干预作用的可能机制,旨在为临床高脂血症提供新治疗靶点及银杏叶的开发利用提供依据.
1 材料与方法
1.1 主要试剂
银杏叶提取物为棕褐色粉末(总黄酮醇苷25.57%、萜类内酯6.62%、银杏总酸1.24×10-6),购自陕西斯诺特生物技术有限公司;高糖高脂饲料(20%蔗糖、0.2%胆酸钠、0.8%胆固醇、15%猪油、适量的磷酸氢钙、酪蛋白、石粉等,购自北京博泰宏达生物技术有限公司;脂肪甘油三酯水解酶(ATGL)、激素敏感性甘油三酯脂肪酶(HSL)酶联免疫试剂盒,均购自上海科顺生物科技有限公司;鼠抗PPARγ、SREBP-1、PP1、DNA-PK、AMPK、USF1抗体,均购自武汉艾美捷科技有限公司;0.45 μm硝酸纤维膜,购自Solarbio公司;β-actin抗体、二抗羊抗兔IgG,购自上海碧云天生物技术研究所;荧光定量PCR试剂,购自TakaRa公司.
1.2 主要仪器
BS-300型全自动生化分析仪(深圳迈瑞),TGL-16M高速台式冷冻离心机(美国Beckman-coulter公司),DYCPZ型电泳槽、DYY-IB型电泳仪(北京市六一仪器厂),FX-35WA Nikon显微镜(日本Nikon公司),7900 HT定量PCR仪(美国ABI公司),核酸蛋白分析仪(美国贝克曼库尔特公司).
1.3 实验动物
SPF级SD大鼠,雄性、6~8周龄、体重(220±5)g,购自兰州兽医研究所实验动物中心(生产许可证号:SCXK(甘)2015-0001).
1.4 试验方法
1.4.1 试验设计
将50只SD大鼠随机分为5组,分别为对照组、模型组、GBE低剂量组、GBE中剂量组、GBE高剂量组,每组10只.参照文献[16],对照组给予普通饲料,模型组与GBE剂量组给予不同浓度梯度的酒精和高糖高脂饲料,自由饮食酒精,通过大鼠毛色、食欲、粪便、对外界刺激的反应情况及血脂水平等指标来判定建模是否成功.造模同时,参考文献[12,15]并结合GBE半数致死剂量,GBE低、中、高剂量组分别按25,50,100 mg/kg(以体质量计)灌胃GBE,每日1次,连续给药24周后,记录所有动物的体质量.常规麻醉,眼球采血,离心(3 000 r/min)10 min,全自动生化分析仪测定血清中TG、ALT、AST及FFA水平.处死大鼠后,取肝组织称重,计算肝指数.肝指数=肝质量(g)/体质量(g)×100%.
1.4.2 组织病理学检查
取肝左叶同一部位组织,固定于15%中性福尔马林缓冲液,经常规组织脱水、透明、包埋、切片,然后进行苏木素-伊红(H.E.)染色,显微镜下观察同一部位肝组织并记录病理变化.
1.4.3 ELISA检测脂肪ATGL和HSL水平
取约0.5 g同一侧腹腔脂肪组织,在冰浴中用高速分散均质机充分研碎,制备成10%脂肪匀浆,3 500 r/min离心10 min,吸取上清液用ELISA法检测脂肪ATGL和HSL水平.
1.4.4 荧光定量PCR检测肝组织PP1、DNA-PK、USF1、PPARγ、AMPK和SREBP-1c基因mRNA相对表达量
在2 mL的离心管中加入大鼠肝脏和Trizol后用匀浆器反复研磨,离心(15 000 r /min)10 min,用酚-氯仿抽提上清液中RNA,再进行逆转录反应、PCR扩增,以β-actin为内参.采用ABI 7500软件分析反应结果,用2-ΔΔCt方法进行相对定量.引物由上海Invitrogen公司设计合成,引物序列见表1.

表1 荧光定量PCR引物
1.4.5 Western blot 检测肝脏PP1、DNA-PK、USF1、PPARγ、AMPK和SREBP-1c蛋白的表达
在RIPA裂解液中加入肝脏组织,制成10%的组织匀浆,4 ℃离心(1 200 r/min)15 min,提取总蛋白,BCA法测定蛋白质浓度.凝胶电泳(SDS-PAGE)、转膜和封闭.按抗体说明书加入兔抗鼠一抗PP1、DNA-PK、USF1(均1∶1 000)、PPARγ(1∶1 500)、AMPK(1∶1 000)、SREBP-1c(1∶2 000),4 ℃过夜,充分洗涤,加偶联辣根过氧化物酶(HRP)的二抗IgG(1∶2 000),ECL显色,运用Image Lab4.1图像分析,以PP1、DNA-PK、USF1、PPARγ、AMPK和SREBP-1c蛋白分别与β-actin条带灰度比值表示相对表达水平.
1.5 统计分析
2 结果
2.1 GBE对高脂血症大鼠肝指数的影响
与对照组相比,模型组大鼠肝指数显著升高(P<0.01).与模型组相比,GBE低剂量组大鼠肝指数出现下降趋势,但差异不显著(P>0.05).GBE中、高剂量组大鼠肝指数显著下降(P<0.05,P<0.01).GBE低、中、高剂量组大鼠肝指数显著高于对照组(P<0.05,P<0.01),见图1.

注:组间条形图上标不同小写字母表示差异显著(P<0.05);标不同大写字母表示差异极显著(P<0.01);标相同字母或无字母标注表示差异不显著(P>0.05),下同.
2.2 GBE对肝组织结构的影响
对照组大鼠肝组织呈现正常形态,肝小叶清晰可见,围绕中央静脉肝细胞索呈放射状排列,肝细胞内无脂滴分布.模型组大鼠的肝小叶结构破坏、形态不清,细胞索排列紊乱,脂质空泡遍及整个肝组织,有炎性细胞浸润,胞浆内有大小不等、数量不一的弥散性空泡状脂滴.与模型组相比,GBE各剂量干预后,大鼠肝小叶清晰,肝细胞排列及结构趋于整齐,细胞内脂滴逐渐消失,见图2.
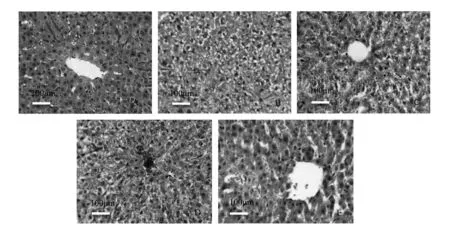
注:A.对照组;B.模型组;C.低剂量组;D.中剂量组;E.高剂量组(标尺示100 μm).
2.3 GBE对高脂血症大鼠血清TG、FFA含量的影响
模型组大鼠血清TG、FFA含量较对照组极显著升高(P<0.01).GBE干预后,大鼠血清TG、FFA含量较模型组显著降低(P<0.05,P<0.01).GBE低、中、高剂量组大鼠血清TG含量高于对照组(P<0.05,P<0.01),GBE低、中剂量组大鼠血清FFA含量高于对照组(P<0.05,P<0.01),但高剂量组血清FFA含量与对照组差异不显著(P>0.05),见图3.

图3 GBE对高脂血症大鼠血清TG、FFA含量的影响(mmol/L)
2.4 GBE对高脂血症大鼠肝功能的影响
与对照组比较,模型组大鼠血清ALT和AST活性极显著升高(P<0.01);与模型组比较,经GBE各剂量干预后,大鼠血清ALT和AST活性明显降低(P<0.05,P<0.01).但GBE低、中剂量组大鼠血清ALT和AST活性高于对照组(P<0.05,P<0.01),高剂量组血清ALT和AST活性与对照组差异不显著(P>0.05),见图4.

图4 GBE对高脂血症大鼠血清AST和ALT水平的影响
2.5 GBE对高脂血症大鼠甘油三酯水解酶的影响
与对照组相比,模型组大鼠脂肪中甘油三酯水解酶HSL活性明显升高(P<0.01),ATGL含量显著降低(P<0.01);与模型组相比,GBE低、中、高剂量组大鼠脂肪甘油三酯水解酶HSL含量显著降低(P<0.05,P<0.01),ATGL含量明显升高(P<0.05,P<0.01).但GBE低、中剂量组大鼠脂肪中甘油三酯水解酶与对照组差异显著(P<0.05,P<0.01),高剂量组脂肪中甘油三酯水解酶与对照组差异不显著(P>0.05),见图5.

图5 GBE对高脂血症大鼠甘油三酯水解酶的影响
2.6 GBE对高脂血症大鼠肝组织脂质代谢相关蛋白表达水平的影响
与对照组相比,模型组大鼠肝组织PP1、SREBP-1c、DNA-PK、USF1蛋白的表达量均极显著升高(P<0.01),而肝组织中PPARγ和AMPK蛋白的表达量极显著降低(P<0.01);与模型组比较,低、中、高剂量GBE均能影响肝组织PP1、DNA-PK、USF1、SREBP-1c、AMPK和PPARγ蛋白的表达,其中PP1、DNA-PK、USF1、SREBP-1c的表达量均显著降低(P<0.05,P<0.01),AMPK和PPARγ的表达量显著增加(P<0.05,P<0.01).定量PCR检测肝组织PP1、SREBP-1c、DNA-PK、USF1、AMPK及PPARγ mRNA表达水平的结果与其蛋白表达水平一致.
3 讨论
高脂血症是血中胆固醇和(或)甘油三酯过高的一种“血脂异常”表现,由生物脂肪代谢或运转异常引起,能诱发脂肪肝和动脉粥样硬化等并发症的发生[17-18].肝脏在脂类的消化、吸收、分解、合成及运输等脂质代谢过程中起核心作用,当脂肪组织堆积于肝脏,导致肝组织浸润变性,就会加剧脂代谢紊乱[19].一般而言,高脂血症属于可逆性疾病,尽早发现并及时治疗往往可恢复正常,这为临床诊疗提供了参考依据[20].陈梅霞、陈为健、许麦成等[13-15]研究发现,GBE能明显降低高脂血症大鼠血清TC、TG和低密度脂蛋白含量,抑制脂质反应,具有明显降血脂的功效,这与本实验结果一致.GBE可改善高脂血症模型大鼠肝组织的病理变化,显著降低肝指数及血清FFA、TG、ALT、AST水平,减轻炎症细胞浸润或脂肪病变.但本研究通过观察检测肝脏结构功能、甘油三酯水平、甘油三酯水解酶、脂代谢调控因子等指标,主要研究GBE影响高脂血症大鼠肝的作用机制.研究发现,机体内脂类代谢的途径包括脂类的合成、吸收及排泄,而脂类代谢途径的稳态依赖于体内多个因子的共同调控[21].PPARγ-HSL/ATGL、AMPK/SREBP-1c和PP1-DNA-PK-USF1信号通路与脂肪细胞形成、脂肪沉积和脂肪因子分泌、营养水平等脂肪代谢过程密切相关[22-23].本实验结果显示,模型组大鼠肝组织PPARγ、AMPK、p-AMPK表达水平显著降低,肝组织SREBP-1c、PP1、DNA-PK和USF1表达水平显著增高;脂肪ATGL含量显著降低,HSL含量显著升高.GBE干预后,大鼠肝组织PPARγ、AMPK、p-AMPK表达水平显著增高,肝组织SREBP-1c、PP1、DNA-PK和USF1表达水平显著降低;脂肪ATGL含量显著升高,HSL含量显著降低.这说明GBE对PPARγ-HSL/ATGL、AMPK/SREBP-1c和PP1-DNA-PK-USF1信号通路有明显的干预作用,进而影响大鼠脂类物质代谢.银杏提取物能改善肝功能,减轻肝脏损伤,进一步说明GBE作用PPARγ-HSL/ATGL、AMPK/SREBP-1c和PP1-DNA-PK-USF1信号通路是防治高血脂症的有效靶点.

图6 GBE对高脂血症大鼠肝组织脂质代谢相关蛋白表达的作用
总之,GBE通过调节PPARγ-HSL/ATGL、PP1-DNA-PK-USF1和AMPK/SREBP-1c信号通路,影响高脂血症大鼠的血脂水平,加速胆固醇的代谢,改善肝功能,进而改善脂质代谢紊乱,减少脂质沉积作用.此研究以期为降血脂中药新药或保健食品研发提供参考和理论依据,也为探究中药多靶点协同调控脂质代谢作用提供了研究思路.

