姜黄素对急性缺血性脑卒中小鼠MCP-1和CCR2水平的影响
张 鑫, 薛 慧, 孟天予, 耿尚勇, 郑雅楠, 赵吉利, 杜文倩
急性缺血性卒中(acute ischemic stroke,AIS)的发病率逐年增加[1],AIS常导致脑组织坏死及局灶性神经功能损伤,因此致残甚至死亡。尽管近年来对AIS的病理生理机制的研究取得重大进展,但仍缺乏改善AIS预后的有效治疗药物。炎性损伤是AIS的发病机制中重要的因素,其过度的表达可以促使AIS损伤进一步恶化和发展。其中,小胶质细胞激活是大脑炎症反应的第一步[2],在神经元存活或损伤的调节中具有重要影响[3,4]。单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)是其中至关重要的趋化因子,其主要由上皮细胞、小胶质细胞等产生,并通过与7个跨膜G蛋白偶联受体 C-C 趋化因子受体 2 (C-C Chemokine Receptor 2,CCR2)结合并激活,向这些靶细胞类型发出信号而产生生物学效应,使其在各种疾病的损伤和感染部位指导单核细胞、小胶质细胞等的迁移和浸润[5]。
姜黄素(curcumin,CUR)是一种从姜黄的植物根茎中提取出来的多酚化合物,因其具有的生物活性繁多,包括抗炎、抗氧化、免疫调节等而饱受关注[6~8]。有研究表明,在dss诱导的结肠炎中,姜黄素抑制dss刺激的巨噬细胞中NLRP3炎症小体的激活,并显著降低了MCP-1及IL-1β、IL-6的表达以及组织病理学损伤,显著改善结肠炎的症状[9]。Sun等[10]的研究发现姜黄素可能通过失活AXL/JAK2/STAT3信号通路抑制小胶质细胞介导的炎症反应,从而改善自身免疫性脑脊髓炎小鼠的症状及严重程度。因此,我们猜想姜黄素是否在AIS模型中通过对MCP-1/CCR2的抑制发挥神经保护作用,故通过建立AIS模型进行研究。
1 材料与方法
1.1 实验动物 健康雄性8~10周龄的C57/BL/6小鼠,体质量18~23 g,购自内蒙古大学动物研究中心,小鼠饲养于室内12 h明暗交替,室温18~23 ℃,标准鼠饲料喂养,自由进食水。
1.2 实验试剂和仪器 超净台(山东博科);Western blot电泳转膜仪器系统(Bio-rad);超声匀浆器(天根);电子天平(奥豪斯);超低温冰箱(松下);电热恒温鼓风干燥箱(上海博讯);恒温水浴锅(上海博讯);低温离心机(艾本德);酶标仪(赛默飞);恒温振荡器(上海世平);转棒疲劳仪(YLS-4C);电凝器(浩航);解剖显微镜(JSZ6-05047272);激光扫描共聚焦显微镜(OLYMPUS FLUOVIEW FV3000)。
姜黄素(购于美国Sigma-Aldrich公司),分子式C21H20O6,纯度大于94%;二甲基亚砜(dimethyl sulfoxide,DMSO)(北京索莱宝科技有限公司);兔MCP-1多克隆抗体(美国Abcom公司);兔CCR2多克隆抗体(英国Biorbyt公司);鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate,GAPDH)多克隆抗体(美国Proteintech公司);Elisa试剂盒(江苏酶免实业有限公司)。
1.3 实验方法
1.3.1 实验分组 雄性C57BL/6小鼠随机分为3组,即假手术组(Sham组)、溶剂对照组(dMCAO组)、姜黄素组(CUR组)。假手术组仅分离颈总动脉且不灼烧大脑中动脉分支;CUR组于术后连续7 d给予姜黄素[200 mg/(kg·d)]腹腔注射;对照组腹腔注射等体积DMSO。
1.3.2 构建dMCAO模型 根据电凝法制作dMCAO动物模型[11],水合氯醛(30 mg/kg)腹腔注射麻醉,腹部朝上固定小鼠。颈部去毛后消毒,于正中部位切开一约1.0 cm切口,将左侧颈总动脉小心仔细的分离,尽量避免出血,并用丝线永久性结扎,缝合颈部切口。然后,将小鼠变化体位,用胶布右侧卧位固定,在耳屏与左侧外眦之间切开皮肤,暴露颞肌,在显微镜下用眼科剪将颞肌剪开,颅骨下隐约能看到右侧大脑中动脉皮质的分支,使用超声颅锥将颅骨钻开一小洞,直径1 mm 左右,完整暴露大脑中动脉皮质分支,随后用电凝笔烧灼血管。
1.3.3 Longa评分 动物模型建立成功后,各组小鼠分别在术后 3 d和 7 d采用改良的Longa 分级法进行行为学评分:0分,无缺陷;1级,不能伸展对侧前肢;2分,对侧前肢屈曲;3分,轻度向对侧转圈;4分,严重向对侧转圈;5分,向对侧跌倒。
1.3.4 转棒实验(rota-rod)评价肢体功能 Rotarod 测试用于评估感觉运动的平衡和协调能力[12]。正式实验开始前将小鼠置于固定速度为4 r/min 的转棒上训练跑轮,以15 min的间隔对小鼠进行连续3 d的训练,每天3次,选择能够保留在转棒上至少60 s的小鼠。正式实验在 dMCAO 手术前1 d开始,将小鼠放置在加速的跑轮仪上,使小鼠在 300 s 的时间内以 4 r/min 到 40 r/min 的旋转速度加速运动。由另一研究者记录每只小鼠从开始试验到从机器上掉落下来的持续时间。将此次转棒持续时间作为AIS前基线水平(baseline)。在 dMCAO 之后的3 d、7 d重复进行 Rotarod 测试,每个测试日以 15 min的间隔对小鼠进行 3 次试验,将3次数据的平均值作为当天的平均转棒持续时间。
1.3.5 2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色法 dMCAO术后7 d,将各组小鼠麻醉后行断头处死,迅速取脑,去除额极,置入-80 ℃冰箱冷冻6 min后取出,连续等距、均匀切取5个冠状脑片,厚度约2.0 mm,置于2%TTC溶液中进行染色,37 ℃恒温孵育15 min。染色后弃去TTC,加入4%多聚甲醛固定24 h。染色后显示为红色区域为正常脑组织,白色区域则为梗死部分脑组织。数码相机拍照,用Image J软件进行图像分析,计算梗死体积:总梗死体积=总梗死面积×脑片的厚度。计算梗死体积百分比:梗死体积百分比(%)=梗死体积百分比(%)={[总梗死体积-(梗死侧半球体积-梗死对侧半球体积)]/梗死对侧半球体积}×100%。
1.3.6 Western blot蛋白质免疫印迹实验 dMCAO术后7 d,假手术组、溶剂对照组及CUR组取AIS核心周围的皮质脑组织,采用BCA蛋白定量法检测蛋白浓度。Western blot方法测定MCP-1、CCR2蛋白表达水平。
1.3.7 免疫荧光实验 dMCAO术后7 d,免疫荧光检测MCP-1/CCR2和IBA1表达:使用多聚甲醛固定脑组织,经蔗糖梯度脱水后经冰冻切片机切成18 μm切片,浸泡在PBS溶液中,用0.3%Triton-PBS室温摇床上漂洗3次,10 min/次;10%山羊血清封闭常温摇床60 min,一抗上孵育过夜,第2天再用0.3%Triton-PBS室温摇床上漂洗3次,10 min/次,避光孵育二抗,室温摇床60 min,后继续避光用0.3%Triton-PBS漂洗3次,将切片捞出平铺在载玻片上,用DAPI染色固定细胞核后封片,4 ℃避光保存,后续在荧光显微镜400倍视野下采集图片使用Image J软件检测。
1.3.8 Elisa dMCAO术后7 d,假手术组、溶剂对照组及CUR组取AIS核心周围的皮质脑组织,采用Elisa法检测IL1β、IL-6、TNF-α表达水平。

2 结 果
2.1 改良Longa评分 在小鼠清醒时采用 Zea-Longa方法进行神经行为学评分。dMCAO组与Sham组相比较,dMCAO组神经行为学评分显著升高(P<0.05)。CUR组与神经行为学组相比较,CUR组神经功能缺损评分有明显下降(P<0.05)(见图1)。

图1 小鼠改良Longa评分统计图
2.2 转棒实验 术前,小鼠在滚轮上的时间无显著差异。术后7 d,与dMCAO组小鼠相比,CUR组小鼠在滚轮上停留的时间均显著提高,dMCAO组为66.13 s±23.62 s,CUR组为90.87 s±15.16 s(P<0.05)(见图2)。
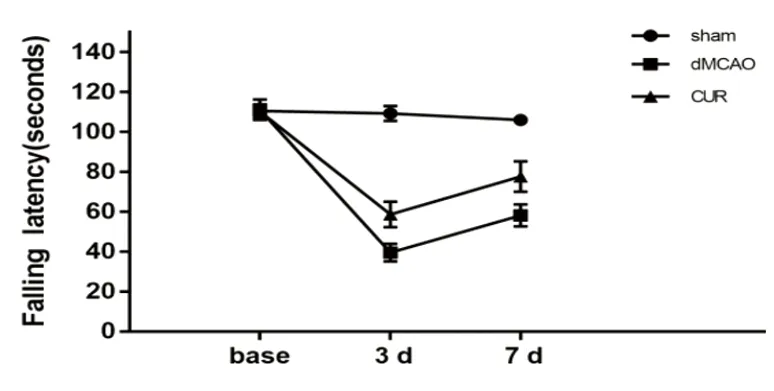
图2 小鼠转棒实验统计图
2.3 小鼠脑组织TTC染色(见图3) 采用TTC染色小鼠脑组织,并统计梗死体积。CUR组小鼠脑组织梗死体积比(33.91%±3.55%)小于dMCAO组(P<0.05)。
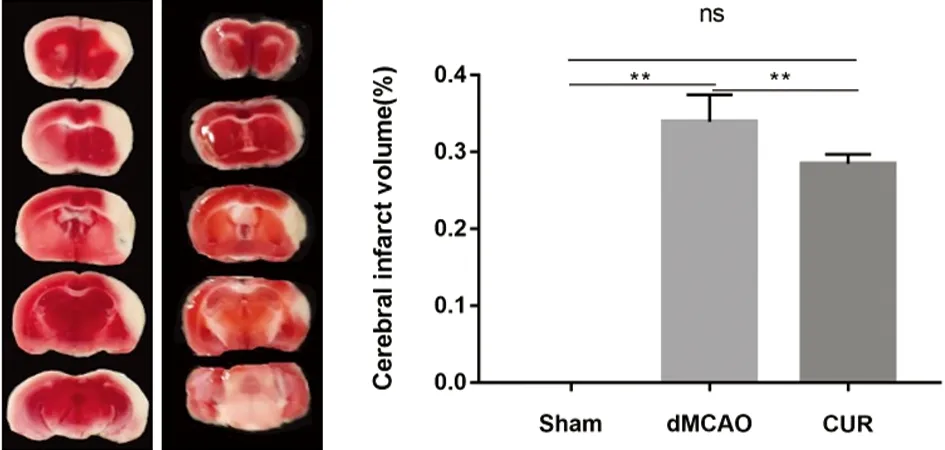
图3 小鼠脑组织TTC染色图、AIS体积比统计图
2.4 Western blot中MCP-1及CCR2表达表达水平的改变(见图4、图5) 与Sham组比较,dMCAO组的MCP-1及CCR2蛋白的表达均明显升高,差异有统计学意义(P<0.05);dMCAO组和CUR组比较,CUR组中 MCP-1及CCR2蛋白的表达均有明显降低,差异有统计学意义(P<0.05)。

图4 MCP-1蛋白表达及统计图

图5 CCR2蛋白表达及统计图
2.5 小鼠脑组织免疫荧光中MCP-1表达水平(见图6) dMCAO组的小胶质细胞及MCP-1蛋白的表达与Sham组相比,均明显升高,差异有统计学意义(P<0.05);dMCAO组和CUR组比较,CUR组中小胶质细胞及MCP-1蛋白的表达均有明显降低,差异有统计学意义(P<0.05)。

图6 MCP-1及IBA1表达图
2.6 炎症因子TNF-α、IL-1β、IL-6表达水平改变 dMCAO组的TNF-α、IL-1β、IL-6表达与Sham组相比,均明显升高,差异有统计学意义(P<0.05);dMCAO组和CUR组比较,CUR组中TNF-α、IL-1β、IL-6的表达均有明显降低,差异有统计学意义(P<0.05)(见表1)。
表1 TNF-α、IL-1β、IL-6表达水平
3 讨 论
AIS是指由可由数种病因导致的一种脑血管疾病,具有发病率高、致残率高等特点,严重危及患者的健康和生命,是世界第二大死因。AIS导致脑血管急性阻塞和血供中断,从而引起局部脑组织缺血、缺氧性坏死,进而出现神经功能障碍产生一系列临床综合征,严重影响患者生活质量[13,14]。
小胶质细胞是中枢神经系统的巨噬细胞,对脑损伤和疾病极其敏感,在维持中枢神经系统稳态中起着重要作用[15]。小胶质细胞在AIS后被激活,并在缺血再灌注损伤产生的炎症反应中发挥主导作用[16],活化的小胶质细胞可产生包括炎症因子(如TNF-α)、一氧化氮(nitricoxide,NO)等在内的多种促炎介质等对脑组织进行产生作用[17]。
单核细胞趋化蛋白-1 (MCP-1/CCL2)是调控单核细胞和小胶质细胞招募和激活的关键趋化因子之一,可以与多种受体结合,但主要通过附着在CCR2的细胞外区域来加强其生物学效应,它们在各种疾病的损伤和感染部位指导单核细胞、小胶质细胞、记忆性T淋巴细胞的迁移和浸润[18]。MCP-1具有促使黏附分子表达的作用,影响受损部分脑组织血供,使脑组织损伤更加严重。MCP-1水平升高与卒中远期风险增加相关[19]。因此,阻断MCP-1/CCR2通路可作为治疗AIS后炎症损伤的一种重要策略。本研究表明,姜黄素显著抑制AIS后MCP-1/CCR2的产生及释放。这些说明姜黄素可能对缺血后的炎症反应具有重要的抑制作用。
姜黄素作为一种抗炎剂,在多种疾病模型中发挥着积极的作用。有研究表明[20],在胶原诱导关节炎小鼠模型中,联合姜黄素和富含维生素D3和Omage3脂肪酸(VO)的饮食显著增强了TNF,IFN-γ和MCP-1的抑制,使疾病严重程度降低80%,并最大限度地延迟疾病的发生和进展。Kar等研究者发现[21],姜黄素和LOXblock-1通过抑制semaphorin-plexin通路减轻炎症过程,改善缺血-再灌注诱导的炎症和急性肾损伤,明显观察到炎症因子,如TNF-α、IL-6和MCP-1的显著降低。除此之外,有报道显示[22],姜黄素在结直肠癌中也发挥重要作用,研究者使用apc突变小鼠(家族性腺瘤性息肉病模型)来评估姜黄素的效果,使用500 ppm的姜黄素处理8周可以抑制肠息肉的发展,并抑制有息肉的肠部分MCP-1和IL-6 mRNA的表达水平。研究者Boarescudeng等[23]评估姜黄素纳米颗粒(CCNP)与传统姜黄素(CC)对异丙肾上腺素(ISO)诱导的大鼠心肌梗死(MI)的影响,研究发现所有剂量的CC和CCNP均可发挥心肌保护作用,其中CCNP的效果最好,且CCNP能更有效地抑制心肌梗死后炎性细胞因子(TNF-α、IL-6、IL-1α、IL-1 β、MCP-1和RANTES)水平的升高,有助于限制心肌梗死后的心脏损伤。因此,我们检测了姜黄素在AIS相关dMCAO小鼠模型中对梗死部分脑组织所产生炎症发生的治疗作用。我们的研究结果表明:(1)姜黄素降低AIS小鼠的神经功能缺损评分,增加脑血流灌注,减小脑梗死体积;(2)这些功能的改善与小胶质细胞的活化的减少,MCP-1/CCR2及炎症因子TNF-α、IL-1β、IL-6表达的水平降低有关。
综上所述,本结果显示了姜黄素对AIS的保护作用。在AIS模型中,姜黄素对AIS脑组织损伤的保护作用可能是通过降低小胶质细胞活化至减低MCP-1/CCR2的表达,下调炎症因子的水平实现的,本实验的数据也表明,姜黄素可能是一种治疗急性缺血性卒中的有效药物,但是我们的研究有一定的局限性,虽然已经提出一些数据表明姜黄素的疗效,还需要更多的剂量反应的详细研究,以及姜黄素是否通过其它途径起到脑保护作用,还需进一步研究。

