生酮饮食治疗婴幼儿发育性癫痫性脑病的效果分析
秦霞霞,樊海珍,韩 虹,武运红,周 娜
(1.山西医科大学,山西 太原 030000;2.山西省儿童医院神经内科,山西 太原 030000)
癫痫性脑病(epileptic encephalopathy,EE)是指癫痫活动本身对于认知、行为等脑功能的影响超过了潜在病因单独所带来的影响,表现为行为、认知、运动功能的发育停滞及减慢或倒退,脑功能障碍可随癫痫活动的减轻而改善。EE从新生儿期到儿童期均可发生,但以脑发育期为主[1]。发育性脑病是指发育迟缓或智力残疾,虽然残疾的程度随着年龄的增长变得更加明显,但其代表的是静态残疾。发育性脑病患儿患癫痫的风险高于一般人群,但这并不意味着其患有EE[2]。2010年国际抗癫痫联盟(International League Against Epilepsy,ILAE)分类方案中的“癫痫性脑病”一词在2017年正式修订时修改为“发育性癫痫性脑病(developmental epileptic encephalopathy,DEE)”,这一改变是因为许多导致EE的基因被认为独立地对发育产生不利影响[3]。DEE相关的癫痫综合征主要包括大田原综合征(ohtahara syndrome,OS)、婴儿癫痫伴游走性局灶性发作(epilepsy of infancy with migrating focal seizures,EIMFS)、婴儿痉挛症(infantile spasm,IS)、Lennox-Gastaut综合征、Doose综合征、婴儿严重肌阵挛癫痫(Dravet综合征)等。有些基因突变既可导致严重的癫痫样活动,也可影响脑发育,如KCNQ2、SCN2A、STXBP1和CDKL5相关的癫痫[2]。临床治疗DEE以控制癫痫发作的药物(anti-seizure medications,ASMs)为主,但对部分患儿仍无法有效控制癫痫发作[4]。生酮饮食(ketogenic diet,KD)是一种低碳水化合物、高脂肪、适当蛋白质和其他营养素的配方饮食。越来越多的证据支持KD在治疗DEE中的有效性、安全性及可行性,此外,可改善患儿的认知行为状况及生活质量[5]。本研究旨在探讨KD治疗婴幼儿DEE的有效性和安全性。
1 研究对象与方法
1.1 研究对象
回顾性选取2018年2月至2022年2月在山西省儿童医院神经内科门诊行KD治疗的42例DEE患儿为研究对象,其中男24例,女18例;年龄为3~36个月,平均(21.00±10.72)个月;病程为2~33个月,平均(14.66±8.09)个月。疾病类型:IS为19例,Dravet综合征9例,OS为2例,EIMFS为1例,葡萄糖转运蛋白1缺乏症(glucose transporter 1 deficiency syndrome,Glut-1DS)1例,其他DEE为10例;其中24例有明确致病基因(SCN1A有9例、SCN2A有7例、CDKL5有2例、SLC2A1有2例、STXBP1有1例、ATP6V1A有1例、14号染色体片段重复1例、KCNT1有1例),6例有癫痫家族史/个人史(妈妈患癫痫2例、爷爷患癫痫1例、早产儿脑损伤病史2例、新生儿缺氧缺血性脑病史1例),9例头颅核磁异常(脑室周围白质软化3例、脑外间隙增宽2例、脱髓鞘改变2例、脑萎缩1例、广泛性皮质损伤1例),13例入组前行促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)治疗(2IU/kg有8例、3IU/kg有5例)。
本研究经山西省儿童医院伦理委员会审批(伦理批号:IRB-KYYN-2021-002)。
1.2 纳入、排除及退出标准
1.2.1 纳入标准
①符合国际抗癫痫联盟2017年诊断标准[3],确诊为DEE患儿;②年龄≤3岁,性别不限;③入组前至少给予2种及以上ASMs治疗,疗程至少3个月,达到最大耐受剂量仍不能控制发作,同时未接受过KD治疗;④均不适合手术治疗或患儿监护人不愿接受手术治疗;⑤患儿监护人不接受神经调控治疗;⑥监护人同意进行KD治疗并签署同意书。
1.2.2 排除标准
①患有严重消化系统、呼吸系统、心血管系统、免疫系统等严重疾病;②存在KD治疗禁忌症:脂肪酸代谢障碍和生物氧化异常的相关代谢性疾病,不能耐受高酮饮食,生长迟缓等。
1.2.3 退出标准
①患儿或监护人对KD疗法依从性差,无法继续坚持者;②主管医生及营养师认为患儿不适合继续坚持治疗者;③中途添加其他抗癫痫治疗方案者(神经调控疗法、手术治疗)。
1.3 方法
1.3.1 治疗方法
根据入组患儿实际情况选择丙戊酸钠、拉莫三嗪、左乙拉西坦、托吡酯、奥卡西平、氯硝西泮等ASMs及ACTH进行常规控制癫痫发作治疗,在此基础上加用经典KD方案。
1.3.2 KD的配置
采用经典KD方案,脂肪∶(蛋白质+碳水化合物)=4∶1。①确定能量:营养师根据患儿活动量、身高、体重、年龄、环境温度等因素选取能量,一般情况下,符合理想身高和体重需要能量的75%~85%即可保持最佳的发作控制状态,以及维持生长发育所需的营养要求。第1天提供每日总热量的1/3,第2天提供2/3,第3天全量供给。②确定KD起始比例:一般为1.5∶1~2∶1,可根据患儿年龄及耐受情况逐渐调整至3∶1~4∶1,制定个体化的KD方案,使血酮维持在3~5mmol/L,血糖维持在4~5mmol/L之间。③确定蛋白质需要量:参照世界卫生组织和美国政府推荐的蛋白质需要量来计算[6]。④确定营养补充剂服用量:治疗期间,根据患儿的营养状况适当补充不含乳糖、蔗糖等的钙剂,以及多种微量元素、复合维生素、枸橼酸钾等,有肉碱缺乏者及时口服左卡尼汀。
1.3.3 KD的管理
①治疗前,完善血尿便常规、血生化分析、血氨、乳酸、丙酮酸,以及心电图、腹部及泌尿系统彩超、发育商(development quotient,DQ)评估、4h视频脑电图(video electroencephalogram,VEEG)、血尿串联质谱分析等检查,排除治疗禁忌症,如肉毒碱缺乏症、卟啉病、β-氧化缺乏症等。②营养师制定个体化KD配餐,并定期进行相关知识的健康教育,使监护人掌握KD疗效记录方法(包括血糖、血酮值,癫痫发作的形式和次数及耐受情况等)。③KD治疗时1个月内不调整原有ASMs种类和剂量。④需定期复查及随访,营养师在KD治疗的第1个月对患儿进行每日随访,监测患儿的血酮、血糖值,同时注意不良反应;医生及营养师每月月末对患儿进行1次随访,并在KD添加的1、3、6、12个月时对患儿进行门诊常规随访,复查血常规、血生化分析、腹部彩超等。计划所有患儿均接受为期12个月的治疗干预。
1.4 观察指标
1.4.1 癫痫的控制
开始KD前,记录患儿前3个月内平均每月癫痫发作次数,并将其作为基线值(a)。随访记录治疗1、3、6、12个月各时间点平均每月癫痫发作次数(b),与治疗前进行比较,确定疗效等级。
癫痫发作减少率=[(a-b)/a]×100%[7-8]。
Ⅰ级:完全控制,完全无癫痫发作;Ⅱ级:显著控制,癫痫发作减少≥75%;Ⅲ级:控制,癫痫发作减少≥50%~ <75%;Ⅳ级:无效控制,癫痫发作减少<50%。Ⅰ、Ⅱ、Ⅲ级为有效,Ⅳ为无效。
癫痫控制有效率=(Ⅰ级例数+Ⅱ级例数+Ⅲ级例数)/总例数×100%。
1.4.2 脑电图的改善
记录治疗前,治疗3、6、12个月时的脑电图变化(4h VEEG)情况。
①控制:癫痫放电频率减少≥90%;②显著改善:癫痫放电频率减少≥75%~<90%;③改善:癫痫放电频率减少≥50%~<75%;④未改善:癫痫放电频率减少<50%。
脑电图好转率=(控制例数+显著改善例数+改善例数)/总病例数×100%[9-10]。
1.4.3 认知及行为的改善
采用Gesell发育量表,记录治疗前及治疗后6、12个月时的总DQ分,以及适应性、大运动、精细动作、语言、个人-社交五大能区的DQ分,DQ分数越高,说明认知及行为改善越明显,对比治疗前后DQ分的变化。
1.4.4 KD治疗的依从性及安全性
分别统计KD治疗1、3、6、12个月月末坚持治疗的人数,计算上述不同时间点的治疗保留率,并分析患儿治疗终止的原因;监测KD治疗期间的不良反应。
治疗保留率=各个时间点坚持KD治疗人数/KD治疗启动时人数×100%
1.5 统计学方法

2 结果
2.1 癫痫的控制情况
在42例DEE患儿中,KD治疗前,有24例应用2种ASMs,有18例应用2种以上ASMs;KD治疗3个月时,有23例减少了1种ASMs;KD治疗6个月时,有19例减少了1种ASMs,有9例减少了2种及以上ASMs;KD治疗12个月时,有12例减少了1种ASMs,有13例减少了2种及以上ASMs。
本次共入组IS患儿19例,其中有13例ACTH治疗失败,KD治疗1、3、6、12个月时,癫痫无发作率分别为10.5%(2/19)、15.8%(3/19)、15.8%(3/19)、26.3%(5/19),总体治疗有效率分别为47.4%(9/19)、63.2%(12/19)、57.9%(11/19)、47.4%(9/19)。
本次共入组Dravet综合征9例,KD治疗1、3、6、12个月时,癫痫无发作率分别为11.1%(1/9)、22.2%(2/9)、11.1%(1/9)、22.2%(2/9),总体治疗有效率分别为33.3%(3/9)、55.6%(5/9)、33.3%(3/9)、44.4%(4/9)。
在42例患儿中,KD治疗1、3、6、12个月时,癫痫无发作率分别为14.3%、16.7%、19.0%、23.8%,癫痫控制有效率分别为47.6%、76.2%、66.7%、59.5%,见表1。治疗后1、3、6、12个月时的癫痫控制有效率比较差异有统计学意义(χ2=17.542,P<0.05)。
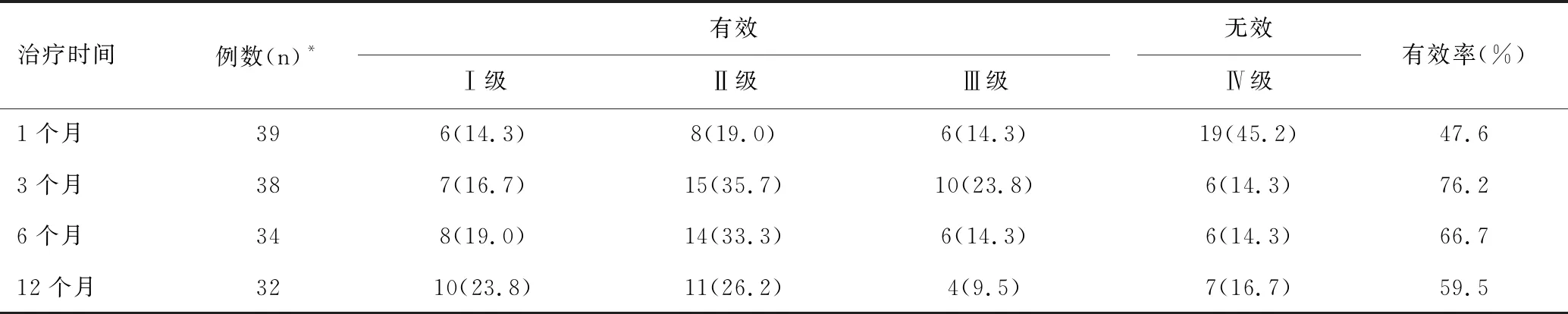
表1 KD治疗后各时间点的癫痫控制有效率 [n(%)]
2.2 脑电图的改善情况
在42例患儿中,KD治疗3、6、12个月时,患儿脑电图好转率分别为38.1%、47.6%、57.1%,经比较差异有统计学意义(χ2=17.243,P<0.05),见表2。

表2 KD治疗后各时间点的脑电图好转率 [n(%)]
2.3 认知及行为的改善情况
在42例患儿中,共有32例完成了12个月的KD治疗,并且完善了DQ测试,治疗12个月时的五大能区及总DQ分均明显高于治疗6个月时和治疗前,经比较差异均有统计学意义(P<0.05),见表3。

表3 KD治疗前及治疗后6、12个月时五大能区及总DQ分的比较
2.4 KD治疗保留率及终止治疗原因
在42例患儿中,KD治疗1个月时有3例患儿退出,治疗保留率为92.9%(39/42例);治疗3个月时有1例退出,治疗保留率为90.5%(38/42例);治疗6个月时有4例退出,治疗保留率为81.0%(34/42例);治疗12个月时有2例退出,治疗保留率为76.2%(32/42例)。在退出治疗的10例患儿中,有4例(40.0%)因家长依从性差退出治疗,3例(30.0%)因疗效差退出治疗,1例(10.0%)因严重拒食退出治疗,1例(10.0%)因过敏经评估后建议退出治疗,1例(10.0%)因经济原因退出治疗。
2.5 不良反应分析
在42例患儿中,有16例发生了不同程度的不良反应,占38.1%,主要发生在KD治疗的前3个月内;其中4例(25.0%)便秘,3例(18.8%)腹泻,2例(12.5%)嗜睡,2例(12.5%)呕吐,2例(12.5%)拒食,2例(12.5%)高脂血症,1例(6.3%)低蛋白血症。经过积极调整饮食等对症处理后患儿逐渐耐受,有15例患儿于不良反应发生1~2周后得到改善,1例因严重拒食而终止KD治疗。
3 讨论
3.1 KD与DEE患儿的关系
3岁内首次癫痫发作的患儿有40%为DEE,其中30%~50%严重神经精神发育障碍患儿存在癫痫相关基因变异[11]。有研究显示,婴幼儿DEE发病高峰年龄为1岁以内(76%),IS及Dravet综合征为最主要的类型,临床发作形式多样,伴精神运动发育迟滞或倒退,药物控制效果不佳,需多种药物联合进行治疗[12]。KD是低碳水化合物和高脂肪饮食方案,脂肪代谢产物酮体包括丙酮、乙酰乙酸和β-羟丁酸,可透过血脑屏障,成为大脑的主要能量来源,减少了葡萄糖作为能量的供应,因此可模拟人体对饥饿的反应,从而用于治疗DEE[13]。DEE同时可共患其他疾病,如运动障碍、孤独症谱系障碍等,因此,治疗的目的不仅是可以控制癫痫发作,还可改善认知功能及相关的共病,促进其发育[14]。目前KD有效控制癫痫发作及改善认知的作用机制尚未完全阐释清楚,可能与阻滞离子通道、神经递质表达变化、增加海马中线粒体的能量、肠道微生物群的改变、促炎和抗炎介质的改变等有关[15-17]。
3.2 KD与IS患儿的关系
IS是婴幼儿期最常见的DEE,推荐用于IS的一线治疗方案包括ACTH、氨己烯酸(vigabatrin,VGB)和口服糖皮质激素,但是ACTH停药后复发率可高达66%,且可能导致高血压、睡眠周期紊乱、可逆性脑萎缩等严重副作用[18]。因此建议将VGB作为与结节性硬化相关IS的一线治疗方案,但对于非结节性硬化的IS效果不如ACTH。有研究显示,当VGB治疗延长至6个月以上时,有21%~34%的婴儿引起了不可逆的视野缺损[19]。口服糖皮质激素会引起高血压、免疫抑制、感染等副作用,同时其最佳用法、用量及疗程仍存在较大争议[20]。2018年国际KD小组最新建议中提出,KD对IS婴儿非常有益,尤其是对ACTH治疗失败的婴儿[21]。一项前瞻性对照研究显示,KD治疗16周,癫痫发作完全控制占10.9%,发作减少>50%占40.7%[22]。Hong等[23]研究了104例IS患儿,KD治疗3、6、12、24个月后,癫痫无发作分别为19、29、31、34例,治疗总有效率分别为63%、64%、77%、77%。2022年的一项回顾性研究表明,KD治疗1、3、6、12个月时,癫痫无发作率分别为6.9%、11.6%、16.0%、16.8%,治疗有效率分别为44.7%、62.8%、49.1%、32.0%[24]。本研究的癫痫无发作率和治疗有效率与上述研究基本相似。
3.3 KD与Dravet综合征患儿的关系
Dravet综合征是婴儿期常见的DEE,早期通常由发热诱发,随着婴儿年龄的增长,部分出现无热性癫痫发作,发病率为1/22万[25]。有研究显示,85%的Dravet综合征患儿为SCN1A基因突变,是最典型的SCN1A相关DEE,且大多数为新生剪切突变,少数为错义突变[12,25]。本研究中9例Dravet综合征患儿,有7例为SCN1A基因突变,2例为SCN2A基因突变。一项研究评估26例Dravet综合征患儿在3、6、12个月的KD治疗有效率分别为38.4%、34.6%、38.4%[26]。另有研究显示,KD治疗3、6个月时癫痫无发作率分别为30.0%、58.8%,癫痫发作减少率>50%者分别为55.0%、41.2%[27]。刘家雯等[28]研究显示,治疗3、6、12个月时,癫痫无发作率分别为20%、43%、67%,治疗有效率分别为67%、86%、92%。本研究主要结果与之相似。
3.4 KD与癫痫患儿脑电图的关系
KD治疗不仅可以减少癫痫的发作,而且可以减少发作间期放电,治疗时间越久,EEG背景节律改善越明显[21]。一项临床前瞻性研究发现,KD治疗1、3个月时,患儿脑电图好转率分别为30.8%、38.5%[29]。李保敏等[30]研究显示,31例DEE患儿经KD治疗1、3个月后,分别有10、24例背景节律改善明显。本研究与上述研究结果相似。随着KD治疗时间的延长,脑电图好转率逐步提高,并且伴随背景节律改善。同时,在本研究中观察到癫痫控制情况与脑电图好转情况不完全一致,癫痫发作完全控制的患儿脑电图可表现为控制、显著改善及改善。
大量研究证实,KD有保护神经的作用,可能与增加脑源性神经营养因子的表达、扩大能量储备、并通过稳定神经元动作电位缓解线粒体功能障碍等有关[31-32]。杨洋等[10]经对比研究发现,KD治疗组患儿在大运动、精细动作、语言、适应性、个人-社交等五大能区DQ分明显提高。一项多中心前瞻性对照研究提示,KD组29.4%的患者神经发育得到改善[22]。本研究显示,治疗后患儿的DQ分均高于治疗前,五大能区DQ分均有提高,尤其在适应性、语言、个人-社交3个能区改善明显。
3.5 KD治疗保留率及终止治疗原因分析
本研究KD各治疗时间点的患儿治疗保留率均稍高于其他研究[18,24,31],可能的原因:①近年来对KD的不断推广,使医生、营养师及家长对其认识不断加深,家长的依从性逐渐增加;②营养师为患儿制定了个性化食谱,治疗保留率相应提高。有研究表明,影响KD治疗保留率的最重要因素是父母的努力和耐心,许多家长因为未达到预期疗效,加之KD的限制,使其很难坚持治疗,从而终止KD[33-35]。未来应着重研发更多口感好、配制简便及价格便宜的KD产品,使家长及患儿更易接受。本研究中有16例患儿发生了不同程度的不良反应,包括便秘、腹泻、嗜睡等,主要发生在KD治疗的前3个月内,经过积极对症处理,大多于不良反应发生的1~2周后得到改善,与其他研究[36-38]结果相似。KD总体是安全的,不良反应一般轻微,大多可通过适当的饮食调整使其避免或缓解,很少因此终止KD治疗。
综上所述,KD对婴幼儿DEE是一种安全、有效的控制癫痫发作的治疗方法,随着治疗时间的延长,可不同程度地改善患儿的认知功能,同时脑电图放电频率明显减少。近年来,随着KD的不断发展,KD产品种类多样,非禁食门诊启动也被证实安全、有效,但目前其作用机制仍不明确,需要更多研究进一步探究其机制,未来希望更多DEE患儿从中获益。

