鹅星状病毒Ⅰ型荧光定量PCR检测方法的建立及应用
谢 军,张 硕,王安平,吴 植,吴 双,朱善元
(江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室 江苏现代畜牧与新兽药工程技术中心,泰州 225300)
近年来,我国华北、华中、华南等多地区鹅厂暴发了一种以关节型和内脏型尿酸盐沉积为主要特征的致死性传染病因尿酸盐沉积现象,民间将其称为痛风病[1-2]。该病主要侵害5~20日龄的雏鹅,死亡率可高达50%,对我国养殖业经济发展造成了严重的威胁[3]。造成鹅痛风的原因有很多,饲料蛋白水平不均衡,饲养环境不佳、肠道菌群失衡或星状病毒感染等多种原因均可出现雏鹅痛风现象[4-5]。但是在一些饲喂合理、环境温暖、干燥、保温性能好,空气流通通畅,养殖密度合适的鹅厂依然会出现痛风现象,因此怀疑此种痛风是由一种病原感染引起的[6-7]。
鹅痛风给鹅养殖业带来了巨大的经济损失。2017年,刁有祥教授[7]首次揭示了引起鹅痛风的病原体为鹅星状病毒(Goose Astrovirus,GAstV)。GAstV属于无囊膜的正链单股RNA病毒,基因组全长为6.9~7.9 kb[8-9]。在电子显微镜下可以观察到鹅星状病毒表面有5~6个突起,结构呈星形,故称之为星状病毒。目前,GAstV全基因组序列分析表明,GAstV具有两种不同的基因型,即GAstV-1和GAstV-2。GAstV-2已从鹅痛风组织中被成功分离出来,而雏鹅回归实验亦证明其能引起鹅痛风[10]。
2016年,我国大部分商品鹅群中暴发了以内脏和关节尿酸盐沉积为主要特征的致死性传染病,姜晓宁等[11-12]研究发现,鹅痛风的病原为GAstVs[11-12]。2017年,首次报道第一株GAstV FLX全基因组序,基因组全长7299 nt[6,13]。之后另有几株GAstVs相继被测序或分离,如HN1G[12]、SDPY[11]、CXZ/18[14]、SD01[11]、GD[15]。然而,基因组同源性分析显示,后续测序的GAstVs毒株与FLX株同源性均不到60%,遗传进化分析也表明这些毒株遗传进化关系与FLX株相距较远,说明我国鹅群中存在不同基因型GAstV,李盈等[16]建议将FLX类毒株命名为1型鹅星状病毒(GAstV-1),SD01类毒株命名为2型鹅星状病毒(GAstV-2),又被称为新型鹅星状病毒。
迄今为止尚无疫苗可以有效治疗鹅痛风病。部分养殖场尝试采用自免血清进行病鹅紧急治疗,然而效果也不理想。从当前情况可知,针对鹅痛风病,养殖商品鹅过程中除了通过疫苗、抗体加强进行免疫保护外,更需要通过建立一种快速、灵敏、有效的鹅星状病毒检测方法,以在鹅痛风病早期进行疫病的预防性检测和临床监测。王安平等[6]将宏基因组学应用于鹅痛风病的诊断中,但该方法成本较高、操作步骤复杂等原因不适用于规模化检测[6]。李阳等[17-18]发现,可利用RT-PCR/一步法RT-PCR进行鹅痛风病病原检测,然而RT-PCR检测方法灵敏度低,无法对检测样品进行定量分析。荧光定量PCR技术因其灵敏度高、耗时短、操作简便,同时弥补了常规PCR技术无法定量分析的缺点,现被广泛使用于临床样品的检测[19-20]。
为此,本研究使用MegAlign软件比对TZ03(GenBank登录号:MW353015)和NCBI下载序列,选取GAstV-1 ORF1b高度保守区内RdRp基因序列设计了一对特异性引物和探针。通过构建重组质粒pET30a-ORF1b,建立了用于检测GAstV-1的TaqMan荧光定量PCR检测方法,以期促进鹅星状病毒病的临床快速诊断,进一步推动星状病毒的感染防制工作。
1 材料与方法
1.1 病毒及其他病原菌 鹅Ⅰ型星状病毒TZ03毒株为江苏省兽用生物制药高技术研究重点实验室于2019年从江苏地区鹅场呈现出明显痛风症状的病鹅肝脏、脾脏、肾脏等组织分离获得,暂命名为GAstV/CHN/TZ03/2019;新城疫病毒(Newcastle disease virus,NDV)La Sota 疫苗株由扬州大学刘秀梵院士惠赠,鹅细小病毒(Goose parvovirus,GPV)SYG41-50疫苗株和番鸭细小病毒(Muscovy duck parvovlrus,MDPV)P1 疫苗株分别购自扬州威克生物工程有限公司和青岛易邦生物工程有限公司,鸭坦布苏病毒(Duck Tembusu virus,DTMUV)(Duck/JiangSu/24/2018)和禽流感病毒(Avian influenza virus,AIV)H9N2亚型(Duck/XuZhou/515/2018)由中国农业科学院上海兽医研究所丁铲研究员惠赠;鹅圆环病毒(Goose circovirus,GoCV)(Goose/Jiangsu/02/2019)、鹅源大肠杆菌APECYE2-1-1(Goose/Taizhou/2019)、鸭疫里默氏杆菌(Duck/Jiangsu/08/2019)等由江苏省兽用生物制药高技术研究重点实验室自行分离、保存。
1.2 试剂与仪器 Magbead Viral DNA/RNA Kit磁珠核酸提取试剂盒购自江苏康为世纪(中国)有限公司;AxyPrep DNA凝胶回收试剂盒、质粒小量制备试剂盒均购自康宁生命科学(吴江)有限公司;PremixTaqDNA预混酶、Prime Script RT Master Mix反转录试剂盒和无菌超纯水购自宝生物工程(大连)有限公司;细菌基因组DNA提取试剂盒(DP302)购自天根生化科技(北京)有限公司;QuantStudio 3实时荧光定量PCR仪器购自美国应用生物系统公司(Applied Biosystems);Qubit 4.0核酸定量仪荧光、Thermo Scientific KingFisher Flex全自动磁珠提取纯化系统计购自赛默飞世尔科技公司。
1.3 引物设计与合成 于GenBank数据库中下载Goose astrovirus基因序列,使用MegAlign软件比对序列后,选取GAstV-1 ORF1b高度保守区内RdRp基因(GenBank登录号:MW353015),使用Applied Biosystems Q3荧光定量仪配套软件Primer Express Software Version 3.0设计引物和探针,以及用作质粒标准品构建的一对引物(表1)。引物和探针均由英潍捷基(上海)有限公司合成。
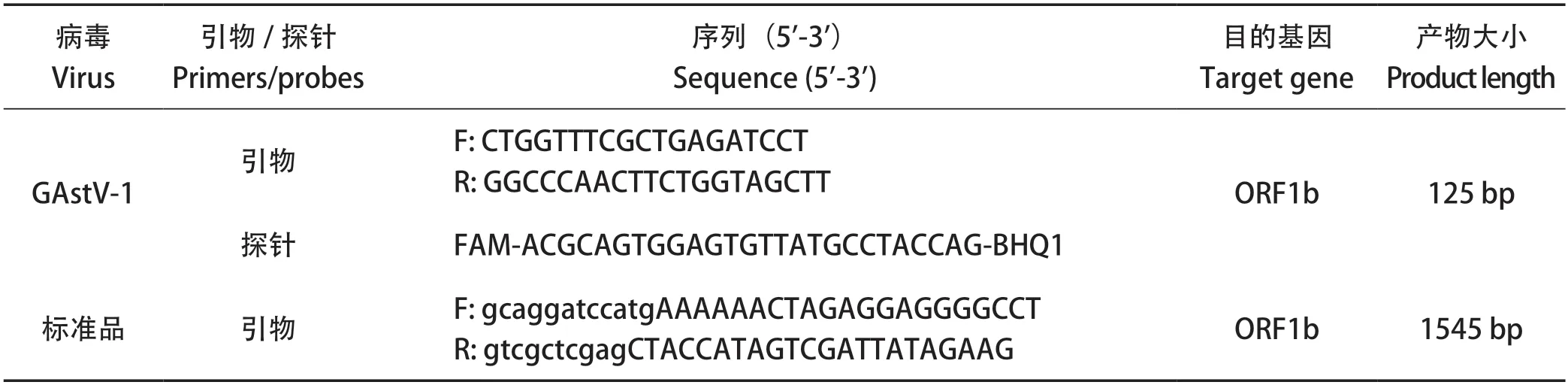
表1 qPCR引物及探针序列Table 1 Primers and probes designed for qPCR
1.4 标准品的构建 选取GAstV-TZ03 cDNA作为扩增模板,PCR扩增体系(50 μL)为:PremixTaq(TaKaRaTaqVersion 2.0 plus dye)25 μL,上、下游引物各2 μL,cDNA模板1 μL,ddH2O 20 μL。反应程序为:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,共35个循环;72℃再延伸10 min;12℃保存。PCR产物经过凝胶电泳分离后,参照凝胶回收试剂盒说明书收集核酸,将其与克隆载体pET-30a连接,转化后将PCR条带大小正确的阳性克隆菌送至英潍捷基(上海)有限公司进行测序,测序结果与NCBI上已发布的序列进行比对,将正确重组质粒pET30a-ORF1b作为该检测方法的标准品。使用Qubit 4.0核酸定量仪荧光计对重组质粒测定浓度。使用以下公式计算重组质粒的拷贝数:拷贝数=(6.02×1023)×(质粒浓度×10-9)/(质粒长度×660)
1.5 核酸提取 取GAstV-1 (TZ03)、NDV (La Sota)、AIV-H9、DTMUV尿囊液,GoCV组织碾磨液,GPV、MDPV疫苗稀释液,使用Thermo Scientific KingFisher Flex全自动磁珠提取纯化系统进行核酸提取,提取的DNA置于-20℃低温保存,因GAstV-1、NDV和AIV-H9病毒为RNA病毒,参照试剂盒对提取RNA进行反转录cDNA置于-20℃保存;细菌参照细菌DNA提取试剂盒,获得的DNA置于-20℃保存。
1.6 荧光定量PCR方法的建立及优化 反应体系(20 μL)为:2× Premix ExTaq(Probe qPCR) 10 μL,50× ROX Reference Dye 0.4 μL,DNA/cDNA模板1 μL,上、下游引物和探针(10 μmol/L),其余ddH2O补足20 μL。使用方阵试验,摸索退火温度、引物和探针浓度等条件以筛选出最佳反应体系,即引物和探针终浓度为0.1、0.2、0.3、0.4、0.5、0.6 μmol/L;退火/延伸温度为57℃、58℃、59℃、60℃、61℃、62℃、63℃不断优化以获得更好的反应结果。反应条件为:95℃预变性30 s;95℃退火10 s,退火/延伸40 s,扩增40个循环后收集荧光信号,用于结果的判定。
1.7 标准曲线的建立 取鹅星状病毒重组质粒标准品,加入ddH2O进行10倍系列梯度稀释,最终浓度为1×101~1×107copies/μL,按照“1.6”中反应体系和条件进行操作,绘制TaqMan qPCR方法的标准曲线。每个浓度梯度实验设3个重复,并采用ddH2O作为阴性对照。
1.8 特异性实验 为检测qPCR实验结果的特异性,使用病毒核酸提取试剂盒分别提取 MDRV、DTMUV、MDPV、AIV(H9N2)、GPV、DuCV病毒RNA,并将RNA反转录为 DNA;使用细菌基因组提取试剂盒提取大肠杆菌、鸭疫里默氏杆菌基因组DNA,以DNA为模板,验证该方法的特异性。
1.9 敏感性实验 按1×101~1×105copies/μL对重组质粒标准品进行倍比稀释,以优化后反应体系和条件进行稀释浓度的最低限度检测,验证该方法的灵敏性。使用RT-PCR进行灵敏度比对性检测。
1.10 重复性试验 为验证qPCR实验结果的可重复性,使用10倍梯度稀释为104~106copies/μL的混合标准质粒来分析组内及组间变异。在相同的条件下在同一个96孔板上做3个重复,测定组内变异系数;分3个时间段就同一批样品进行重复检测,批次样品单次检测时设定3个重复组,进行组间变异系数测定。
1.11 临床样品的检测 对依托江苏省兽用生物制药高技术研究重点实验室和江苏现代农业(水禽)产业技术体系集成创新中心,经过NGS测序后的13份已知背景的田间临床样品进行验证。
2 结果
2.1 目的基因的扩增 以 GAstV-1(TZ03) cDNA为模板进行常规 PCR 扩增,获得 GAstV-1 的ORF1b基因片段(1542 bp),片段大小与目的片段一致(图1)。经胶回收、连接、转化、阳性克隆菌扩增及质粒提取,阳性菌测序结果与预期一致,表明成功建立重组质粒标准品并命名为pET30a-ORF1b。
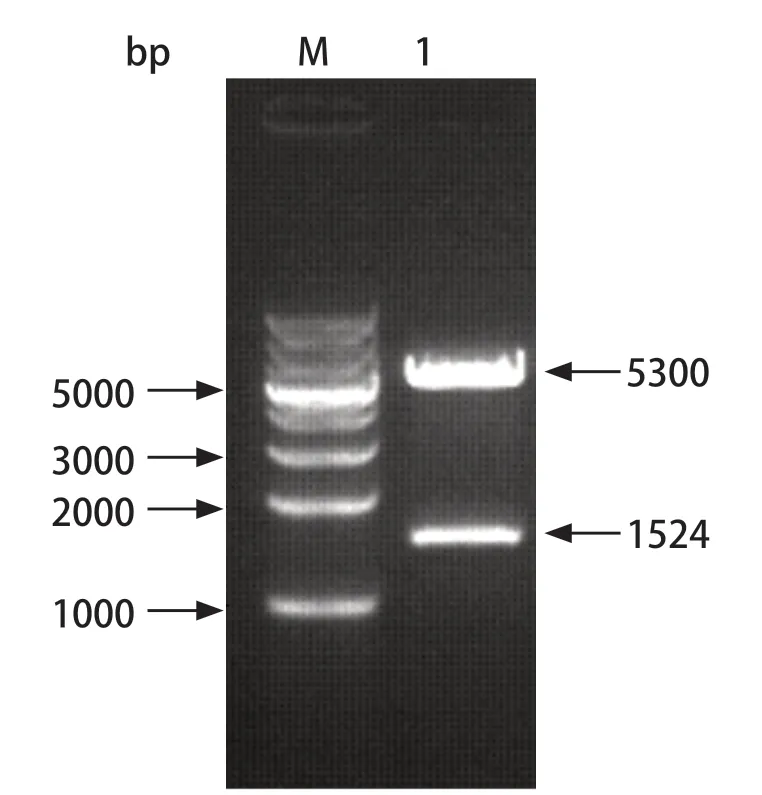
图1 pET30a-ORF1b酶切鉴定Fig.1 Identification of the recombinant plasmid pET30a-ORF1b by restriction enzymes digestion
2.2 TaqMan qPCR 标准曲线建立 将重组质粒梯度稀释,制备成1×102~1×107copies/μL的重组质粒标准品。根据优化的反应体系和条件绘制qPCR的标准曲线。结果显示,GAstV-1病毒可得到具有良好的相关系数及扩增效率的标准曲线,R2=0.998,E=99.6%(图2)。
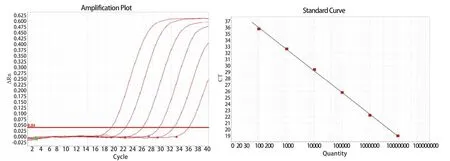
图2 GAstv-1 qPCR 扩增曲线及标准曲线Fig.2 Amplification curve and standard curve of single qPCR for GAstv-1 E =99.6%,R2 =0.998 ,Slope = -3.394,Y-Inter = 39.812
2.3 TaqMan qPCR特异性试验 以TZ03的cDNA作为阳性对照,ddH2O作为阴性对照,对NDV、GPV、MDPV、DTMUV、AIV-H9、GoCV、鹅源大肠杆菌、鸭疫里默氏杆菌的DNA/cDNA 进行特异性检测。结果显示,除阳性对照组,其余6种病毒、2种细菌和阴性对照组均未检测到荧光信号(图3)。建立的qPCR方法在不同病原的检测结果中具有良好的特异性。
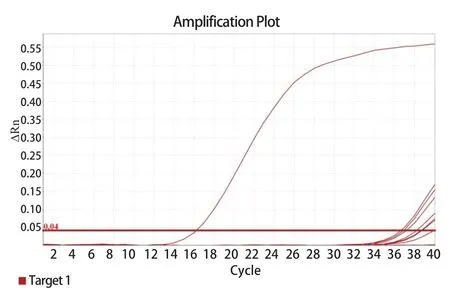
图3 GAstv-1 qPCR 特异性检测Fig.3 Specific detection of single qPCR for GAstV-1
2.4 TaqMan qPCR灵敏度试验 重组质粒标准品按1×101~1×105copies/μL进行倍比稀释,并以上一步骤优化条件进行qPCR检测。结果显示:GAstV-1的qPCR的灵敏度约为10 copies/μL,阴性对照无扩增。而常规PCR灵敏度检测结果:灵敏度近1000 copies/μL(图4~5)。由此表明,GAstV-1病毒的qPCR检测方法具有较高灵敏度,且较常规PCR高100倍左右。
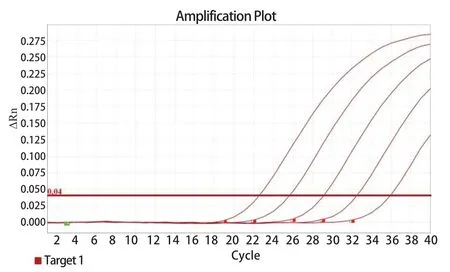
图4 GAstV-1 qPCR灵敏度检测Fig.4 Sensitivity detection of single qPCR for GAstV-1
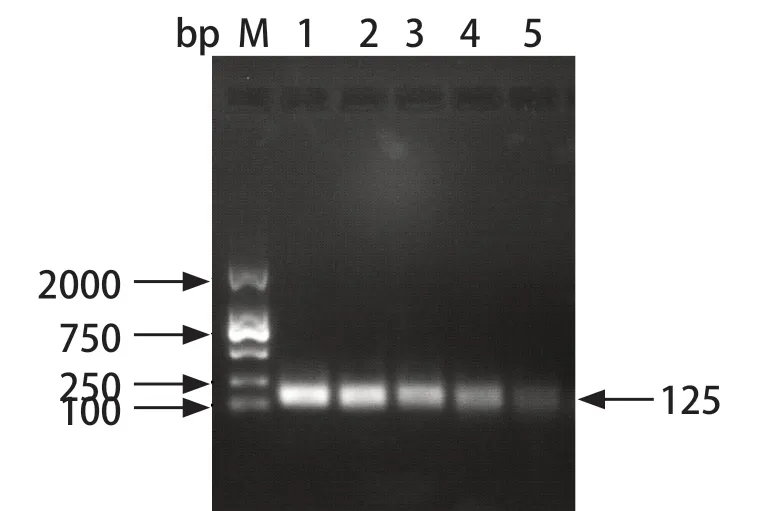
图5 GAstV-1 PCR 灵敏度检测Fig.5 Sensitivity detection of single PCR for GAstV-1
2.5 TaqMan qPCR 重复性试验 利用构建的荧光定量PCR法对不同批次不同浓度的重组质粒标准品进行检测。结果显示,GAstV-1 TZ03株组内变异系数为0.10%~0.34%,组间变异系数为0.28%~0.60%(表2)。

表2 qPCR法组内、组间重复性试验结果Table 3 Results of repeatability test within and between single qPCR groups
2.6 临床样品检测 依托江苏省兽用生物制药高技术研究重点实验室和江苏现代农业(水禽)产业技术体系集成创新中心,提供13份已知背景的田间临床样品对建立的检测方法进行验证。利用构建的荧光定量PCR法检测出13份田间临床样品的阳性,0份田间临床样品为阴性,与13份田间临床样品的已知背景情况相符。
3 讨论
我国是水禽生产、消费大国,肉鹅出栏量常年稳定在5亿羽以上、种鹅存栏量在2千万羽以上,产值高达500亿元以上。但自2016年以来,我国商品鹅饲养时发现鹅群中出现了以皮下、组织、关节等部位尿酸盐堆积的临床症状疾病,患病雏鹅死亡率高达50%,单日死亡率最高可达存栏量的15%,耐过鹅也会表现出生长迟缓,甚至还会继发感染细菌疾病,严重威胁到我国肉鹅养殖业的经济发展[21]。大量研究表明,雏鹅饲喂过程中补充过量的高蛋白、高钙饲料,很容易导致尿酸产生过多或饮水不足、排泄障碍,引发大量尿酸盐堆积,从而引起营养代谢性疾病[17]。同时有研究证明鹅星状病毒是导致鹅痛风的主要原因之一[1,22]。研究发现,鹅痛风病主要是由1型和/或2型星状病毒感染引起的,临床症状和病理变化较相似,很难通过肉眼进行区分,给临床检疫带来了困难[23-24]。
TaqMan qPCR方法和常规PCR法比较,前者灵敏更高、结果重复性更佳、特异性更强等,被广泛用于临床样品的检测和筛查。构建TaqMan qPCR检测法的关键在于引物和探针的设计,良好的引物和探针是该法构建成功的重要保证。先在GenBank上下载获得病毒目的基因全部序列,使用MegAlign软件进行序列比对,筛选出ORF1b高度保守区内RdRp基因,使用Primer Express Software Version 3.0设计引物和探针。引物设计时选择退火温度为59℃~60℃,因探针退火温度宜高于引物8℃~10℃,所以探针的退火温度设定为68℃~70℃,以确保探针的优先结合。反应体系经引物、探针条件摸索,优化结果为:95℃预变性30 s;95℃退火10 s,退火/延伸40 s,扩增40个循环。试验结果显示建立的TaqMan qPCR方法具有良好的标准曲线,扩增效率(E)为92%~103%,R2在0.996以上,即表明鹅星状病毒的目的基因得到良好的扩增;特异性检测结果表明,通过检测GAstV、NDV、DTMUV、AIV(H9N2)、GPV、GoCV、水禽大肠杆菌和鸭疫里默氏杆菌等病原菌,除鹅Ⅰ型星状病毒外,其他水禽相关病毒、细菌均无扩增;通过不同时间段进行实验,组内变异系数为1.02%~3.11%,组间变异系数为1.09%~3.67%,引物的重复性良好;通过实验室保存的阳性临床样品进行检测,检测结果与NGS测序结果一致。
由此可见,本研究成功构建了灵敏度高、特异性强、重复性好的GAstV-1 TaqMan qPCR检测方法。该方法的建立为水禽养殖提供了早期快速诊断技术,对水禽养殖业的健康发展具有重要意义。

