右美托咪定对癫痫大鼠海马神经元凋亡及BDNF/TrκB信号通路的影响
赵 莉, 范翠翠
癫痫是一种脑功能障碍的慢性综合征,神经元突发性异常放电是其主要原因[1]。在癫痫发作过程中,机体神经化学和生理学功能异常,可造成脑水肿、心律失常、体温失调、电解质和葡萄糖的紊乱、横纹肌溶解综合征以及认知功能受损等,甚至猝死[2]。神经元凋亡是癫痫发作后大脑损伤的重要形式[3]。因此,防治癫痫发作后神经元凋亡具有重要意义。研究显示,脑源性神经营养因子(BDNF)以及介导其生物学效应的受体-酪氨酸激酶受体B(TrκB)与多种神经系统疾病的发生发展都有关[4]。研究显示,激活BDNF/TrκB信号通路可以改善阿尔茨海默病大鼠的记忆障碍[5]。作为一种α2-肾上腺素受体激动剂,右美托咪定具有抗交感、镇静及镇痛等作用[6]。右美托咪定对脑血管病也具有治疗效果,杨永红等[7]研究发现,右美托咪定在改善脑缺血再灌注大鼠神经损伤方面疗效显著。但其在抗癫痫方面的作用以及机制尚不清楚。本研究拟基于BDNF/TrκB信号通路,探讨右美托咪定对癫痫发作后海马神经元凋亡的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF 级别雄性SD 大鼠,8~10 周龄,体质量244~274 g,购自南京伟沃生物科技有限公司,生产许可证号:SCXK(苏)2021-0012,大鼠饲养于温度为(21~24)℃,相对湿度为(57~62)%,12 h光暗循环的环境中,本研究经复旦大学附属中山医院吴淞医院伦理委员会批准(批准编号:JCLS-2022-11-02)。
1.1.2 主要药物与试剂 盐酸右美托咪定注射液、氯化锂、肿瘤坏死因子(TNF-α)、白介素(IL-6)ELISA 试剂盒、盐酸匹罗卡品、BCA 试剂盒(批号分别 为 DS29050、DS14681、DS58930、DS23582、DS28442、DS53821)均购自江西中洪博元生物技术有限公司;BDNF/TrκB 通路激活剂(LM22B-10,纯度>99%)、TUNEL 凋亡检测试剂盒、硫酸阿托品、ECL试剂、蛋白裂解液(批号分别为BS25011、BS49142、BS52855、BS27589、BS59202)均购自杭州铂赛生物科技有限公司;鼠源β-微管蛋白Ⅲ(Tuj1)一抗、羊抗鼠二抗、兔源BDNF、TrκB、B 细胞淋巴瘤-2 相关X 蛋白(Bax)、B 细胞淋巴瘤-2(Bcl-2)、β-actin、羊抗兔二抗(批号分别为KJ10940、KJ52015、KJ58292、KJ25829、KJ57193、KJ53820、KJ25810、KJ41847)均购自江苏凯基生物技术有限公司。
1.1.3 主要仪器 LW3000T 型显微镜、SpectraMax M2 型酶标仪、Quantum CX5 型凝胶成像仪均购自武汉天德生物科技有限公司。
1.2 方法
1.2.1 癫痫模型的建立及分组给药 构建癫痫大鼠模型[8,9]:大鼠腹腔注射127 mg/kg 的氯化锂溶液,24 h后腹腔注射1 mg/kg的硫酸阿托品,30 min后注射30 mg/kg 的盐酸匹罗卡品。根据Racine 分级进行癫痫发作评定[10],Ⅰ:嘴和面部抽动;Ⅱ:肌阵挛性运动,但无直立;Ⅲ:肌阵挛,伴直立;Ⅳ:全身阵挛性直立;Ⅴ:全身强直阵挛,姿势控制丧失(摔倒)。造模成功的标准是达Racine 分级Ⅳ以上,并持续15 min以上[8]。将造模成功的36只大鼠随机分为模型组、右美托咪定组(50 µg/kg)[11]、右美托咪定+LM22B-10 组(50 µg/kg+5 mg/kg)[12],每组12 只。另取12 只健康大鼠按照上述造模方法注射等量生理盐水作为对照组。
建模结束后,右美托咪定组根据参考文献[11]给予大鼠50 µg/kg 右美托咪定腹腔注射(将右美托咪定和生理盐水混溶成浓度为5 µg/ml的溶液,注射体积10 ml/kg);右美托咪定+LM22B-10 组大鼠给予50 µg/kg 右美托咪定腹腔注射和5 mg/kg LM22B-10侧脑室注射[12](将右美托咪定、LM22B-10 分别和生理盐水混溶成浓度分别为5 µg/ml、0.5 mg/ml 的溶液,注射体积10 ml/kg);对照组和模型组大鼠腹腔注射等体积生理盐水。各组每天注射1次,连续1周。
1.2.2 大鼠癫痫发作频率和持续时间观察给药结束24 h后,于上午9:00~12:00,下午3:00~6:00,记录大鼠癫痫发作频率和持续时间。
1.2.3 TUNEL染色观察大鼠海马神经元细胞凋亡情况 行为学观察结束后,处死大鼠,收集海马CA1区处脑组织,分为两部分,一部分置于-70 ℃冰箱保存,另一部分用4%多聚甲醛固定,制作石蜡切片,厚度为4 µm。取部分切片,脱蜡、复水,蛋白酶K工作液进行细胞通透操作,加入TUNEL 试剂常温避光孵育1 h,含HRP 的抗荧光素抗体室温避光孵育0.5 h,DAB 试剂显色7 min,每一步骤间用PBS 漂洗3次(每次5 min),细胞核采用苏木素复染,显微镜下观察。每张切片随机选取5 个视野,记录视野内棕褐色的阳性染色细胞数,即为凋亡细胞数,计算平均值。
1.2.4 免疫荧光染色检测大鼠海马CA1区脑组织Tuj1 阳性细胞情况 取1.2.3 中石蜡切片,脱蜡洗涤后,进行抗原修复,室温封闭1 h,加入稀释好的鼠源Tuj1(1∶1 500)一抗,4 ℃孵育过夜,加入羊抗鼠二抗(1∶2 500),室温孵育2 h,对细胞核进行DAPI染色后,荧光显微镜下观察,红色荧光即为Tuj1阳性细胞。用Image J处理图像,结果以Tuj1阳性细胞数目/mm2表示。
1.2.5 大鼠海马CA1区脑组织中TNF-α、IL-6水平的测定 取1.2.3中海马CA1区脑组织,研磨匀浆,4 ℃下11 200 r/min 离心15 min,取上清,ELISA法检测上清液中TNF-α、IL-6水平。
1.2.6 大鼠海马CA1区脑组织中BDNF、TrκB、Bax、Bcl-2 的蛋白表达水平的测定 取1.2.3 中大鼠海马CA1区脑组织,研磨匀浆,蛋白裂解液裂解,定量总蛋白浓度,取蛋白样品85 µg,电泳分离,转膜,用5%的脱脂奶粉室温下孵育1.5 h。加入稀释好的兔源BDNF(1∶1 200)、TrκB(1∶1 450)、Bax(1∶1 500)、Bcl-2(1∶1 500)、β-actin(1∶2 000)一抗,4 ℃孵育过夜,加入羊抗兔二抗(1∶2 400),室温下孵育2 h,ECL 试剂显影,以β-actin 为内参,Image J软件分析定量各组蛋白的灰度值。
1.3 统计学分析
使用SPSS 26.0软件进行统计分析,计量资料以-x±s表示,多组间比较采用单因素方差分析,组间两两比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 右美托咪定对癫痫大鼠癫痫行为的影响 与对照组相比,模型组大鼠癫痫发作频率、持续时间显著升高(P<0.05);与模型组相比,右美托咪定组、右美托咪定+LM22B-10 组大鼠癫痫发作频率、持续时间显著降低(P<0.05);与右美托咪定组相比,右美托咪定+LM22B-10 组大鼠癫痫发作频率、持续时间显著升高(P<0.05)(见表1)。
表1 各组大鼠癫痫发作频率、持续时间的比较(±s,n=12)
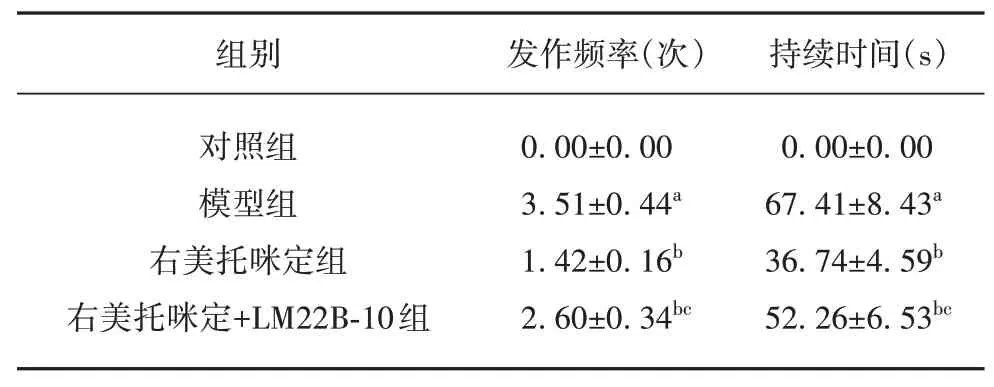
表1 各组大鼠癫痫发作频率、持续时间的比较(±s,n=12)
与对照组相比aP<0.05;与模型组相比bP<0.05;与右美托咪定组相比cP<0.05。
?
2.2 右美托咪定对癫痫大鼠海马神经元细胞凋亡和海马CA1区脑组织Tuj1 阳性细胞的影响与对照组相比,模型组大鼠海马神经元凋亡细胞数目显著升高,海马CA1区脑组织Tuj1 阳性细胞数目显著降低(P<0.05);与模型组相比,右美托咪定组、右美托咪定+LM22B-10 组大鼠海马神经元凋亡细胞数目显著降低,海马CA1区脑组织Tuj1 阳性细胞数目显著升高(P<0.05);与右美托咪定组相比,右美托咪定+LM22B-10 组大鼠海马神经元凋亡细胞数目显著升高,海马CA1区脑组织Tuj1 阳性细胞数目显著降低(P<0.05)(见表2、图1、图2)。
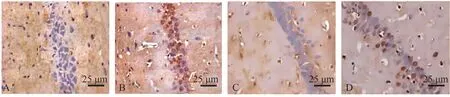
图1 各组大鼠海马神经元TUNEL染色图(400×)
表2 各组大鼠海马神经元凋亡细胞数目和海马CA1区脑组织Tuj1阳性细胞数目的比较(±s,n=12)

表2 各组大鼠海马神经元凋亡细胞数目和海马CA1区脑组织Tuj1阳性细胞数目的比较(±s,n=12)
与对照组相比aP<0.05;与模型组相比bP<0.05;与右美托咪定组相比cP<0.05。
?
2.3 右美托咪定对癫痫大鼠海马CA1区脑组织中TNF-α、IL-6 水平的影响 与对照组相比,模型组大鼠海马CA1区脑组织中TNF-α、IL-6 水平显著升高(P<0.05);与模型组相比,右美托咪定组、右美托咪定+LM22B-10 组大鼠海马CA1区脑组织中TNF-α、IL-6 水平显著降低(P<0.05);与右美托咪定组相比,右美托咪定+LM22B-10 组大鼠海马CA1区脑组织中TNF-α、IL-6 水平显著升高(P<0.05)(见表3)。
表3 各组大鼠海马CA1区脑组织中TNF-α、IL-6 水平的比较(±s,n=12,pg/mg)

表3 各组大鼠海马CA1区脑组织中TNF-α、IL-6 水平的比较(±s,n=12,pg/mg)
注:与对照组相比aP<0.05;与模型组相比bP<0.05;与右美托咪定组相比cP<0.05。
?
2.4 右美托咪定对癫痫大鼠海马CA1区脑组织中BDNF、TrκB、Bax、Bcl-2 蛋白表达水平的影响 与对照组相比,模型组海马CA1区脑组织中BDNF、TrκB、Bax 蛋白表达水平显著升高(P<0.05),Bcl-2蛋白表达水平显著降低(P<0.05);与模型组相比,右美托咪定组、右美托咪定+LM22B-10 组大鼠海马CA1区脑组织中BDNF、TrκB、Bax蛋白表达水平显著降低(P<0.05),Bcl-2 蛋白表达水平显著升高(P<0.05);与右美托咪定组相比,右美托咪定+LM22B-10 组大鼠海马CA1区脑组织中BDNF、TrκB、Bax 蛋白表达水平显著升高(P<0.05),Bcl-2 蛋白表达水平显著降低(P<0.05)(见图3、表4)。

图3 各组大鼠海马CA1区脑组织中BDNF、TrκB、Bax、Bcl-2 蛋白印迹图
表4 各组大鼠海马CA1区脑组织中BDNF、TrκB、Bax、Bcl-2蛋白表达水平的比较(±s,n=12)

表4 各组大鼠海马CA1区脑组织中BDNF、TrκB、Bax、Bcl-2蛋白表达水平的比较(±s,n=12)
注:与对照组相比aP<0.05;与模型组相比bP<0.05;与右美托咪定组相比cP<0.05。
?
3 讨 论
海马神经元凋亡是癫痫持续状态后神经细胞丢失的重要形式[13]。研究显示,癫痫发作后还伴随着神经炎症反应,会引起脑组织细胞神经炎性损伤[14]。本研究构建癫痫大鼠模型,其病理学表现类似于颞叶癫痫,其行为表现遵循Racine标准。同时,模型组大鼠癫痫发作频率、持续时间、海马神经元凋亡细胞数目、海马CA1区脑组织TNF-α、IL-6 水平较对照组显著升高,表明癫痫大鼠神经元凋亡情况加重,存活神经元减少,同时伴随炎症反应。
右美托咪定可与不同的α2 受体亚型结合后产生相应的镇静、镇痛、抗焦虑、血压升高等作用。研究发现,右美托咪定能减轻脑缺血再灌注损伤大鼠神经炎症和神经元损害,改善脑细胞凋亡,是一种神经保护剂[15],其在临床治疗老年精神病患者无抽搐电休克方面效果显著[16]。Bax和Bcl-2是凋亡调控蛋白,Bax 促进细胞凋亡,而Bcl-2 作为抗凋亡蛋白,功能与之相反[17,18]。Tuj1 是一种微管蛋白,也是神经元的标志物之一,其表达越高表示神经元存活数越多[19]。本研究结果发现,相比于模型组,右美托咪定组大鼠癫痫发作频率、持续时间、海马神经元凋亡细胞数目、海马CA1区脑组织TNF-α、IL-6 水平、Bax 蛋白表达水平显著降低,海马CA1区脑组织Tuj1 阳性细胞数目、Bcl-2 蛋白表达水平显著升高,提示右美托咪定干预可以显著降低癫痫大鼠的发作频率和持续时间以及神经元凋亡数量,增加神经元存活数目,抑制炎症反应。
BDNF 能影响神经元的存活、分化和维持,还在成熟海马的兴奋性和神经递质合成方面具有重要调控作用[20]。作为BDNF 的受体TrκB,与BDNF结合时,引发酪氨酸磷酸化,进而触发一系列级联信号转导,参与多种生理反应[21]。Javaid 等[22]研究报道,癫痫小鼠脑组织中BDNF/TrκB 信号传导被激活,使得脑组织促炎细胞因子活性升高,而经噻加宾治疗后癫痫小鼠脑组织氧化应激、BDNF/TrκB信号传导和促炎细胞因子活性受到抑制,癫痫症状得到显著改善[23]。除此之外,BDNF/TrκB 信号通路的激活还可引起海马兴奋环路的建立,导致细胞内钙离子内流,增强兴奋性突触后电位[24]。本研究结果显示,癫痫大鼠海马CA1区脑组织中BDNF、TrκB 蛋白表达水平显著升高,而右美托咪定干预后BDNF、TrκB 蛋白表达水平显著降低。在右美托咪定基础上添加BDNF/TrκB 通路激活剂LM22B-10后,癫痫大鼠发作频率、持续时间以及海马神经元凋亡细胞数目、海马CA1区脑组织TNF-α、IL-6 水平、BDNF、TrκB、Bax蛋白表达水平较右美托咪定组显著升高,海马CA1区脑组织Tuj1阳性细胞数目、Bcl-2蛋白表达水平较右美托咪定组显著降低,提示右美托咪定引起的减弱癫痫大鼠神经元细胞凋亡能力被LM22B-10 抑制,进一步提示右美托咪定可能通过阻断BDNF/TrκB 通路的激活发挥改善大鼠癫痫发作、抑制海马神经元凋亡及炎症反应的目的。
综上所述,右美托咪定能降低癫痫大鼠的癫痫发作以及抑制海马神经元的凋亡,减轻大鼠炎症反应,其机制可能与抑制BDNF/TrκB 信号通路的激活有关。但本研究仅探究了右美托咪定通过BDNF/TrκB 信号通路对癫痫大鼠的作用,右美托咪定能否通过其他信号通路发挥抗癫痫作用,有待后续研究。
伦理学声明:本研究方案经复旦大学附属中山医院吴淞医院伦理委员会批准(批准编号:JCLS-2022-11-02)。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:赵莉负责论文设计、撰写论文;范翠翠负责论文修改并最后定稿。

