远缘原生质体融合菌株的构建及生防作用研究
康霄文 杜晓华 王东伟 程菊娥 王忠勇 孙书娥 苏品 刘勇
摘 要:研究基于沼泽红假单胞菌PSB-06促生和增强寄主抗病性,苏云金芽孢杆菌KY-1抗逆性强等优点,采用原生质体融合技术获得这2种菌株的融合菌株,测定了融合菌株对生姜根结线虫的防治效果,以期得到综合亲本优良性状的新型高效生防菌株。结果表明:融合菌株显著降低了土壤根结线虫的数量,收获期相对防效达73.68%;融合菌株处理显著提高了生姜的农艺性状、产量和品质,单株姜球数(13.80个)、姜球宽度(33.47 cm)和单株产量(1.29 kg)均优于空白对照;同时提高了生姜收获期叶片的总叶绿素含量、POD和SOD活性。综合来看,沼泽红假单胞菌和苏云金芽孢杆菌融合菌株的促生及生防潜力较亲本沼泽红假单胞菌有所提高,为微生物菌种改良提供了依据。
关键词:沼泽红假单胞菌;苏云金芽孢杆菌;原生质体融合;生姜;根结线虫
中图分类号:Q813.2 文献标识码:A文章编号:1006-060X(2023)10-0043-07
Constructing a Distant Protoplast Fusion Strain of Rhodopseudomonas palustris and Bacillus thuringiensis to Biocontrol Ginger Root-Knot Nematodes
KANG Xiao-wen1, DU Xiao-hua2, WANG Dong-wei2, CHENG Ju-e2, WANG Zhong-yong2, SUN Shu-e2, SU Pin2, LIU Yong2
(1. Asset Management Center of Hunan Academy of Agricultural Sciences, Changsha 410125, PRC; 2. Hunan Institute of Plant Protection, Hunan Academy of Agricultural Sciences, Changsha 410125, PRC)
Abstract:Microbial protoplast fusion breeding is an important direction of microbial strain improvement. Based on the advantages of Rhodopseudomonas palustris PSB-06 for promoting growth and enhancing host resistance, and strong stress resistance of Bacillus thuringiensis KY-1, their fusion strain was obtained by protoplast fusion technology, whose control effect on ginger root-knot nematode disease was tested. The results showed that the fusion strain treatment significantly reduced the number of soil root-knot nematodes, and the disease control effect reached 73.68% in the harvest period. Meanwhile, it significantly improved agronomic traits, yield and quality of ginger; the number of ginger bulb per plant (13.80), ginger bulb width (33.47 cm) and the yield per plant (1.29 kg) all surpassed the blank control; at the same time, the total chlorophyll content, and POD and SOD activities of ginger in the harvest period were increased. In conclusion, the fusion strain of Rhodopseudomonas palustris and Bacillus thuringiensis has produced much stronger growth promotion and biocontrol effects than the parent strain PSB-06, which may provide theoretical and practical support for the improvement of microbial strains.
Key words:Rhodopseudomonas palustris; Bacillus thuringiensis; protoplast fusion; ginger; root-knot nematode
收稿日期:2023–08–06
基金項目:湖南省自然科学基金青年基金(2022JJ40234);杂交水稻全国重点实验室自主研究项目(2023MS03);湖南省农业科技创新资金(2023CX18;2022CX1;2022CX84-18);长沙市自然科学基金(kq2202338)
作者简介:康霄文(1964—),男,湖南涟源市人,副研究员,主要从事植物病害研究、科技产品推广、科技服务和资产管理等工作。并列第一作者:杜晓华。
通信作者:苏 品,刘 勇
近年来,随着绿色农业的发展和供给的结构性调整,微生物农药因其广谱、高效、安全、环境相容性好等特点受到广泛关注,其研究和应用已成为植物病虫害综合治理的重要手段,同时也是保护生态环境,实现农业可持续发展的有力保证[1]。
目前,常用于农业生产的微生物农药有苏云金芽孢杆菌、枯草芽孢杆菌、绿色哈茨木霉菌和光合细菌等,主要用于防治作物病害、虫害以及促进作物生长等[2]。其中,芽孢杆菌是好氧或兼性厌氧、产芽孢的革兰氏阳性杆菌的总称,其生理特征明显,分布广泛,是土壤和植物体表或根际的重要微生物种群。芽孢杆菌由于能产生耐热抗逆的芽孢,其在环境中的存活率、定殖率均较高,便于生产和加工成生防菌剂。田间应用研究已经证实,芽孢杆菌生防菌剂在稳定性、与化学农药的相容性以及在不同植物不同时间防效的一致性等方面表现优异。同时,芽孢杆菌作为土壤和植物微生态优势微生物种群之一,具有很强的拮抗作用和抗逆能力,是植物病害生防微生物的重要组成部分[3-4]。光合细菌是能利用细菌叶绿素进行光合自养型生长的一类微生物总称,也是植物表面与土壤微生物群落的一个重要组成部分。光合细菌通过自身的特征代谢活动,参与植物的养分摄取、生长发育、逆境抵御等过程,是农田生态系统中与植物以及其他微生物关系密切的有益微生物。此外,光合细菌还可通过诱导免疫反应等方式维护植物与土壤的健康。作为一类代谢功能多样、分布广泛、环境适应能力强,且与植物生长密切相关的微生物,光合细菌将是新型多功能微生物肥料与微生物农药开发的重要菌种资源[5]。然而目前,我国利用微生物农药对植物病害进行生物防治往往是以单一的生防因子为原料,导致了微生物农药的抗菌谱狭窄、综合防效差、需菌量大、环境依赖性强,同时还存在产品保藏期短和菌种易退化等问题[1]。这对生防微生物农药的研发和改良提出了新的要求。
现代生物技术的发展和应用,为微生物菌种的改良提供了契机。其中原生质体融合是通过人工方法将来源于不同遗传类型亲本的原生质体去除细胞壁,实现不同基因组的交换、重组,期望得到结合双亲基因型或产生新基因型的菌种。原生质体融合技术,可以克服自然不亲和因子的障碍,不经过有性生殖就可得到优良品种[6]。近年来,该技术广泛应用于农业、医药、食品、疾病防治等各个领域,是进行遗传育种研究的一个重要手段,而且该技术在基因定位和基因调控等方面也具有重要的应用价值,因此是生防微生物育种的重要手段[7]。该研究对沼泽红假单胞菌和苏云金芽孢杆菌进行原生质体融合,筛选融合菌株,并进行了融合菌株防治生姜根结线虫的田间试验,以期探索通过原生质体融合技术克服远缘杂交不亲和的可行性,同时为利用基因重组菌株防治植物病虫害提供依据。
1 材料与方法
1.1 试验材料
供试的沼泽红假单胞菌(Rhodopseudomonas palustris)PSB-06和苏云金芽孢杆菌(Bacillus thuringiensis)KY-1由实验室分离、鉴定、保存。供试生姜为莱芜地方品种;生姜线虫防治试验在山东济南市莱芜区(117°46'80.47"E,36°36'82.43"N)进行,供试土壤为黏性土壤,肥力中等,连续多年根结线虫发病严重。
供试培养基:(1)LB液体培养基:细菌培养用胰蛋白胨 10 g/L,细菌培养用酵母提取物5 g/L,NaCl 10 g/L,高压蒸汽灭菌15 min;(2)LB固体培养基:基础配方同LB液体培养基,另加细菌培养用琼脂8 g/L,高压蒸汽灭菌15 min;(3)LB高渗培养基:基础配方同LB液体培养基,另加蔗糖0.5 mol/L[8],高压蒸汽灭菌15 min;(4)光合细菌液体培养基:(NH4)2SO4 0.5 g/L,CH3COONa 0.5 g/L,K2HPO4约1 g/L(根据实际情况将pH值调到7时的用量为准),FeSO4 0.05 g/L,H3BO4 0.05 g/L,NaMoO4 0.05 g/L,酵母提取物1.5 g/L,高压蒸汽灭菌30 min;(5)光合细菌固体培养基:基础配方同光合细菌液体培养基,另加细菌培养用琼脂13 g/L,高压蒸汽灭菌30 min;(6)光合细菌高渗液体培养基:基础配方同光合细菌液体培养基,另加蔗糖0.5 mol/L,高压蒸汽灭菌15 min;(7)光合细菌软琼脂培养基:基础配方同光合细菌液体培养基,另加细菌培养用琼脂8 g/L和蔗糖0.5mol/L,高压蒸汽灭菌15 min后加灭活小牛血清200 ml/L。
主要试剂:(1)1 mol/L Tris-Cl(pH值7.8):10.34 g Tris-HCl和4.17 g Tris-OH溶解在50 mL蒸馏水中;(2)溶液A:0.10 g MgCl2 和11.98 g蔗糖溶于25 mL双蒸水中,加入500 μL 1 mol/L的Tris-Cl(pH值7.8),并将体积调节至50 mL;(3)溶液B:0.05 g MgCl2 和13.69 g蔗糖溶于25 mL双蒸水中,加入500 μL 1 mol/L的Tris-Cl(pH值7.8),并将体积调节至50 mL;(4)0.8 mol/L 蔗糖溶液:将13.69 g蔗糖溶解在50 mL双蒸水中;(5)EDTA(pH值 8.0):将0.70 g EDTA-2Na溶解到15 mL ddH2O中,终浓度为372.20 g/mol;(6)SMM缓冲液(pH值6.5):34.23 g蔗糖、0.46 g C4H4O4和0.38 g MgCl2溶解在100 mL双蒸水中;(7)PEG缓冲液:SMM中包含40%(V/V)PEG6000,10 mmol/L CaCl2和5%(V/V) DMSO;(8)溶菌酶:将0.015 g溶菌酶溶解在3 mL双蒸水中,终浓度为5 mg/mL;(1)~(7)號溶液过滤除菌,常温保存,(8)号溶液过滤除菌, -20℃保存。DnaseI(ThermoFisher),-20℃保存。
主要设备有BX51T-32F01光学显微镜(olympus)、Nikon-108电子显微镜(nikon)。
1.2 试验方法
1.2.1 亲株菌株的准备 沼泽红假单胞菌PSB-06的纯培养物接种于光合细菌生长培养基中,厌氧光照培养,光照强度1 500 lx,温度32℃,培养至OD530为0.9~1.0;苏云金芽孢杆菌KY-1的纯培养物接种于LB液体培养基中,30℃振荡培养到OD600为0.9~1.0。
1.2.2 沼泽红假单胞菌PSB-06原生质体的制备 原生质体制备方法参考前人[9-11]的方法进行相应修改。取对数生长期的PSB-06纯培养物按1∶10的比例稀释到30 mL含有终浓度60 μg/mL的头孢噻肟钠光合细菌液体培养基中,37℃振荡培养2.0 h,2 500 r/min 4℃离心4 min弃上清,回收菌体。轻轻加入1 mL 0.8 mol/L的蔗糖,孵育1 min,清洗菌体。弃上清液,操作过程中不要干扰到菌体。将150 ?L的1 mol/L Tris-Cl、120 ?L的5 mg/mL溶菌酶和120 ?L的0.125 mol/L EDTA依次加入到单细胞丝中,室温孵育10 min。向上述溶液中慢慢加入1 mL溶液A,时间要超过1 min,同时用手轻轻旋转溶液,室温下孵育4 min。再缓慢加入7 mL 4℃的溶液B,2 500 r/min 4℃离心4 min。小心地除去所有上清,沉淀重悬于1 mL光合细菌高渗培养基中。在10×100倍油镜下观察样品原生质体的形成过程。将一定量菌体稀释在蒸馏水中裂解原生质体,然后在光合细菌固体培养基上连续稀释,统计未形成原生质体的菌体产生的菌落,以此计算原生质体的形成效率。
1.2.3 芽孢杆菌KY-1原生质体的制备 将OD600≈1.0的芽孢杆菌菌悬浮液30 mL 5 000 r/min 4℃离心10 min,去上清。將菌体重悬在30 mL SMM缓冲液中,并加入终浓度1 mg/mL的溶菌酶,100 r/min,37℃震荡培养1 h。5 000 r/min 4℃离心10 min,去上清,沉淀重悬于1 mL LB高渗培养基中。在10×100倍油镜下观察原生质体的形成过程。将一定量菌体稀释在蒸馏水中裂解原生质体,然后在LB固体培养基上连续稀释,统计未形成原生质体的菌体产生的菌落,以此计算原生质体的形成效率。
1.2.4 原生质体的融合和再生 分别取0.5 mL制备成功的PSB-06和KY-1原生质体,混合后加入1 U的DNaseI来消解因菌体裂解而释放的DNA,从而防止在原生质体形成过程中因吸收裂解菌体释放的DNA而产生的转化。将上述混合液在25℃下孵育10 min,3 500 r/min 4℃离心20 min,重悬在0.5 mL PEG缓冲液中。继续在25℃下孵育5~20 min后,加入1 mL SMM缓冲液,3 500 r/min 4℃离心20 min。融合完成后,立即加入5倍体积的SMM缓冲液稀释、离心、洗涤菌体2次。将菌体重悬在光合细菌高渗液体培养基中,梯度稀释后涂布于光合细菌软琼脂培养基上再生。克隆菌体的16S rDNA,测序,以鉴定出融合子,然后进行传代培养。
1.2.5 融合菌株防治生姜根结线虫的田间试验 试验设4个处理,分别为:处理1,分别在2020年4月18日(发芽期)、7月11日(苗期)、9月8日(旺盛期)进行融合菌株(5 kg/667 m2)灌根处理;处理2:分别在2020年4月18日(发芽期)、7月11日(苗期)、9月8日(旺盛期)进行亲株PSB-06(5 kg/667m2)灌根处理;处理3:2019年11月25日至2020年3月3日进行土壤棉隆熏蒸处理,熏蒸液用量为20 kg/667m2;处理4:空白对照,未进行任何消毒处理。每个处理5次重复,小区面积16 m×0.7 m,随机区组排列。采用旋耕整地,生姜种植间距为18~20 cm。每个处理设3条保护线以维持环境条件的一致性。土壤样品收集、各处理的根结线虫防效、生姜生长指标和叶片生理活性指标测定、土壤微生物多样性及其理化性质分析等均参照Wang等[12]的方法进行。
1.3 数据分析
运用Excel、SPSS13.0软件对所有数据进行单因素方差分析,采用Duncan氏新复极差法进行差异显著性分析(α=0.05)。
2 结果与分析
2.1 融合菌株的获得
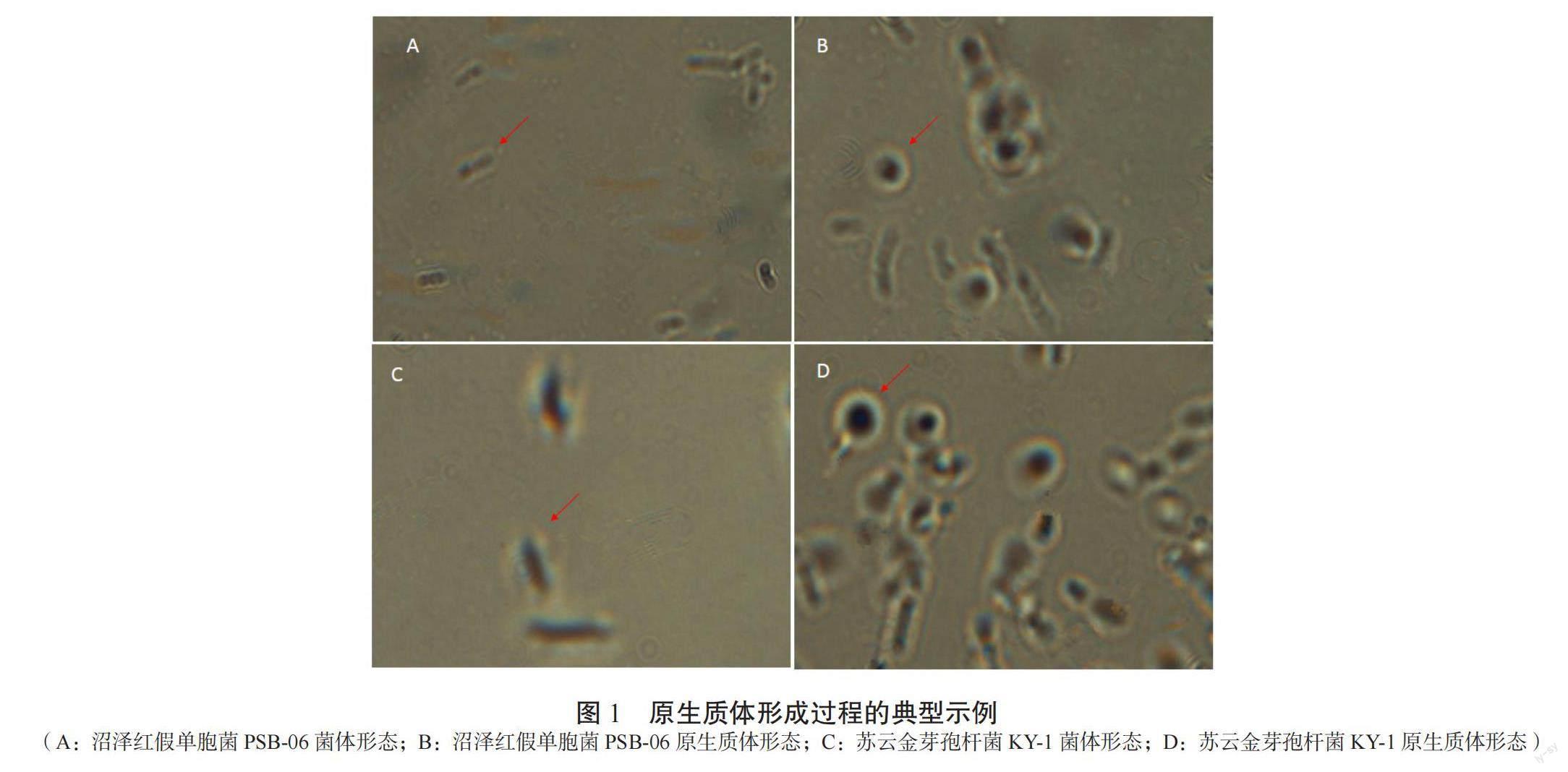
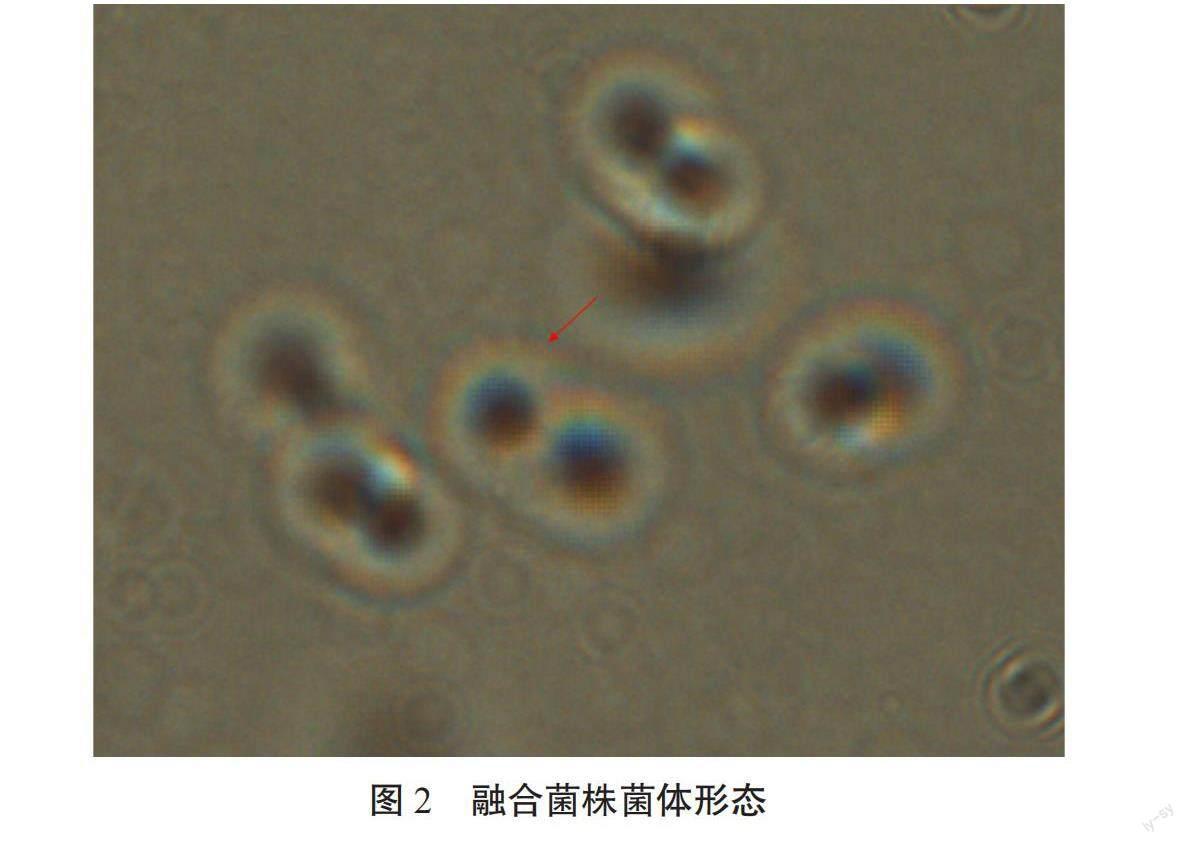
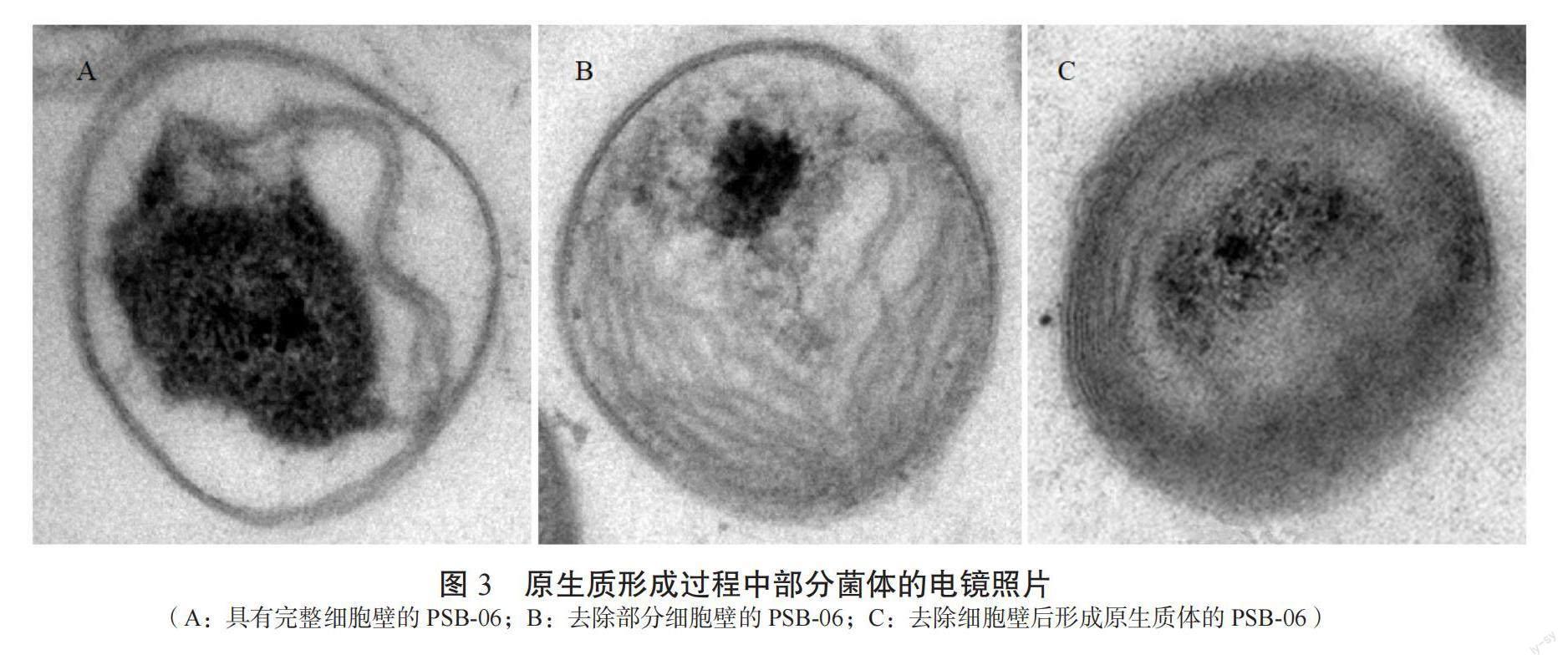
在油镜下观察了融合过程,并记录了原生质体制备各阶段的形态变化,如图1所示,对亲本菌株进行处理后,在10×100倍油镜下观察到沼泽红假单胞菌PSB-06和苏云金芽孢杆菌KY-1酶解前的形态(图1A和C)和外壁剥离后形成的由细胞膜包裹的原生质体形态(图1B和D)。视野中大部分菌体的原生质体由于剥离细胞壁后失去细胞刚性,形成由内膜包裹的油煎蛋状。与酶解前相比几乎无带壁菌体的存在,且制备的原生质体数目充足。图2显示了2个原生质体融合后形成融合菌株的形态。同时,在扫描电镜下观察了沼泽红假单胞菌PSB-06菌体原生质体的形成过程如图3所示,图3A所示为沼泽红假单胞菌PSB-06的菌体形态,而头孢噻肟钠和溶菌酶处理后视野中的菌体外膜已经从菌体部分剥离(图3B)或者不可见,进而形成原生质体(图3C)。
2.2 融合菌株对生姜根结线虫的防治效果
如图4A所示,发芽期各处理土壤样品中根结线虫数量均较低,但各处理间无显著差异(P>0.05)。从苗期到收获期根结线虫虫口数量逐渐增加,旺盛生长期根结线虫数量显著增加。每100 g土壤中,苗期融合菌株处理的根结线虫平均虫口数为0.60条,PSB-06处理为0.80条,隆棉消毒处理的为0.40条,3个处理的根结线虫数量均低于空白对照的2.20条,且差异显著(P<0.05)。旺盛生长期和收获期,融合菌株处理的根结线虫平均虫口数分别为8.20和8.40条,均显著低于空白对照(P<0.05),且旺盛生长期融合菌株处理的根结线虫平均虫口数显著低于PSB-06处理和隆棉消毒处理(P<0.05)。
如图4B所示,收获期融合菌株处理的根结线虫病情指数为10,显著低于空白对照(P<0.05)。融合菌株处理对根结线虫的防效达73.68 %,显著优于亲本菌株PSB-06处理的47.37 %和隆棉消毒处理的52.36 % (P<0.05);且与空白对照相比,生防菌株PSB-06和隆棉消毒处理都能显著降低生姜根结线虫的病情指数,减轻根结线虫对生姜的危害,且防效持续性较好。
2.3 融合菌株对生姜生长指标的影响
如表1所示,与空白对照相比,收获期各处理对生姜的株高、分蘖数、主茎粗、主茎叶数、单株姜球数、姜球宽度和单株产量均具有一定的促进作用,其中以融合菌株处理的效果最好,生姜株高达110.60 cm、分蘖数为11.10个、主茎粗达5.39 cm,均显著高于对照的(P<0.05),但各处理对主茎叶数的影响不显著(P>0.05)。与空白对照相比,融合菌株处理显著提高了生姜的产量和品质,融合菌株处理单株姜球数达13.80个、姜球宽度达33.47 cm,单株产量达1.29 kg,均显著优于空白对照处理 (P<0.05)。
2.4 融合菌株对生姜叶片的总叶绿素含量和抗胁迫能力的影响
由图5可知,融合菌株处理生姜叶片在苗期和收获期的总叶绿素含量分别为2.04和1.91 mg/g,均显著高于空白对照的1.45和1.13 mg/g(P<0.05),旺盛生长期各处理生姜叶片的总叶绿素含量差异不显著。收获期融合菌株处理的生姜叶片总叶绿素含量显著高于亲本菌株PSB-06处理和隆棉消毒处理 (P<0.05)。
由图6可知,苗期和旺盛生长期,各处理生姜叶片的POD活性无显著差异(P>0.05),收获期融合菌株处理的生姜叶片POD活性为16.10 U/g,显著高于其他处理(图6A);SOD活性方面,旺盛生长期各处理叶片中SOD活性差异不显著,苗期和收获期融合菌株处理生姜叶片SOD活性分别为100.37、116.59 U/g,均顯著高于空白对照(P<0.05)(图6B)。
3 讨 论
微生物原生质体融合育种技术为跨界融合理论提供了现实依据,在得到杂种细胞的同时保持了亲本遗传物质的稳定传递[13]。但原生质体融合技术作为品系改良策略仍有一个缺点,就是许多杂交菌株
有丝分裂不稳定,染色体丢失(导致非整倍体)或分离到亲本品系的情况经常发生[6]。同样,实验室中的融合菌株在传代培养时也会发生一方亲本遗传物质丢失的情况,这有待进一步的研究和改良。
沼泽红假单胞菌PSB-06原生质体的制备在实验室原有方法的基础上做了相应改进,形成了“混合酶破壁加化学诱导法”去除菌体细胞壁。头孢噻肟钠通过抑制转肽酶的合成初步抑制菌体细胞壁的合成以形成单细胞丝,然后EDTA处理以除去部分外壁,最后用溶菌酶消化暴露的肽聚糖。原生质体融合和再生试验中,笔者发现虽然沼泽红假单胞菌和苏云金芽孢杆菌的最适生长温度均不是25~28℃,但融合子在25~28℃下的再生率略高于30℃(沼泽红假单胞菌PSB-06的最适生长温度)时的再生率;同时,融合子混合于融化的45℃软琼脂培养基时的再生率低于直接将融合子涂布于含0.5 mol/L蔗糖的软琼脂培养基时的再生率,且含有部分外壁的原生质体再生率较高,因此原生质体融合时不需要去掉全部细胞壁来达到融合的目的。
融合菌株防治生姜根结线虫的试验结果表明,融合菌株对生姜根结线虫有较好的防治效果。在生姜发芽期和苗期,土壤中的根结线虫数量较少,在旺盛生长期和收获期显著增加。很有可能是生姜生长早期气温过低,根结线虫的繁殖速度慢所致。后期随着环境温度的升高,根结线虫种群规模迅速增加。与空白对照相比,融合菌株对根结线虫的防治效果可一直持续到收获期,且融合菌株对根结线虫的防治效果优于亲本菌株PSB-06(融合菌株与另一亲本苏云金芽孢杆菌KY-1抗胁迫能力的比较尚在试验中)。从生姜收获期的生长指标来看,融合菌株显著提高了生姜地上部分的农艺性状及生姜的品质和产量,而且融合菌株提高了苗期和收获期生姜叶片的叶绿素含量,笔者推测,融合菌株很有可能通过提高叶绿素的含量来增强生姜植株的光合作用,从而提高生姜的产量和品质,且前人的研究也显示亲本菌株PSB-06具有促进植物生长的作用[14-15]。从生姜叶片的抗氧化活性来看,在生长发育早期各处理生姜叶片的POD活性差异不显著,收获期融合菌株处理生姜叶片的POD活性显著高于空白对照;融合菌株处理在苗期和收获期显著提高了生姜叶片的SOD活性,且在收获期SOD活性显著高于亲本菌株PSB-06处理。已有报道显示,在胁迫条件下或植物生长后期,POD和SOD活性均有所升高[16]。这表明融合菌株处理增强了生姜的耐胁迫能力,也预示着微生物原生质体融合菌株在防治植物病虫害、提高植物抗胁迫能力等方面具有一定的潜力。
参考文献:
[1] 康业斌,丁玥琪,陈奇园,等. 生防微生物及其在烟草病害防治中的应用研究进展[A]. 河南省植物保护学会,河南省昆虫学会,河南省植物病理学会. 河南省植物保护学会第十一次、河南省昆虫学会第十次、河南省植物病理学会第五次会员代表大会暨学术讨论会论文集[C]. 许昌:河南省植物保护学会,河南省昆虫学会,河南省植物病理学会,2017.
[2] 张 慧,许 宁,曹丽茹,等. 我国微生物农药的研发与应用研究进展[J]. 农药学学报,2023,25(4):769-778.
[3] 陈中义,张 杰,黄大昉. 植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J]. 植物病理学报,2003,33(2):97-103.
[4] ELLIOTT M L,DES JARDIN E A,JR BATSON W E,et al. Viability and stability of biological control agents on cotton and snap bean seeds[J]. Pest Management Science,2001,57(8):695-706.
[5] 苏 品,张德咏,张 卓,等. 光合细菌的农用微生物功能解读[J]. 中国生物防治学报,2021,37(1):30-37.
[6] LI N,LU J,WANG Z R,et al. Improving the regeneration rate of deep lethal mutant protoplasts by fusion to promote efficient L-lysine fermentation[J]. BMC Biotechnology,2023,23(1):22:1-11.
[7] 王佳蕊,魏 炜. 微生物原生质体融合育种技术及其应用与展望[J]. 建筑与预算,2017(10):31-34.
[8] 黄勤妮,劉 佳,宋秀珍,等. 大肠杆菌和枯草芽胞杆菌的原生质体融合[J]. 首都师范大学学报(自然科学版),2002,23(1):55-59,90.
[9] 刘 勇,张德咏,谭新球,等. 5种光合细菌种间原生质体融合及优良农用融合子的筛选鉴定[J]. 生命科学研究,2004,8(4):344-350.
[10] FIGUEROA D M,WADE H M,MONTALES K P,et al. Production and visualization of bacterial spheroplasts and protoplasts to characterize antimicrobial peptide localization[J]. Journal of Visualized Experiments,2018(138):e57904.
[11] DAI M H,ZIESMAN S,COPLEY S D. Visualization of protoplast fusion and quantitation of recombination in fused protoplasts of auxotrophic strains of Escherichia coli[J]. Metabolic Engineering,2005,7(1):45-52.
[12] WANG D W,WANG J,SU P,et al. Effects of dazomet combined with Rhodopsesudomonas palustris PSB-06 on root-knot nematode,Meloidogyne incognita infecting ginger and soil microorganisms diversity[J]. Frontiers in Microbiology,2022,13:1021445.
[13] OGAWA K,YOSHIDA N,GESNARA W,et al. Hybridization and breeding of the benomyl resistant mutant,Trichoderma harziantum antagonized to phytopathogenic fungi by protoplast fusion[J]. Bioscience,Biotechnology,and Biochemistry,2000,64(4):833-836.
[14] LUO L Y,WANG P,ZHAI Z Y,et al. The effects of Rhodopseudomonas palustris PSB06 and CGA009 with different agricultural applications on rice growth and rhizosphere bacterial communities[J]. AMB Express,2019,9(1):173-183.
[15] ZHAI Z Y,CHEN A,ZHOU H M,et al. Structural characterization and functional activity of an exopolysaccharide secreted by Rhodopseudomonas palustris GJ-22[J]. International Journal of Biological Macromolecules,2021,167:160-168.
[16] MYOUGA F,HOSODA C,UMEZAWA T,et al. A hetero complex of iron superoxide dismutases defends chloroplast nucleoids against oxidative stress and is essential for chloroplast development in Arabidopsis[J]. The Plant Cell,2008,20(11):3148-3162.
(责任编辑:成 平)

