甲壳动物JAK/STAT信号通路在免疫应答中的功能与调控机制
赵付荣, 王 蔚,张艳阁,郑 秦,陈建明*
(1.闽江学院地理与海洋学院、福建省海洋生物多样性保护与永续利用重点实验室,福建 福州 350108;2.福州海洋研究院,福建 福州 350108)
甲壳动物属于无脊椎动物,是重要的经济类养殖动物,目前在水产品中的比重逐渐加大。作为代表性养殖甲壳动物的虾类和蟹类,其需求量随着人们生活水平的不断提高而持续增加,虾蟹类养殖业也得到了快速发展。但是饲养技术的不足与相关疾病的发生仍是虾蟹养殖业的重大威胁,目前已知能感染虾蟹的病原有病毒、细菌、真菌、立克次氏体和寄生虫等,如白斑综合征(WSD)、急性肝胰腺坏死综合征(AHPND)等是影响养虾业的最具侵略性的疾病[1]。在充满病原微生物的复杂环境里,脊椎动物依靠先天性免疫和获得性免疫两种形式抵御病原微生物的侵害,而甲壳动物仅具有先天性免疫,主要存在细胞免疫与体液免疫两种形式,其中体液免疫中的免疫信号通路发挥着关键的作用[2]。在无脊椎动物中,主要存在着3条免疫功能调控的信号通路:Toll、IMD和JAK/STAT。Toll和IMD信号通路主要参与抗细菌和真菌的免疫反应,少部分具有抗病毒免疫效应[3-4],而JAK/STAT信号通路主要参与抗细菌和抗病毒免疫反应,但相关的分子机制尚未完全清楚[5]。
JAK/STAT 信号通路,即Janus激酶(JAK)-信号传导及转录激活因子(signal transduction and activators of transcription,STAT),这一信号通路于1994年,被Darnell等在研究干扰素诱导细胞内信号传导时发现[6]。JAK/STAT信号通路是一种多种细胞因子共用的主要信号传导机制,参与细胞的增殖、分化、凋亡以及免疫调节等,已在多种模式生物中被广泛研究。随着研究的深入,现已确定与虾蟹同为无脊椎动物的果蝇(Drosophilamelanogaster)的JAK/STAT信号通路的核心成分,分别是配体(UPD)、酪氨酸激酶(JAK)、膜受体(Dome)与信号转导和转录激活因子(STAT)[7-8]。细胞因子与相应的受体结合后引起受体分子的二聚化,这使得与受体偶联的JAK激酶相互接近并通过交互的酪氨酸磷酸化作用而活化。JAK激活后催化受体上的酪氨酸残基发生磷酸化修饰。受体磷酸化为细胞质STAT创建对接位点,STAT通过酪氨酸磷酸结合SH2结构域被招募到受体复合物中,并自身磷酸化。活化的磷酸化STAT(pSTAT)通过分子间SH2-磷酸酪氨酸相互作用形成同源或异源二聚化,易位到细胞核,结合DNA调控元件,改变染色质可及性,诱导基因转录[9]。该信号通路为细胞因子信号传导的重要途径,在进化上相对保守,广泛参与细胞增殖、分化、凋亡、免疫调节、血管生成、氧化应激、炎症反应以及肿瘤生成等重要的生物学过程[9-10]。目前JAK/STAT信号通路的研究在信号识别、信号调控以及基因的调控表达方面成果非常丰富。但在甲壳动物中,关于JAK/STAT信号通路的关键元件及功能的报道有限,至今还没有形成一个完整的体系[11]。
在先天免疫系统的研究中,果蝇等经典的无脊椎动物模式生物[12],为虾蟹等甲壳动物的JAK/STAT信号通路的研究提供了有效参考。研究人员发现虾免疫系统的基本框架与昆虫高度相似[11, 13],在虾中发现了JAK/STAT信号通路的相关元件,并通过系统发育分析证明对虾STAT与昆虫STAT具有较高的同源性。本文从Dome、JAK、STAT、信号调节因子这4个方面来讨论养殖甲壳动物JAK/STAT信号通路的研究进展。该信号通路上各组分的作用见表1。
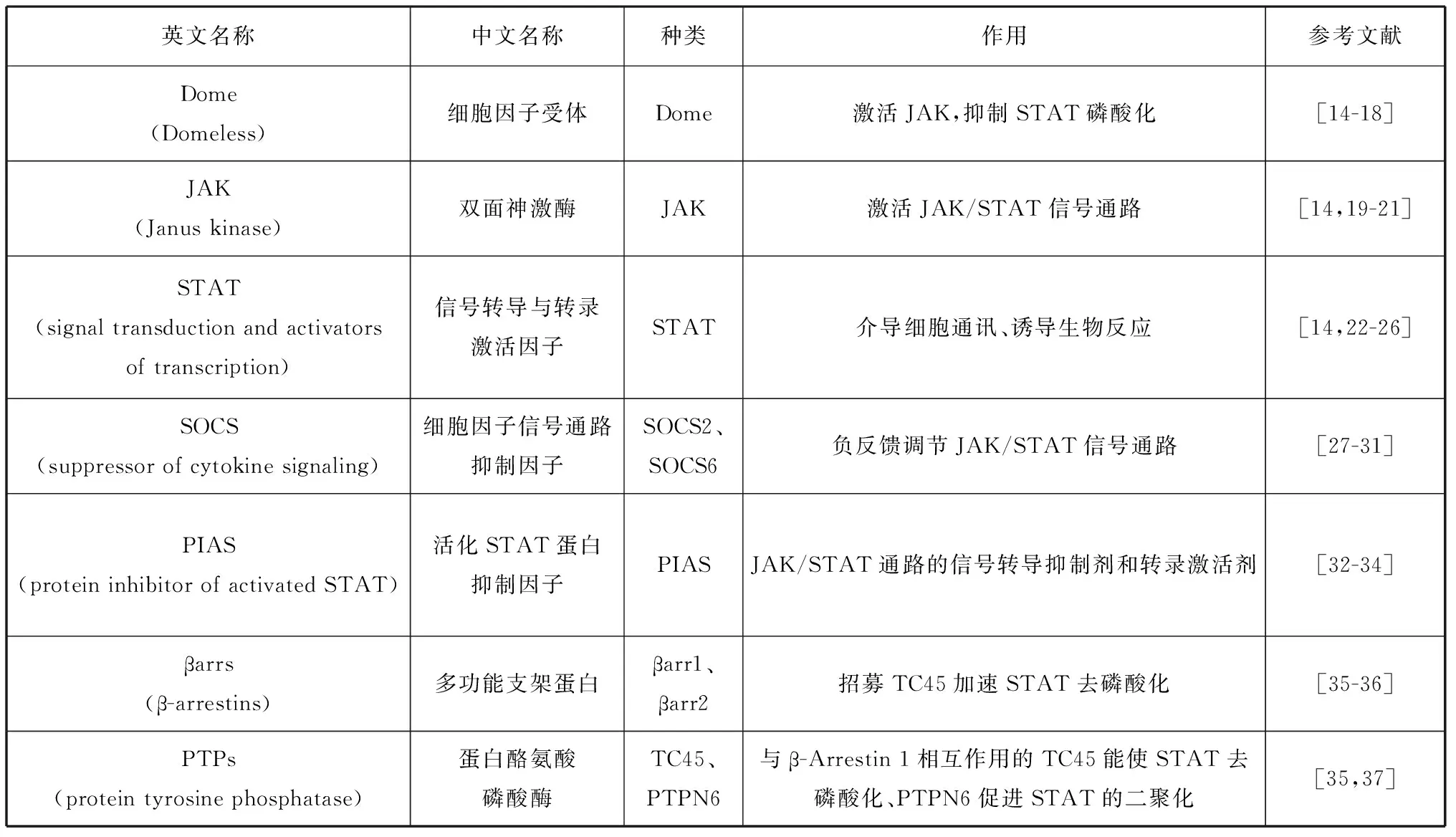
表1 甲壳动物各元件在JAK/STAT通路中的作用Tab. 1 Role of each element in the JAK/STAT pathway in crustaceans
1 细胞因子受体(Dome)的结构及其在虾蟹中的表达和作用
果蝇细胞因子受体Dome(DoDome)是首次在无脊椎动物中被发现的细胞因子受体,有研究表明Dome蛋白的缺失会导致胚胎死亡。目前已在多种甲壳动物中鉴定到类似Dome的存在,包括中华绒螯蟹(Eriocheirsinensis)[14]、红螯螯虾(Cheraxquadricarinatus)[15]、斑节对虾(Penaeusmonodon)[16]、凡纳滨对虾(Litopenaeusvannamei)[17]和日本囊对虾(Marspenaeusjaponicus)[18]。
Dome属于跨膜蛋白,含有胞外区、跨膜区和胞内区3个部分。胞外区含有与细胞因子专一性结合的位点,与特异性配体结合启动细胞信号转导。胞内区结构变化较小,具有与酪氨酸激酶结合的结构域,与酪氨酸激酶结合后从而具备信号转导功能,介导JAK/STAT通路信号转导,参与上游JAK/STAT反应。细胞因子受体因胞外区与配体结合的特异性位点的不同,被分为不同的类型。不同种类生物的Dome在结构上也有所差异,但是功能基本相似。
MjDome(Dome inMarspenaeusjaponicus)是首个在甲壳动物 JAK/STAT 通路中被报道的细胞因子受体,被发现于日本囊对虾。MjDome与脊椎动物Ⅰ型细胞因子受体家族中白细胞介素6(IL-6)受体的胞外区具有相似的结构:细胞因子结合(cytokine binding modules,CBM)结构域与细胞外Ⅲ型纤连蛋白(fibronectin-type-Ⅲ,FNⅢ)结构域。研究表明,CBM结构域参与Dome受体的激活而使下游信号顺利传导[38]。IL-6受体的CBM结构域由CBMⅠ和CBMⅡ2个结构域组成,CBMⅠ包含4个保守的半胱氨酸残基,CBMⅡ包含1个五氨基酸WSXWS(Trp-Ser-Xaa-Trp-Ser)基序,该保守基序广泛存在于脊椎动物 I 型细胞因子受体中,它作为一个分子开关控制受体的激活[39]。
研究者通过序列分析发现MjDome的结构含有1个信号肽,1个CBM结构域,5个FNⅢ结构域和1个跨膜结构域[19]。Yan等通过分析LvDome(Dome inLitopenaeusvannamei)的氨基酸序列,发现其具有1个信号肽、2个CBM结构域、3个FNⅢ结构域和1个细胞质结构域[17]。有研究报道了中华绒螯蟹的Dome包含1个信号肽、5个FNⅢ结构域、1个跨膜区和1个低复杂性区。通过多序列比对,EsDome(Dome inEriocheirsinensis)的氨基酸序列与IL-6受体和昆虫的Dome具有较大差异,但系统发育分析显示EsDome属于甲壳动物类[14]。研究人员在红螯螯虾的CqDome(Dome inCheraxquadricarinatus)鉴定出1个N端信号肽、2个CBM结构域、3个FNⅢ结构域和1个跨膜结构域。CqDome的CBM结构域中,CBMⅠ包含4个保守半胱氨酸残基,但CBMⅡ有一个不完整的WSXWS基序[15]。Laohawutthichai等发现斑节对虾的Dome(PmDome)包含1个信号肽、1个CBM结构域、4个FNⅢ结构域和1个跨膜结构域[16]。以上甲壳类动物Dome经氨基酸序列比对与系统发育分析后,均被归为同一组,它们的结构与IL-6受体相比,均没有完整的WSXWS基序,并且FNⅢ结构域的数量也有差异,但共同包含4个保守的半胱氨酸残基及FNⅢ结构域,所以推测甲壳动物与哺乳动物的Dome具有相似的功能。值得注意的是,不同生物的Dome中FNⅢ的数量可能不一致,FNⅢ结构域广泛存在于细胞因子受体中,参与蛋白质的折叠、稳定与功能调控[40],但FNⅢ的数量对Dome功能的影响还暂未报道,需进一步研究。
在甲壳动物中,Dome广泛分布于血细胞、心脏、肝胰腺、鳃、肠等通常与机体的免疫功能相关的组织或器官中,但不同物种的Dome在不同器官或组织内的表达量具有差异。研究人员对Dome在虾蟹不同组织中进行表达研究发现,Dome在日本囊对虾的心脏中表达水平较高,在血细胞和肝胰腺中表达水平较低[18]。相反的是,红螯螯虾的CqDome在血细胞中表达水平最高[15],血细胞在甲壳动物的免疫系统中发挥着至关重要的作用,Dome在血细胞中的高表达量可能有利于红螯螯虾对抗病原的免疫反应。凡纳滨对虾Dome在血细胞、心脏、肝胰腺、鳃、肠中均有表达外,在肌肉和眼柄中表达水平较高[17],据报道,IL-6受体也在人类的肌肉中广泛表达。中华绒螯蟹的Dome在鳃、血细胞、肌肉、心脏、肠、肝胰腺和胃中均有表达,且表达量依次降低[14]。在斑节对虾中,研究人员发现PmDome在淋巴组织中表达量最高,在肝胰腺中表达量最低,淋巴组织是病原入侵对虾后免疫功能发挥作用的主要组织。了解甲壳动物体内Dome的分布有助于我们更好的了解其在先天免疫中的作用,这些组织或器官都与甲壳动物的免疫功能相关,并且Dome分布广泛,可能在病原入侵时能更快地将细胞外信号传入细胞核。
Dome已被证实参与JAK/STAT信号通路的激活,并且与病毒的复制有关,但是抗菌机制还有待研究。研究者发现LvDome可以作为一种受体激活JAK/STAT通路,WSSV可能诱导LvDome的表达,增强对虾 JAK/STAT 通路的激活。LvDome过表达会显著增强WSSV启动子的转录,而敲降LvDome后WSSV在虾中的增殖得到了抑制,降低了虾的累积死亡率,表明LvDome可能被WSSV影响以利于病毒复制[17]。前人研究也发现红鳌鳌虾的CqDome基因沉默显著抑制了WSSV的复制,这意味着WSSV可以利用CqDome进行复制,并且CqDome参与了红螯鳌虾JAK/STAT通路的信号转导[15],这一研究结果与凡纳滨对虾的LvDome研究结果一致。在斑节对虾的血细胞中,WSSV感染使PmDome表达上调,沉默PmDome会对对虾体内免疫相关基因的表达有显著影响,而且降低了WSSV的拷贝数,延缓了由WSSV引起的累积死亡率。在对日本囊对虾的研究中发现MjDome可以与C型凝集素(MjCC-CL)卷曲结构域结合,直接激活日本囊对虾JAK/STAT信号通路从而对细菌入侵做出免疫应答[18]。研究还发现在细菌入侵时,敲低中华绒螯蟹血细胞中EsDome后会影响部分抗菌肽的表达,它提示EsDome激活了JAK/STAT信号通路以及参与了调控抗菌肽的表达。但是细菌是以直接方式还是间接方式激活EsDome还不清楚[14]。
虽然虾蟹的种类远远不止这些,但是上述研究结果为Dome介导并激活JAK/STAT通路的信号转导的激活提供了强有力的证据,也为其他甲壳动物中Dome的研究提供了参考。
2 JAK酪氨酸激酶的结构及其在虾蟹中的表达和作用
JAK是一种细胞内的非受体酪氨酸激酶,是细胞因子受体胞内结构衔接的信号分子家族。JAK家族是不同信号转导通路的关键组成部分,在细胞的生存、增殖、分化、发育、稳态和抵抗病原方面起着重要作用[41]。目前在哺乳动物中报道JAK有4个亚型,分别是JAK1、JAK2、JAK3和TYK2(tyrosine kinase 2)。此外JAK有7个同源结构域,分别是JH1—JH7[42]。据报道在果蝇中也发现了一种类似JAK功能的酪氨酸激酶Hopscotch(Hop),与哺乳动物的JAK2亚型同源性最高[43]。
在甲壳动物中,已在卤虫(Artemiafranciscan)、拟穴青蟹(Scyllaparamamosain)、凡纳滨对虾和中华绒螯蟹中鉴定到JAK激酶,但是不同甲壳动物的JAK都是独特的。JAK激酶通常含有一个FERM结构域、一个SH2结构域、一个假激酶结构域和一个TyrKc结构域[44]。其中FERM结构域与SH2结构域参与JAK与细胞因子受体的结合[45];假激酶结构域被认为对调节TyrKc结构域的活性至关重要[46];TyrKc结构域负责细胞因子受体和下游分子上酪氨酸残基的磷酸化[14]。结构域预测分析表明,卤虫的AfJAK (JAK inArtemiafranciscan)、拟穴青蟹的SpJAK(JAK inScyllaparamamosain)与凡纳滨对虾的LvJAK(JAK inLitopenaeusvannamei)结构相似,从N端到C端都包含一个FERM结构域、一个SH2结构域和两个TyrKc结构域。SpJAK、LvJAK和果蝇JAK具有较高的相似性,提示JAK蛋白在进化过程中较为保守,可能具有动物间相似的功能[19-20]。而中华绒螯蟹的EsJAK(JAK inEriocheirsinensis)除了包含一个SH2结构域和两个TyrKc结构域外,还包含了一个Band 4.1同源结构,已知这些特异性酪氨酸激酶结构域介导信号传导并起到重要作用[14, 47]。
不同甲壳类JAK在不同的组织中表达,并广泛分布于免疫器官或组织中。其中,SpJAK在脑、神经和肠道中均呈现高表达,在鳃、胃、眼柄、肝胰腺、心脏和血细胞等大部分检测组织中中度表达;在肌肉中的表达水平最低[19]。EsJAK在多种组织中均有表达,包括在鳃、肠、肝胰腺和心脏中表达。其中在肝胰腺中表达水平最高,在血细胞中表达最低[14]。LvJAK在鳃、血细胞、肝胰腺和肠中也均有表达。这些组织均为免疫组织,推测可能与免疫有联系[29]。
甲壳动物的JAK激酶参与了JAK/STAT信号通路的抗菌和抗病毒反应。AfJAK能够以剂量依赖的方式激活昆虫Sf细胞中D-raf原癌基因的启动子活性,这与果蝇 STAT 在免疫应答过程中激活D-Raf 原癌基因的结论一致,推测AfJAK可能参与MAPK级联反应的调控[21]。SpJAK可以通过促进STAT作用于其 DNA结合基序,增强WSSV wsv069基因启动子的活性。这些结果表明SpJAK可以激活JAK/STAT通路。此外,在体内沉默SpJAK可导致呼肠孤病毒(MCRV)感染的拟穴青蟹死亡率增高,并且使其病毒载量增高,推测SpJAK可能在MCRV防御中发挥重要作用[19]。LvJAK是JAK/STAT通路的靶基因,可作为正调控因子形成正反馈回路。此外,沉默LvJAK可导致更高的死亡率和病毒载量,提示LvJAK可能在WSSV的防御中发挥重要作用。其结果为JAK蛋白介导的正反馈回路在无脊椎动物中存在提供了证据[20]。
3 信号转导及转录激活因子的结构及其在虾蟹中的表达和作用
STAT家族是JAK/STAT信号通路的关键组成部分,具有信号转导和转录激活的双重功能,当细胞外受到刺激时会被激活从而控制基因的表达[41]。在无脊椎动物中,STAT参与多种生物过程中的重要转录调控,可能涉及广泛的发育阶段以及组织分布[22,32]。目前在哺乳动物中已确定STAT家族有STAT1、STAT2、STAT3、STAT4、STAT5A/5B和STAT6七个主要成员[48]。但在甲壳动物中STAT仅仅发现一种,与哺乳动物的STAT5具有较高的同源性。已有研究表明在节肢动物和昆虫中JAK/STAT途径在机体抗病毒免疫中具有一定的作用[49]。
STAT蛋白通常由STAT相互作用结构域、STAT all-alpha/beta结构域、STAT DNA结合结构域和SH2结构域组成[14]。其中STAT相互作用结构域被认为促进了STAT-STAT二聚体的形成;STAT all-alpha/beta结构域被认为有助于STAT-STAT二聚体进入细胞核;STAT DNA结合结构域具有类似于p53肿瘤抑制蛋白的免疫球蛋白样折叠功能;SH2结构域作为磷酸化依赖的开关从而控制受体识别和DNA结合[50-51]。结构域预测发现EsSTAT包含一个STAT相互作用结构域、一个STAT all-alpha结构域、一个STAT DNA结合结构域和一个SH2结构域[14]。斑节对虾的PmSTAT具有DNA结合域、SH2域和C末端反式激活域[23]。
凡纳滨对虾的LvSTAT(STAT inLitopenaeusvannamei)基因含有N-末端结构域、螺旋结构域、DNA结合域和SH2结构域[24]。中国明对虾(Fenneropenaeuschinensis)的FcSTAT(STAT inFenneropenaeuschinensis),包含蛋白质相互作用域、全α螺旋结构域、DNA结合域、SH2结构域和C末端结构域[22]。克氏原螯虾(Procambarusclarkii)中克隆了3个STAT亚型cDNA,结构域预测分析表明PcSTATs的三个亚型都包含了一个STAT相互作用域、一个STAT全α域、一个DNA结合域和一个SH2结构域[25]。日本囊对虾的蛋白包含STAT相互作用域、STAT all-alpha结构域、DNA结合域和SH2结构域[26]。系统进化树分析结果表明,拟穴青蟹的SpSTAT(STAT inScyllaparamamosain)、中华绒螯蟹的EsSTAT(STAT inEriocheirsinensis)、凡纳滨对虾的LvSTAT、中国明对虾的FcSTAT蛋白聚在一支,并且与人的STAT5较为密切[14]。上述几种甲壳类动物STAT有类似的结构,并且系统进化树分析同源性较高,表明STAT蛋白在进化过程中具有保守性,可能具有相似的功能。LvSTAT 在血细胞、肝胰腺中高表达[24]。EsSTAT在鳃、肝胰腺和血细胞等组织中均高表达[14];MjSTAT(STAT inMarspenaeusjaponicus)在肌肉、胃、脑和鳃组织中表达[26]。可见STAT在不同动物不同组织的表达水平并不一致。
有研究表明WSV181可以通过控制STAT92E表达来抑制JAK/STAT信号传导,对感染了果蝇C病毒的转基因果蝇以及注射重组WSV181和WSSV的凡纳滨对虾进行了感染实验,结果显示病毒载量增加且JAK/STAT途经的组分转录水平降低,表明WSV181可通过抑制JAK/STAT途径促进病毒增殖[52]。前人研究发现当凡纳滨对虾被WSSV感染时,WSSV并不破坏JAK/STAT通路,相反可以激活STAT使其从细胞质转移到细胞核中从而促进WSSVIe1基因的表达[23]。凡纳滨对虾在WSSV刺激下STAT能够发生磷酸化,并且STAT 磷酸化后进入细胞,调控效应分子的表达[53]。在WSSV感染晚期STAT蛋白会由细胞质进入细胞核,为了合成更多的STAT蛋白,STAT转录增强以此来补充细胞质中减少的STAT蛋白量[54]。EsSTAT蛋白的抑制仅影响JAK/STAT信号传导,因为EsSTAT处于JAK/STAT信号传导下游即末端的位置,JAK/STAT信号传导的激活可以导致EsSTAT磷酸化,进而使磷酸化后的EsSTAT从细胞质转移到细胞核[14]。在对中国明对虾的研究发现,STAT被WSSV诱导上调表达[22]。MjSTAT的磷酸化过程能够被SOCS2抑制。当SOCS2被干扰后,对虾对细菌的清除能力增强,对虾的死亡率减少[8]。STAT在JAK-STAT信号传导的下游发挥作用,多位研究者已经证实STAT在WSSV感染时可以发生磷酸化并且形成二聚体进入细胞核进而调控相应基因的表达。这些研究都为进一步了解甲壳动物的天然免疫应答提供了基础,有助于对甲壳动物的JAK/STAT信号传导全面而具体的认识。
4 负调控因子的结构及其在虾蟹中的表达和作用
先天免疫是抵御病原体入侵的第一道防线。细胞因子介导细胞间的交流,在适当程度下调节免疫反应是非常重要作用的。然而,先天免疫的激活必须严格控制,以避免过度的免疫反应而造成不良影响。因此细胞因子受体信号传导的负调控就显得尤为重要[55]。JAK/STAT正调控元件和负调控元件共同参与信号通路的调控已被证实[8]。介导JAK/STAT 信号传导的负调控因子分别是:细胞因子信号传导抑制因子(SOCS)蛋白家族,蛋白酪氨酸磷酸酶(PTP)和活化STAT蛋白抑制因子(PIAS)。除了这些调控蛋白之外,多功能支架蛋白β-arrestin1与细胞因子TC45也参JAK/STAT途径的调控。
4.1 细胞因子信号通路抑制因子(SOCS)
细胞因子信号通路抑制因子(SOCS)是反式调控元件的一种,受JAK/STAT信号通路调控表达,且能抑制该信号通路,具有负调控作用,但已有部分研究证明了SOCS分子在细胞因子受体信号转导中的正向调控作用[56]。SOCS包含8个家族成员,分为2个亚家族,分别被命名为Ⅰ型 (SOCS4—SOCS7) 和Ⅱ型 (CIS和SOCS1—SOCS3)[57],有研究表明在鱼类中已鉴定到SOCS家族的新成员[58]。SOCS主要通过两种方式调控JAK/STAT信号通路,一是通过SH2结构域竞争性结合JAK激酶上磷酸化的酪氨酸残基来抑制激酶活性[59],二是通过募集泛素连接酶形成复合体,并通过泛素化途径降解标记的靶基因[60]。
SOCS家族通常具有相似的结构,氨基端的N区,中间的SH2结构域和羧基端的SOCS-box。氨基端的N区为一段长度和核苷酸序列高度可变的可变区;SH2结构域能识别JAK激酶上磷酸化的酪氨酸残基,参与信号的转导;羧基端的SOCS-box具有较高的保守性,作为底物蛋白识别模块,参与蛋白酶对底物蛋白的泛素化和后续的降解[61-62]。
目前已在中华绒螯蟹、日本囊对虾、凡纳滨对虾和克氏原螯虾(Procambarusclarkii)[27]体内鉴定出SOCS,属于SOCS2或SOCS6家族,不同物种SOCS中SH2结构域与SOCS-box的氨基酸序列是保守的。在中华绒螯蟹的EsSOCS2(SOCS2 inEriocheirsinensis)中预测了ESS结构域、SH2结构域和SOCS-box。氨基端延伸的N-ESS结构域被认为是SOCS的特异性元件,它在SOCS2和CIS中作为结构子域连接着SH2结构域和SOCS-box[63],SH2结构域中包含一个酪氨酸磷酸化(Tyrosine phosphorylation, pY)位点(Arg230, Asp231和Ser232)。日本囊对虾的MjSOCS(SOCS inMarspenaeusjaponicus)、凡纳滨对虾的LvSOCS2(SOCS2 inLitopenaeusvannamei)和克氏原螯虾的PcSOCS2(SOCS2 inProcambarusclarkii)蛋白结构中均具有SH2结构域和SOCS-box这两个典型结构域,并且MjSOCS与EsSOCS2、LvSOCS2、PcSOCS2分别具有56.2%、90.0%和57.0%的同源性,均属于SOCS2家族。在中华绒螯蟹的EsSOCS6(SOCS6 inEriocheirsinensis)也包含SH2结构域和 SOCS-box结构域,并在其氨基端结构域中发现了一个长的可变区,经鉴定后属于SOCS6家族[28]。
SOCS在不同甲壳动物的组织分布情况和各组织中的表达量差异印证了SOCS具有多种功能。EsSOCS2在肝胰腺、鳃、肌肉、心脏和性腺中表达量较高,在血细胞中表达量较低[29];EsSOCS6在肝胰腺和鳃中高表达,在造血组织中表达量相对较低;MjSOCS在心脏、鳃、肠道和淋巴器官中高表达,在血细胞、胃和肝胰腺中表达量很低;Wang等发现LvSOCS2在凡纳滨对虾的鳃、肠和上皮组织中高表达,在心脏和神经的表达量为中等,在肝胰腺、幽门盲肠和血细胞中表达量较低。但另一研究结果表明,LvSOCS2在对虾的血细胞、肠道和肝胰腺中高表达,在鳃中表达量极低,心脏中几乎不表达。LvSOCS2在神经组织中的表达表明了它可能参与了神经元组织的分化[30]。PcSOCS2在心脏和肌肉中表达水平最高,在肝胰腺中呈低表达水平。
SOCS家族在协调细胞对多种细胞因子和生长因子的反应中发挥关键作用,通过针对受体复合物调节细胞内信号级联以防止过度信号传递并恢复内稳态[64-66]。但目前关于SOCS参与甲壳动物免疫防御反应的报道较少。研究发现鳗利斯顿氏菌(Listonellaanguillarum)和藤黄微球菌(Micrococcusluteus)刺激中华绒螯蟹后,血淋巴细胞内的EsSOCS2表达量升高,表明EsSOCS2可能在抗细菌感染中起重要作用[29]。此外,EsSOCS2被报道中在中华绒螯蟹中具有调节神经递质释放的功能[67]。研究人员还发现EsSOCS6可能通过调节 NF-κB 信号通路在对病毒和细菌的免疫应答中发挥综合作用。在日本囊对虾中发现了MjSOCS2,其表达量可受脂多糖、肽聚糖和聚肌胞苷酸影响,表明MjSOCS与对虾的先天免疫有关。研究还发现,MjSOCS2能够抑制磷酸化的MjSTAT[31]。在凡纳滨对虾中,LvSOCS2能够呈浓度依赖性抑制由LvJAK诱导的DmVir-1启动子表达量上调,这些结果提示LvSOCS2是 JAK/STAT 通路的负调控因子。此外,敲除LvSOCS后,WSSV感染凡纳滨对虾的死亡率降低,说明敲除LvSOCS2能增强凡纳滨虾对WSSV的抗性[30]。研究人员发现在克氏原螯虾中可能存在20-hydroxyecdysone/SOCS2/ERK通路,而PcSOCS2是该信号通路的负调控因子[27]。
4.2 活化STAT蛋白抑制剂(PIAS)
活化STAT蛋白抑制剂(PIAS)蛋白家族通常作为负调控因子参与JAK/STAT信号通路的调控,是该信号通路的信号转导抑制剂和转录激活剂[68-69]。哺乳动物的PIAS蛋白家族有4个成员PIAS1、PIAS3、PIASx(PIAS2)和PIASy(PIAS4)。PIAS家族具有广泛的功能,参与细胞增殖、细胞分化、细胞凋亡、免疫应答等重要生物学过程[70-71]。在JAK/STAT信号通路中,PIAS与二聚化的STAT结合阻止STAT核易位,阻断活化的STAT的DNA结合活性来抑制STAT诱导下游基因转录的能力[72-73]。
PIAS蛋白家族高度保守,具有共同的结构特征: 氨基端的SAP结构域、PINIT结构域、RLD结构域,以及羧基端的一个富含酸性氨基酸的结构域(AD)和富含丝氨酸跟苏氨酸的结构域(S/T-rich结构域)。SAP结构域参与序列特异性DNA或结构特异性 DNA结合[74];PINIT结构域参与了PIAS的核定位[75];RLD结构域参与PIAS蛋白的 SUMO-E3连接酶的激活,并且可能参与PIAS与其他蛋白的相互作用[76];在 AD中存在一个推测的 SUMO1相互作用基序(SIM)[77]。C末端的S/T-rich结构域最不保守,其功能还有待研究。
目前在甲壳动物中仅有一种PIAS被发现,已在拟穴青蟹、日本囊对虾和凡纳滨对虾中被报道[32-34]。SpPIAS(PIAS inScyllaparamamosain)、MjPIAS(PIAS inMarspenaeusjaponicus)和LvPIAS(PIAS inLitopenaeusvannamei)均有相似的结构域特征,均包含SAP结构域,PINIT结构域,RLD结构域和S/T-rich结构域。
日本囊对虾的MjPIAS在血细胞和肝胰腺高表达。研究发现,MjPIAS通过抑制STAT的磷酸化与核易位来负向调控JAK/STAT信号通路对抗菌肽基因的表达来抑制日本囊对虾的抗菌能力[34]。凡纳滨对虾的PIAS(LvPIAS)在肌肉中表达量最丰富,其表达水平受细菌和病毒刺激后均有不同程度的显著变化应答。LvSTAT与LvPIAS之间存在负反馈环,LvSTAT诱导LvPIAS,LvPIAS抑制LvSTAT对LvPIAS启动子的转录活性[33]。
4.3 多功能支架蛋白(βarrs)
βarrs(β-arrestins)是多功能支架蛋白,参与调节多种细胞表面受体的脱敏和内吞作用[78-79]。哺乳动物中,有研究表明在IFN-γ治疗后,核βarr1直接与细胞核中的STAT1相互作用,招募TC45加速STAT1去磷酸化[80];另一项研究发现GdX(位于Xq28 G6PD簇中的X连锁基因,也称为Ubl4A,泛素样蛋白4A)能够介导TC45和STAT3之间相互作用,促进STAT3去磷酸化[81]。在对虾中,有两个βarr(βarr 1和2)[35]和1个TC45。
在细菌感染后,STAT磷酸化增加,随后其易位到细胞核中以诱导虾血细胞中AMP的表达。βarrs和TC45加速了鳗弧菌(Vibrioanguillarum)攻击对虾STAT的去磷酸化,这些结果表明βarr1作为支架蛋白在TC45和STAT之间起桥梁作用,它加速了STAT在细胞核中的去磷酸化抑制了鳗弧菌感染对虾中AMP的表达[36]。
4.4 蛋白酪氨酸磷酸酶(PTPs)
蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTPs)是JAK/STAT信号通路中的STAT负调控因子,目前已知有超过130种PTPs被发现,PTPs能使细胞质中JAK激酶上磷酸化的酪氨酸残基去磷酸化或使细胞核中的STAT去磷酸化来调控STAT的活性[81]。目前在甲壳动物中,PTPs的研究较少,仅发现了日本囊对虾的TC45 (45-kDa form of TC-PTP)和凡纳滨对虾的LvPTPN6。日本囊对虾的TC45包含一个活化区和一个位于C-端非活化区的核定位信号[36];凡纳滨对虾的LvPTPN6包含两个SH2结构域和蛋白酪氨酸磷酸酶催化(PTPc)结构域[37]。
PTPs在甲壳动物体内呈组织性分布。TC45在凡纳滨对虾的血细胞、心脏、肝胰、鳃、胃和肠中均有表达[36];LvPTPN6在神经、肌肉和肠道中表达量最高,在心脏、肝胰腺中表达量偏低[37]。
研究者干扰日本囊对虾的TC45基因后,使用细菌刺激日本囊对虾,发现对虾体内STAT磷酸化水平升高,说明TC45通过对STAT去磷酸化负调控了JAK/STAT信号通路的抗细菌免疫[36]。在凡纳滨对虾中,LvPTPN6的表达受到干扰素调节因子(IRF)的调控,IRF可以直接与LvPTPN6的启动子结合。值得注意的是,与典型的PTPs功能相反,LvPTPN6可以促进 STAT 的二聚化及核定位,这进一步提高了 STAT 靶向的免疫效应基因的表达,并增强了虾的抗病毒免疫[37]。
5 总结与展望
甲壳动物JAK/STAT信号通路与先天免疫系统相关,并在应对病原感染的免疫应答反应中起重要作用。各种细胞因子通过JAK/STAT信号通路参与介导机体各种生理病理反应。在正常情况下,各种细胞因子能通过JAK/STAT信号通路介导的抵抗病原感染。反之,则会导致病原,特别是病毒可以利用该通路感染宿主。
病毒性疾病是水产殖业发展的主要威胁,应用抗生素的传统治疗方法可以缓解疾病的发展,但抗生素的过度使用会导致机体耐药和新疾病的发生。因此,虾蟹养殖疾病防控策略的提出、先天免疫方面的研究显得尤为重要。这里提出几个未来研究的方向以供参考:
(1)目前关于JAK/STAT信号通路的研究大都集中在组成元件的鉴定、组成元件参与白斑综合征病毒感染的机制研究方面。对各组成元件具体的监管机制以及各元件之间的相互作用仍需要进一步探索。
(2)通路上主要元件的报道主要集中在STAT上,而关于JAK和Dome的相关报道则有限;关于通路与病毒感染机制的研究主要集中在白斑综合征病毒方面,关于其他病毒感染、病原菌侵染的研究鲜有报道。而对于养殖甲壳动物危害比较大的疾病比如十足虹彩病毒病, 传染性皮下和造血组织坏死病、急性肝胰腺坏死病等,这几种疾病尚无有效的治疗方法,死亡率非常高。因此对这些疾病的感染机制的研究,尤其是对其在JAK/STAT通路上的各元件对通路的影响机制的研究显得十分迫切。以期做好疾病的防控工作,把生产实际的损失降至最低。
总而言之,JAK/STAT通路之间的分子机制尚未被完全阐明,在通路特征及功能的研究方面还需更进一步深入研究。深入研究JAK/STAT通路上已经鉴定出来的对病原感染的免疫应答反应的相关基因和蛋白的功能,为虾蟹养殖业提供必要的疾病防控理论依据的同时,也为虾蟹疾病防控提出有效的解决方法。

