磁性铁氧化物在含铀废水吸附处理中的应用研究
张金海
(广东亨利达环保科技有限公司,广东 惠州 516000)
随着社会经济的发展,核电成为国家安全方面的重要能源资源。铀作为核电的重要燃料,在工业发展中的需求量越来越大,但面临的铀污染也越来越严重。
目前,含铀废水的处理方法主要由膜分离法、微生物法、电化学法、化学沉淀法和吸附法等[1]。膜分离法主要是通过纳滤膜的过滤作用实现废水中铀的去除,去除效率可达到90%[2];微生物法主要是利用放线菌、铀还原菌等微生物将铀转化为有机物以降低铀的放射性和毒性,但是对铀的去除效果不高[3];电化学法主要是用电化学还原技术将废水中的U(VI)转化为U(IV),然后通过添加吸附剂进一步去除铀[4];化学沉淀法主要是利用化学反应使铀转化为不溶性化合物而实现铀的去除,对铀的去除率可达到96%以上[5];吸附法主要使采用吸附剂,利用物理吸附的方法将铀去除,去除率可达90%以上[6]。在实际应用中,吸附法因具有实施方便、效率高、成本低而被广泛使用。
含铀废水处理吸附剂主要有粘土矿物、生物质基材料、金属氧化物、有机聚合物和磁性无机-有机杂化材料。其中以铁的氧化物为主的金属氧化物对铀的亲和力较高,可以实现铀的高效去除。Su等人研究了γ-Fe2O3对U(VI)的去除效果,结果表明γ-Fe2O3对铀的吸附容量在3 min 内可达到87.35 mg/g[7]。Liu 等研究了α/γ-Al2O3对U(VI)吸附性能,发现γ-Al2O3比α-Al2O3的吸附性能好,U(VI)去除率可达到94.43%[8]。然而,上述吸附剂在酸性环境中对U(VI)的吸附能力较差,为了提高在酸性含铀废水中的吸附性能,通常给吸附剂赋予一定的磁性功能,以期实现铁的氧化物在酸性含铀废水中的高吸附性能。
1 实验部分
1.1 仪器与试剂
ARL EQUNINX 3000/3500 粉末X 射线衍射仪;YJ1002 型电子天平;KQ-500E 型超声波清洗机;DHG-9140A 型鼓风干燥箱;雷磁PHSJ-6L 型pH 计;DR5000 紫外可见分光光度计;ZNCLG240*150 型恒温加热磁力搅拌器;TH-MHC 型磁滞回线试验仪。
硝酸铀酰、Fe3O4、CH3COONa·3H2O、硅酸乙酯(C8H20O4Si)、(CH2OH)2、NH3·H2O、十二醇硫酸钠、CH3CH2OH、H2SO4、HNO3、NaOH、溴化十六烷基三甲基铵(C19H42BrN),分析纯。
1.2 磁性铁氧化物(γ-Fe2O3@SiO2)的制备
采用30 mL 浓度为0.1 mol/L 的HCl 对Fe3O4纳米球进行超声清洗,称取1 g 置于含有C19H42BrN(0.30 g)、NH3·H2O(NH3质量分数28%,1 ml)、CH3CH2OH(80 ml)和纯水(20 ml)的混合液中搅拌1 h,之后逐滴加入10 μL C8H20O4Si,在30 ℃条件下连续搅拌5 h,采用磁铁收集Fe2O3@SiO2并用CH3CH2OH和纯水分别洗涤3次,将洗涤后的溶液放置烘箱中,在60 ℃条件下进行干燥。将干燥的磁性铁氧化物放置在温度为500 ℃的马弗炉中煅烧5 h 去除体系中含有的C19H42BrN,同时将Fe3O4氧化为γ-Fe2O3,得到磁性铁氧化物γ-Fe2O3@SiO2微球。
1.3 铀标准溶液的配置
称取2.11 g 硝酸铀酰六水化合物(UO2(NO3)2·6H2O)置于含有磁子的烧杯(250 ml)中,加入适量的浓HNO3,再盖上玻璃盖。将烧杯置于恒温磁力搅拌器中使UO2(NO3)2·6H2O 充分搅拌溶解,待全部溶解后将含铀溶液转移至容量瓶(1 L)中,并用超纯水进行稀释定容,得到质量浓度为1 g/L的铀标准溶液,后续实验通过调整稀释倍数得到所需浓度的含铀废水。
1.4 分析方法
1.4.1 铀浓度测定
采用偶氮胂Ⅲ分光光度法测定铀浓度[9]。用移液管分别量取浓度为0.1 mol/L 的盐酸0.5 mL、质量浓度为500 mg/L的偶氮胂Ⅲ2.0 mL和浓度为0.05 mol/L的乙二胺四乙酸1 mL置于10 mL比色管中,通过试验分析,确定其特征吸收峰波长为652 nm。在此基础上建立标准曲线,在U(VI)质量浓度0~10 mg/L 范围内,其质量浓度与溶液吸光度具有线性相关性,其决定系数(R2)已经达到0.99以上,见图1。

图1 U(VI)质量浓度标准曲线Fig 1 U(VI)mass concentration standard curve
根据得到的标准曲线,可按照公式计算在特定时间条件下γ-Fe2O3@SiO2对溶液中铀的去除率(δ)和吸附量(q),计算公式如下:
式中ρ0为含铀废水的初始U(VI)质量浓度,ρt为t时刻含铀废水中的U(VI)质量浓度,m为吸附剂γ-Fe2O3@SiO2的质量,V为试验含铀废水的体积。
1.4.2 磁滞回线分析
采用TH- MHC 型磁滞回线试验仪对γ-Fe2O3@SiO2进行磁特性的测量和分析。
2 结果与讨论
2.1 磁性强度分析
磁性强度作为磁性吸附剂的重要指标之一,对磁性吸附性能具有一定的影响。具有磁性的吸附剂材料,可以在外加磁场的作用下实现吸附剂的固液分离,同时也有利于设计相关的回收装置。本实验过程中制备的γ-Fe2O3@SiO2的磁滞曲线如图2所示。

图2 γ-Fe2O3@SiO2的磁滞曲线Fig 2 Hysteresis curve of γ-Fe2O3@SiO2
由图2 可知,制备的γ-Fe2O3@SiO2的磁滞曲线为经过原点的对称曲线,没有磁滞现象,同时饱和磁化强度Ms为27.968 Am2/kg,即γ-Fe2O3@SiO2具有良好的磁性,可以在外加磁场的作用下实现吸附剂的固液分离,这将有利于提高对U(VI)的去除率。
2.2 溶液pH的影响
γ-Fe2O3@SiO2对U(VI)的去除和吸附主要是通过还原反应及沉淀进行的,溶液的pH 值不仅对U(VI)的化学形态产生影响,还影响体系中加入的吸附剂γ-Fe2O3@SiO2的表面电荷,从而影响γ-Fe2O3@SiO2对U(VI)的吸附性能。在γ-Fe2O3@SiO2投加量为0.3 g/L、初始铀质量浓度为10 mg/L的条件下,分析了溶液pH对γ-Fe2O3@SiO2的U(VI)去除和吸附效果的影响,结果如图3所示。
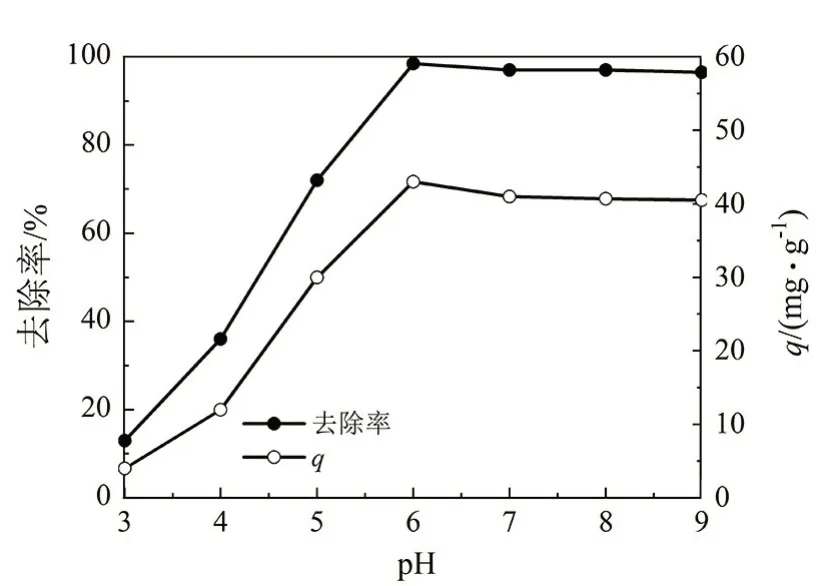
图3 溶液pH的影响Fig 3 Effect of solution pH
由图3 可知,γ-Fe2O3@SiO2对铀U(VI)的吸附量以及去除率随着pH 的变化而变化,pH 在3.0~6.0 范围,γ-Fe2O3@SiO2对U(VI)的吸附量以及去除量均随着pH的增加而迅速增加;当pH=6.0时,U(VI)的去除率接近100%;继续增加pH,去除效率有所降低,但整体去除效率较高。总体,γ-Fe2O3@SiO2对U(VI)具有较好的吸附性能,这主要因为:
1)在弱酸性环境条件下,U(VI)会以UO22+、(UO2)4(OH)7+和(UO2)3(OH)5+等阳离子形式存在于水溶液中,随着pH 增加至6 时,γ-Fe2O3@SiO2表面的羟基去质子化导致可螯合U(VI)的自由活性基团迅速增加,同时与U(VI)的静电斥力也逐渐减小,因此U(VI)的吸附效率明显提高。
2)当溶液pH 继续增加时,UO22+会产生水解,形成UO2(OH)2和UO2(OH)3-[NO3]等阴离子,这些阴离子易与水中的H+结合,沉淀在吸附剂表面,因此,γ-Fe2O3@SiO2对铀U(VI)的去除率无明显变化,后续实验选择的溶液pH均为6。
2.3 γ-Fe2O3@SiO2投加量的影响
在pH 为6、初始铀质量浓度为10 mg/L 的条件下,通过调整γ-Fe2O3@SiO2投加量,分析其对U(VI)的去除效率和吸附量的影响,结果如图4所示。

图4 γ-Fe2O3@SiO2投加量的影响Fig 4 The effect of γ-Fe2O3@SiO2 dosage
由图4可知,U(VI)的去除效率随着γ-Fe2O3@SiO2投加量的增加而迅速增加,当投加量为0.4 g/L时,去除效率达到约100%,继续增加投加量,去除效率维持稳定。随着γ-Fe2O3@SiO2投加量的增加,吸附量逐渐减小,特别是在投加量0.2~0.6 g/L范围,下降幅度最大。这主要是因为溶液中的活性点位数量会随着γ-Fe2O3@SiO2投加量的增加而增多,当反应一定时间后吸附会产生一定的平衡,但活性点位未饱和,从而使得吸附量降低。因此,γ-Fe2O3@SiO2较优的投加量为0.4 g/L。
2.4 环境中腐殖酸(FA)的影响
由于水体中的物质是多变且复杂的,某一物质的存在可能会导致其它污染物性能发生变化,从而影响目标污染物的去除。黄腐酸(FA)作为常见的天然有机物质在酸性环境中广泛存在,且在含铀废水中对U(VI)的化学形态和反应活性均产生一定程度的影响。在初始铀质量浓度为10 mg/L、γ-Fe2O3@SiO2投加量为0.4 g/L的条件下,探讨不同pH 条 件 下, 水 体 中FA 对γ- Fe2O3@SiO2的U(VI)吸附性能的影响,结果如图5所示。

图5 环境中腐殖酸(FA)的影响Fig 5 The impact of humic acid(FA)in the environment
由图5 可知,随着FA 含量的逐渐增加,γ-Fe2O3@SiO2对U(VI)的去除率降低,说明FA对吸附具有一定的抑制作用,且强酸环境下,FA 的抑制作用更为明显。分析原因为,弱酸环境下FA与γ-Fe2O3@SiO2表面的Si-OH基团之间有较强的吸着力,γ-Fe2O3@SiO2表面形成一定量的团聚体将γ-Fe2O3@SiO2表面活性位点占据,并与U(VI)离子产生竞争吸附现象,造成部分U(VI)无法去除。
2.5 水体共存离子的影响
在实际含铀废水中含有大量的阳离子和重金属离子,在一定程度上对U(VI)吸附性能造成一定的影响。水体中常见的阳离子主要包括K+、Na+、NH4+和Mg2+,重金属离子主要有Zn2+、Co2+、Pb2+和Mn2+。在初始铀质量浓度为10 mg/L、γ-Fe2O3@SiO2投加量为0.4 g/L 和溶液pH 为6 的条件下,分析不同浓度的阳离子和重金属离子对γ-Fe2O3@SiO2的U(VI)吸附性能的影响。阳离子对U(VI)吸附性能的影响,结果见表1。

表1 阳离子的影响Tab 1 The influence of cations
由表1 可知,阳离子的存在对U(VI)的去除率具有一定的抑制作用,且随着阳离子浓度的增加,抑制作用越强。这可能是由于离子之间存在的静电吸引,溶液中的阳离子与U(VI)产生了竞争吸附,大量的阳离子占据了γ-Fe2O3@SiO2表面的活性位点,使得γ-Fe2O3@SiO2对U(VI)的吸附性能下降。但是在阳离子共存的条件下,随着阳离子浓度的增大,γ-Fe2O3@SiO2对U(VI)的去除率均高于90%,说明阳离子的存在对γ-Fe2O3@SiO2吸附U(VI)的影响较小。
重金属离子对γ-Fe2O3@SiO2的U(VI)吸附性能的影响,结果见表2。
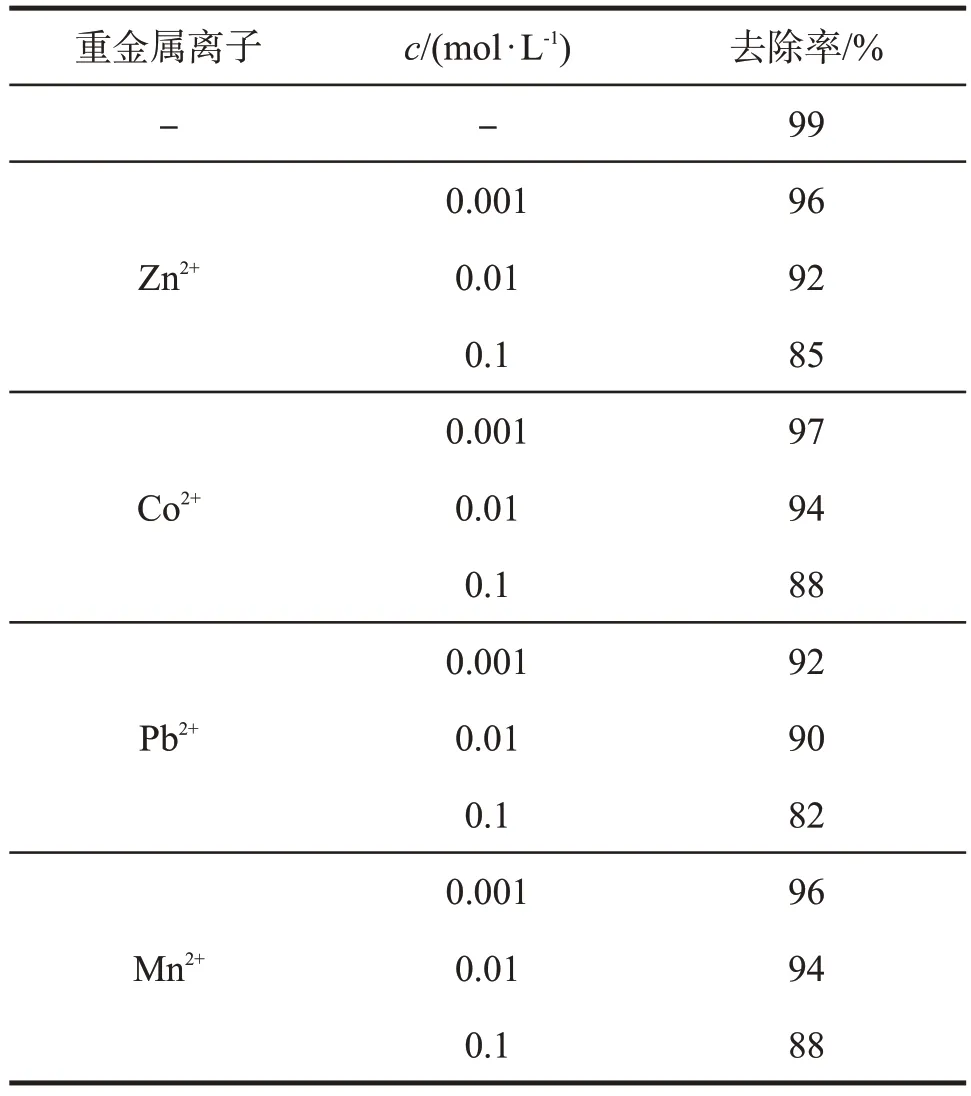
表2 重金属离子的影响Tab 2 The influence of heavy metal ions
由表2 可知,随着重金属离子浓度的增加,γ-Fe2O3@SiO2对U(VI)的去除率下降,且下降幅度较大,表明重金属离子的存在会抑制γ-Fe2O3@SiO2对U(VI)的去除,抑制作用强于阳离子。
3 结 论
通过模板法制备了以Fe2O3为磁心、SiO2为外壳的介孔磁性铁氧化物γ-Fe2O3@SiO2,对γ-Fe2O3@SiO2的磁性强度进行了分析,并研究了溶液pH、γ-Fe2O3@SiO2投加量、水体中黄腐酸(FA)以及共存离子对U(VI)去除效果的影响,得到以下结论:
1)γ-Fe2O3@SiO2具有良好的磁性,可以在外加磁场的作用下实现吸附剂的固液分离。
2)γ-Fe2O3@SiO2对铀U(VI)的吸附量以及去除率在弱酸条件下受pH 的影响较大,当PH=6 时,U(VI)的去除率接近100%;当γ-Fe2O3@SiO2投加量为0.4 g/L时,U(VI)的去除效率可达到约100%。
3)含铀废水中的黄腐酸(FA)对γ-Fe2O3@SiO2的U(VI)吸附具有一定的抑制作用,且强酸环境下的抑制效果更明显;阳离子的存在对γ-Fe2O3@SiO2吸附U(VI)的影响较小,而重金属阳离子对吸附铀的抑制作用更强。

