类芬顿氧化法处理二级生化出水双酚A研究
李立军
(广东省交通规划设计研究院集团股份有限公司,广州 510000)
双酚A(BPA)是一种环境类内分泌干扰物质,具有类雌激素,对生物生殖及免疫系统方面具有严重影响[1]。以BPA为原料制备的材料被广泛应用于化工、机电、交通运输、建筑和军事等多个领域[2]。同时,由于其类雌激素性会与雌激素受体有一定的亲和力而被应用于部分禽畜养殖业当中。BPA 的应用广泛,导致生活污水二级生化出水中常出现残留BPA,排入水体影响人类的生存环境和身体健康,因此急需采用相关技术对二级生化出水中的BPA进行处理。
目前,对于BPA 的处理方法主要包括物理法、生物法和化学法[3-5]。化学法主要包括化学沉淀法、氧化法、还原法和电解处理法,其中氧化法以高级氧化法[5]为主,其主要是在外加催化剂、光等作用下产生的羟基自由基(HO·)将酚类等废水中的大分子有机物降解更小的有机物,主要包括臭氧、电催化氧、光、芬顿和类芬顿氧化处理等。类芬顿氧化法是将氧化方法与传统芬顿方法相结合的一种方法,在芬顿法的基础上添加电、光等技术将Fe2+变成铁氧化物或其他金属及金属氧化物与H2O2进行反应,增强芬顿氧化试剂对有机物的氧化降解能力[6]。采用类芬顿氧化法对二级生化出水BPA将起到更好地降解效果。
1 实验部分
1.1 仪器与试剂
离心机,6A/PP4-62 型;液相色谱,Acquity HClass 型;氮吹浓缩仪,APNE-12;恒温加热磁力搅拌器,ZNCL-G240*150型;气相色谱-质谱联用仪(GC-MS),TSQ 9000;pH 计,FE28-Meter型;紫外线灯,UVA-340 nm型。
BPA,优级纯;氢氧化钠,氯化钠,硫酸,亚硫酸钠,六水硝酸钴,硫酸亚铁,双氧水(质量分数30%),过硫酸氢钾,甲醇,二氯甲烷,分析纯;甲醇,色谱纯。
1.2 实验过程
用电子天平称取一定量的BPA(精确至1 mg)加入到盛有纯水的烧瓶中,配成所需含量的溶液,利用HCl 和NaOH 溶液调节溶液pH 至所需要求。在实验装置中准确加入一定量的BPA 溶液并搅拌30 min,之后加入一定量的由Fe2+和H2O2组成的芬顿试剂反应一定时间,取10 mL 样品用Na2SO3/NaNO2进行滴定反应,随后对所取样品在进行完预处理后进行相关指标的分析。
1.3 分析方法
采用液相色谱对反应前后BPA 含量进行检测,用双酚A的降解率作指标。
检测前需对BPA溶液进行预处理,主要包括2个方面:1)配水部分,当水样中BPA的质量浓度<1 mg/L 时,取1.5 mL 的BPA 样品与3.5 mL 的色谱纯甲醇溶液均匀混合后倒入进样瓶待测;2)实际废水部分:取2 mL 的BPA 样品置于离心管中,用离心机在转速12 kr/min下离心5 min;取1.5 mL的上清液样品置于比色管中,将3.5 mL 的色谱纯甲醇溶液和BPA 样品均匀混合后倒入进样瓶待测。当BPA 的质量浓度>1 mg/L 时,需将其稀释处理到标准曲线范围内再进行测样。BPA 溶液标准曲线见图1。

图1 BPA溶液标准曲线Fig 1 Standard curve of BPA solution
氧化中间产物采用GC-MS进行检测。
2 结果与讨论
2.1 Fe2+含量对BPA降解率的影响
在BPA溶液初始质量浓度为500 μg/L,H2O2的质量浓度为50 μmol/L、溶液的初始pH 为7、反应温度为(25±1)℃、氧化反应时间为30 min 的条件下,考察Fe2+的含量对BPA的降解率的影响,结果如图2所示。
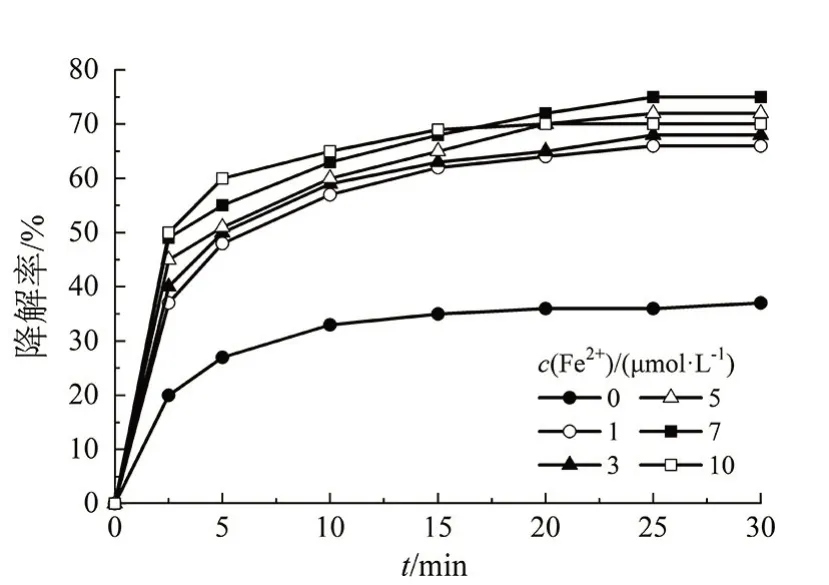
图2 Fe2+含量对BPA降解率的影响Fig 2 Effect of Fe2+content on the degradation rate of BPA
由图2 可知,在Fe2+的含量为0 时,BPA 的降解率很低;随着Fe2+含量的逐渐提高,BPA的降解率逐渐提高,即只有在Fe2+与H2O2协同作用时,才能实现BPA 的高降解。当Fe2+的浓度分别为5、7 μmol/L 时,BPA 的最终降解率最高,分别为75%和78%。当继续增加Fe2+的浓度至10 μmol/L 时,BPA 的降解率在短时间内较高;但是随着时间的增加,BPA的降解率有所下降。
产生上述现象的原因主要有:1)Fe2+的存在会引发链式反应,与H2O2反应产生氧化还原电位较高的HO·,从而实现BPA 的高降解率;2)在H2O2量一定的条件下,可产生的HO·有限,当Fe2+的含量在一定范围内达到饱和后继续提高Fe2+的浓度,会导致部分HO·进行消耗,BPA降解率下降。
2.2 H2O2含量对BPA降解率的影响
在BPA 溶液初始质量浓度为500 μg/L,Fe2+的质量浓度为5 μmol/L、溶液的初始pH 为7、反应温度为(25±1)℃、氧化反应时间为30 min 的条件下,考察析H2O2含量对BPA 的降解率的影响,结果如图3所示。

图3 H2O2含量对BPA降解率的影响Fig 3 Effect of H2O2content on the degradation rate of BPA
由图3可知,随着H2O2含量的增加,BPA的降解率增大,且H2O2对BPA 的降解表现出明显的效果。当H2O2的浓度为30 μmol/L时,BPA的降解率仅为68%;继续增加H2O2的浓度为为200 μmol/L时,双酚A 的降解率为88%;但H2O2的浓度继续增加至600 μmol/L,BPA 的降解率仅增加至89%,即BPA的降解率未随H2O2含量的增加而明显增加。
这主要是因为,H2O2为HO·的载体,HO·的量随着H2O2含量的增加而增加;但是当H2O2含量过高时,HO·会与过量的H2O2反应产生弱氧化能力的HO2·,从而降低类芬顿氧化反应效果,造成BPA 的降解率降低。因此,当H2O2的浓度为50 μmol/L时,即可达到实验期望的BPA的降解率。
2.3 溶液pH对BPA降解率的影响
在BPA 溶液初始质量浓度为500 μg/L、HH2O2的浓度为200 μmol/L、Fe2+的浓度为5 μmol/L、反应温度为(25±1)℃、氧化反应时间为30 min 的条件下,考察溶液的pH对BPA的降解率的影响,结果如图4所示。
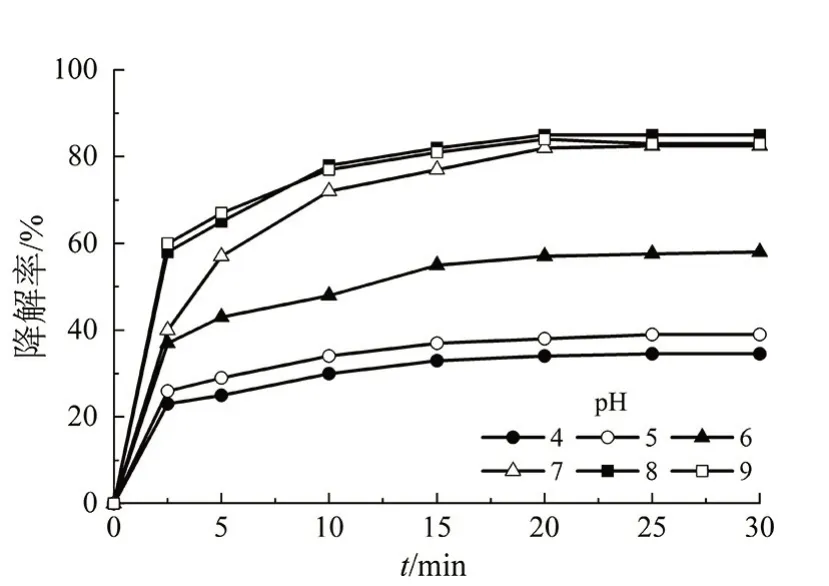
图4 溶液pH对BPA降解率的影响Fig 4 Effect of pH of solution on the degradation rate of BPA
由图4 可知,pH 对BPA 的降解率具有明显的影响,BPA 的降解率随着pH 的增大而增大。但当pH 高于8 时,继续提高pH,BPA 的降解率变化不大。这主要是因为,溶液中存在的Fe2+不稳定,当pH 过高时,Fe2+易被氧化而形成氢氧化铁络合物,导致Fe2+含量减少,抑制HO·的生成,从而导致BPA的降解率降低。但是当pH过低时,如当pH在4~5时,溶液中H+含量过高导致HO·与H+反应生成H2O,阻碍Fe2+的生成,从而抑制整个催化反应。综上所述,当pH 为8 时,BPA 具有较高的降解率。
2.4 反应温度对BPA降解率的影响
在BPA溶液初始质量浓度为500 μg/L、H2O2浓度为200 μmol/L、Fe2+的浓度为5 μmol/L、溶液的初始pH 为8 和氧化反应时间为30 min 的条件下,考察反应温度对BPA的降解率的影响,结果如图5所示。
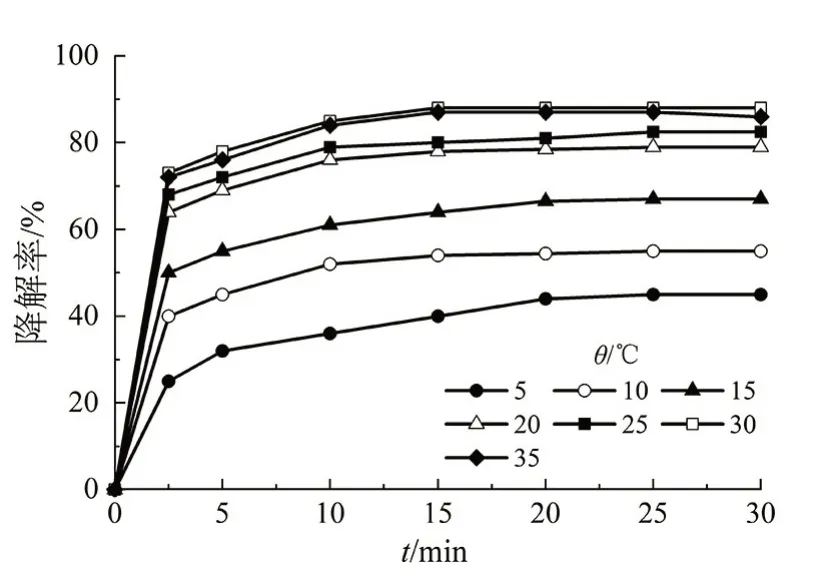
图5 反应温度对BPA降解率的影响Fig 5 Effect of reaction temperature on the degradation rate of BPA
由图5可知,BPA降解率随着反应温度的升高而增大。当反应温度为30 ℃时,降解率最大,为88%;但是当反应温度超过30 ℃后,BPA 降解率无较大变化。这主要是因为化学反应速率随温度的升高而加快;但是当反应温度过高时,H2O2产生分解,从而降低HO·的产率,导致类芬顿氧化降解能力降低,BPA降解率下降。
2.5 初始BPA含量对BPA降解率的影响
在H2O2浓度为200 μmol/L、Fe2+的浓度为5 μmol/L、反应温度为30 ℃、溶液的初始pH 为8、氧化反应时间为30 min 的条件下,考察溶液初始BPA含量对其降解率的影响,结果如图6所示。

图6 初始BPA含量对其降解率的影响Fig 6 Effect of initial content of BPA on its degradation rate
由图6 可知,在H2O2和Fe2+的量一定的条件下,BPA 的降解率随着初始BPA 含量的升高而下降。这主要是因为H2O2的量一定,产生的HO·量也一定,限制了BPA 的去除,导致BPA 的降解率随初始BPA含量的增加而降低。
2.7 中间产物分析
在采用类芬顿氧化法处理BPA 的过程中,检测出的中间产物如表1所示。

表1 类芬顿氧化法处理BPA的中间产物Tab 1 Treatment of BPA intermediates by Fenton-like oxidation
由表1可知,共检测出6种中间产物,这与类芬顿氧化法的反应机理有关。类芬顿氧化法处理BPA主要是H2O2会在Fe2+的催化作用下HO·与BPA进行反应,从而将BPA 逐步氧化为小分子化合物,使BPA进行降解。
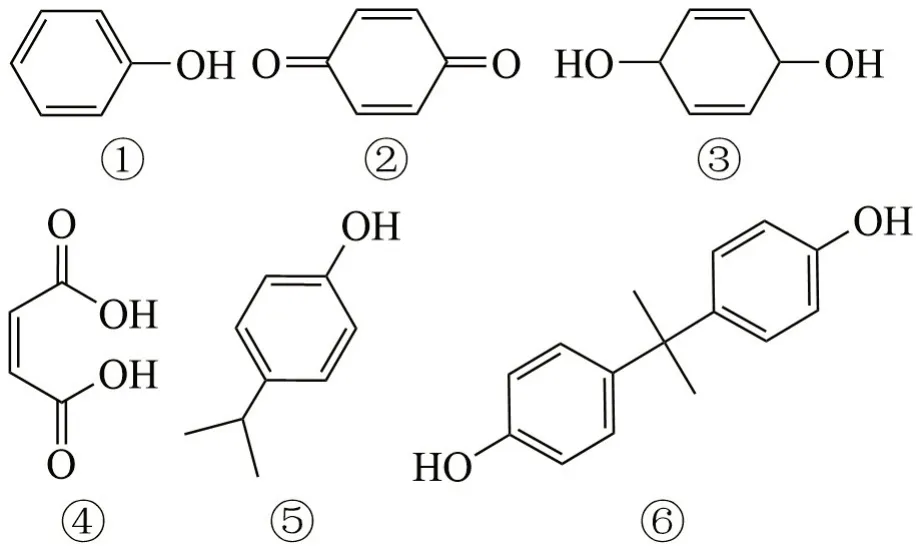
Fe2+催化H2O2生成的HO·破坏了BPA 的结构,从而形成一系列苯酚类小物质中间产物。在HO·的存在下,对二苯酚会进一步被氧化生成苯酚和对苯醌,对苯醌在HO·的存在下结构被破坏,生成顺丁烯二酸,最终被降解氧化。
3 结 论
通过以上反应可知,在采用类芬顿氧化法处理BPA 的过程中,在紫外光辐照作用下,当H2O2、Fe2+的摩尔比为10、溶液初始的pH 为8 时,类芬顿氧化法对BPA 的处理效果最好,同时,在一定的温度范围内,BPA 的降解率随反应温度的升高而增大。
实验中BPA 水溶液的质量浓度为500 μg/L时,实验的优化条件为:当Fe2+的浓度5 μmol/L,H2O2的浓度200 μmol/L、pH为8、反应温度30 ℃。
处理BPA 的过程中会形成苯酚、对二苯酚等中间产物,并在羟基自由基的作用下进一步分解。实验成果可应用于生产污水处理厂中二级生化出水残留BPA的处理。

