饲料中添加复合胆汁酸对皮质酮诱导的肉鸡脂肪肝综合征的缓解作用研究
胡丹,郝燕青,陈渠,邬晓婷,倪迎冬
(南京农业大学动物医学院/农业农村部动物生理生化重点实验室,江苏 南京 210095)
脂肪肝综合征(fatty liver syndrome,FLS)是一种常见的家禽代谢性疾病,其发病机制与病理症状与哺乳动物非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)十分相似[1]。为了增加肉鸡生长性能和养殖效益,近年来肉鸡饲料中油脂添加量有增加趋势,更易发生脂肪肝综合征。患病鸡肝脏出现严重的脂肪沉积,导致肝脏破裂出血,从而出现突然死亡现象[2-3]。脂肪肝综合征已成为笼养鸡非感染性死亡的主要原因之一,约有75%的笼养肉鸡死亡与FLS有关[4]。因此,家禽脂肪肝的致病机制和防治技术研究成为热点研究之一。
皮质酮(corticosterone,CORT)是禽类体内一种有活性的糖皮质激素(glucocorticoid,GC)。GC水平过高可诱发机体代谢紊乱,包括Ⅱ型糖尿病、骨骼肌流失、血脂异常、向心性肥胖和肝脏中甘油三酯过度沉积等[5-6]。作为调控机体脂代谢的重要激素,CORT通过糖皮质激素受体(glucocorticoid receptors,GR)动员组织从头合成脂肪酸,增加外周循环中的游离脂肪酸水平[7]。肝脏摄入的脂肪酸增多,促进甘油三酯的合成,产生脂质沉积,最终诱发脂肪肝。慢性应激或长期高水平CORT暴露与脂肪肝进展和炎症反应密切相关[8]。
胆汁酸(bile acid,BA)是由肝脏合成后分泌到消化道中的一类物质,在十二指肠中促进脂类物质及脂溶性维生素的吸收。此外,BA作为信号分子可通过与法尼酯 X 受体(farnesoid X receptor,FXR)和G 蛋白偶联胆汁酸受体1(G protein-coupled bile acid receptor 1,GPBAR1/TGR5)来调节机体葡萄糖和脂质代谢[9-10]。临床研究表明,NAFLD的发生伴随着胆汁酸稳态及其相关信号通路的紊乱,通常表现为初级胆汁酸增加,而次级胆汁酸减少[11-12]。因此,与BA相关的信号通路被认为是治疗哺乳动物NAFLD的靶点。近年来,对家禽的研究表明,饲料中添加BA可促进肉鸡生长,可能与肠上皮细胞消化酶的活性升高有关[13-14]。在摄入不同能量水平日粮的情况下,饲喂BA能显著降低肉鸡的料重比,降低血清中甘油三酯水平,并改善肝脏中的脂代谢状态[15]。然而,目前有关饲喂胆汁酸对家禽FLS缓解作用与机制的研究尚未见报道。因此,本研究以AA肉鸡为动物模型,通过注射CORT诱导FLS,以探索饲料中添加BA对FLS的缓解作用及机制,为家禽脂肪肝综合征研究与防治提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验试剂胆汁酸由山东龙昌动物保健品技术有限公司生产,组成成分主要是猪脱氧胆酸(70.67%)、鹅脱氧胆酸(19.61%)和猪胆酸(8%)[13]。组织甘油三酯检测试剂盒购于北京普利莱基因技术有限公司;血液生化检测试剂盒购于美康生物科技股份有限公司;4%多聚甲醛购自南京建成科技有限公司;TRIzol 试剂购于北京擎科生物科技有限公司;RT-qPCR试剂盒和反转录试剂盒均购于武汉爱博泰克生物科技有限公司;引物由北京擎科生物科技有限公司合成;细胞组织 RIPA 裂解液、增强型ECL化学发光液、蛋白酶抑制剂均购于武汉爱博泰克生物科技有限公司;BCA蛋白检测试剂盒购于北京索莱宝科技有限公司;硝酸纤维素膜购于南京迈博生物科技有限公司。
1.1.2 试验仪器试验仪器包括:全自动生化分析仪(7020,HITACHI);全波长多功能酶标仪(Synergy 2,BioTek);全自动化学发光图像分析系统(5200,Tanon);微量核酸检测仪(Nanodrop 2000,Thermo);实时荧光定量 PCR 仪(QuantStudio 6 Flex,Applied Biosystems);光学显微镜(Olympus-BX53)。
1.2 试验设计与日粮
1.2.1 动物饲养与管理试验选取120只1日龄雄性AA肉鸡,随机分为2组,分别饲喂基础日粮和添加BA的日粮。胆汁酸的添加分为3个阶段:3~7日龄(前期),剂量(每只鸡)为4、7、10、13、16 mg·d-1;17~21日龄(中期),剂量为18、19、20、21、22 mg·d-1;31~35日龄(后期),剂量为28、29、30、31、32 mg·d-1。采用笼养方式饲养,1~3日龄,饲养室内温度为32~34 ℃,随后以每周2~3 ℃的速度降低温度,直到第35天的21~22 ℃。按常规程序进行免疫接种。全天光照,自由饮水和采食。
1.2.2 皮质酮处理28日龄时从饲喂基础日粮的肉鸡中随机选取20只,随机分为对照组(CON),皮质酮注射组(CORT);从胆汁酸组随机选取10只进行皮质酮注射(CORT+BA)。CORT组和CORT+BA组肉鸡皮下注射4 mg·kg-1皮质酮(溶解于含15%乙醇的PBS溶液中),连续注射7 d,CON组注射等量含15%乙醇的PBS溶液。于40日龄时结束试验,进行采样。

表1 日粮营养成分Table 1 The nutrient component of the diet g·kg-1
1.3 测定指标与方法
1.3.1 生长情况与样品采集采样前(40 d)称肉鸡体重,禁食12 h后屠宰采样。采集颈部动静脉混合血液,在4 ℃条件下3 500 r·min-1离心20 min,将分离的血清置于EP管中,于20 ℃冰箱内储存。采集肝脏组织样及分子样,使用4%多聚甲醛缓冲液固定组织样,分子样迅速放入液氮中,采样结束后转移至-80 ℃冷冻保存。
1.3.2 组织器官发育采集完整的肝脏称重,以器官重占肉鸡活体重的相对量来表示器官指数(g·kg-1)。采集全部的腹部脂肪组织、腿肌组织称重,以组织重占肉鸡活体重的相对量来表示组织所占百分比(%)。
1.3.3 血液生化指标检测血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、葡萄糖(GLU)、总胆固醇(TCHO)、高密度脂蛋白(HDLC)、低密度脂蛋白(LDLC)、游离脂肪酸(NEFA)、甘油三酯(TG)使用全自动生化分析仪以及相对应的试剂盒检测。
1.3.4 HE染色和油红O染色对部分肝脏组织使用4%多聚甲醛缓冲液进行固定,切片,进行HE和油红O染色,每组6个。使用光学显微镜对切片进行观察和拍摄,观察组织形态与脂滴分布和大小。
1.3.5 总RNA提取提取肉鸡肝脏组织总RNA,检测并统一浓度后反转录为cDNA,通过实时荧光定量PCR(RT-qPCR)检测肝脏中脂肪合成、分解和转运相关mRNA的相对表达量。引物序列见表2。

表2 荧光定量PCR引物序列Table 2 Sequence used for real-time PCR
1.3.6 Western blot检测称取肝脏样品约30 mg,按1∶10的比例加入RIPA裂解缓冲液后匀浆。匀浆后样品在 4 ℃条件下12 000 r·min-1离心20 min。收集上清液,使用Pierce BCA蛋白测定试剂盒测定蛋白浓度。变性蛋白样品(30 μg 蛋白)经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳检测。随后将蛋白转印至硝化纤维素膜上,以50 g·L-1脱脂奶粉室温封闭2 h,一抗4 ℃孵育过夜,用TBST洗膜后与二抗反应2 h。洗涤后,使用增强化学发光试剂,避光孵育后放入全自动化学发光图像分析系统中进行图像采集。以GAPDH作为内参。利用Image J软件对条带灰度进行量化分析。抗体信息见表3。

表3 Western blot检测所用抗体信息Table 3 Information of antibody used for Western bolt
1.3.7 数据统计与分析所有结果以平均值±标准误表示,各组间显著性差异采用SPASS 19.0软件进行单因素方差(One-Way ANOVA)分析,采用LSD法进行多重比较。
2 结果与分析
2.1 肉鸡体重、器官重及器官指数变化
由表4可知:与对照组相比,CORT注射对肉鸡体重、肝重和肝脏指数无显著影响(P>0.05),但显著降低肉鸡的腿肌重,显著增加了腹脂重及腹脂率(P<0.05)。BA能缓解由CORT引起的腿肌重的减少和腹部脂肪的增加(P<0.01),同时显著增加腿肌率(P<0.05)。提示BA可改善CORT引起的肉鸡腹部脂沉积和腿部肌肉流失。
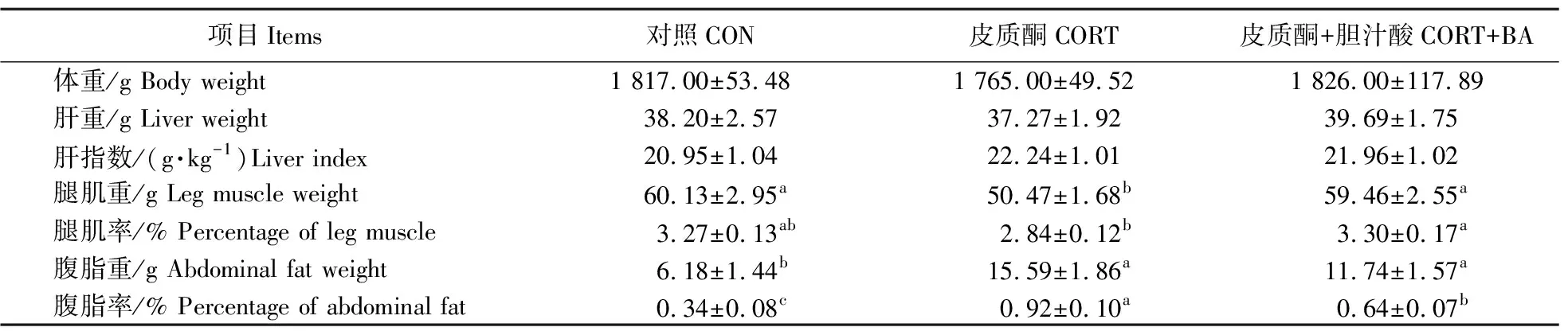
表4 不同处理肉鸡体重、器官重和器官指数变化Table 4 Changes of body weight,organ weight and organ index in broilers under different treatments
2.2 肉鸡血清中相关生化指标变化
由表5可知:对照组相比,CORT组肉鸡血清中ALT活性、GLU、TCHO和TG水平均无显著变化(P>0.05),但HDLC和LDLC水平显著降低,而NEFA水平显著升高(P<0.05)。BA处理显著提高了血液HDLC水平(P<0.05)。以上结果表明,CORT处理引起机体脂质代谢的紊乱,而BA处理可改善脂代谢。

表5 不同处理肉鸡血清中相关生化指标变化Table 5 Changes of biochemical indexes in serum of broilers under different treatments
2.3 肉鸡肝脏TG含量变化
由图1可知:HE染色结果表明CORT处理组肉鸡肝脏组织松散,存在明显的脂滴空泡;油红染色结果进一步显示CORT处理组肝脏内有大面积的脂滴分布,生化检测结果显示肝脏TG水平显著上升(P<0.01)。而BA添加显著降低了肝脏中TG水平,改善了肝脏脂肪沉积现象(P<0.05)。表明胆汁酸可缓解皮质酮引起的肉鸡脂肪肝综合征现象。
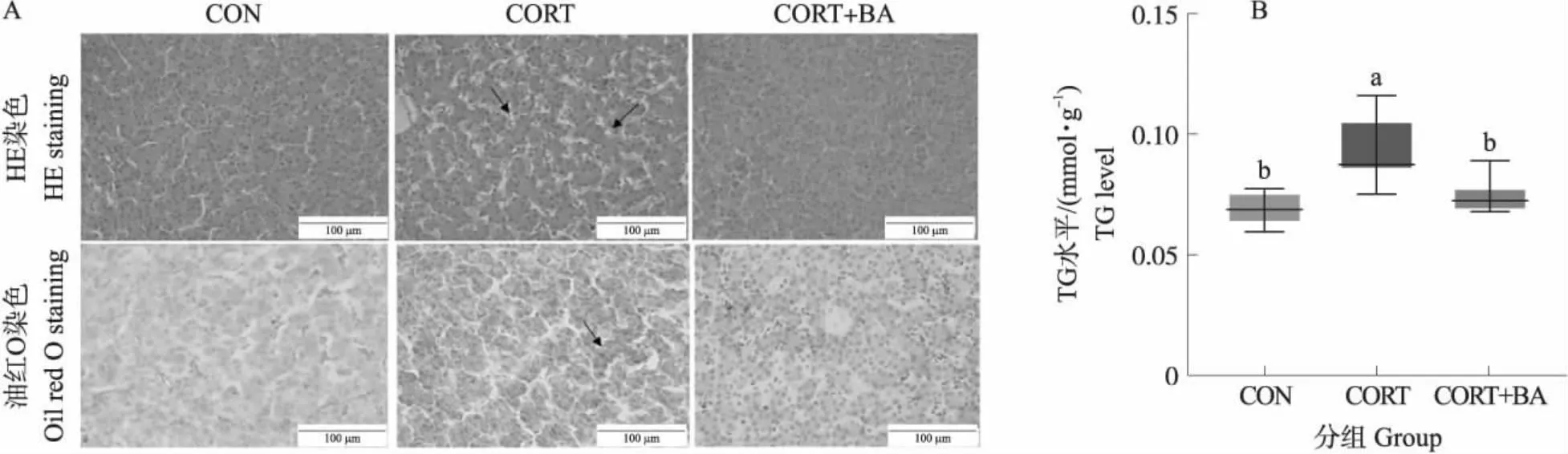
图1 不同处理肉鸡肝脏内甘油三酯水平的变化Fig.1 HE and oil red O staining of liver tissue and hepatic TG level in broilers under different treatments
2.4 肉鸡肝脏脂代谢相关基因表达变化
由图2可知:CORT显著上调肉鸡肝脏中脂肪合成关键酶硬脂酰辅酶A去饱和酶(cd1)和乙酰辅酶A羧化酶(acc)的基因表达(P<0.05)。BA添加后降低了scd1及acc的基因表达量(P<0.05),且显著增加了脂肪酸β氧化关键酶肉毒碱棕榈酰基转移酶(cpt1a)基因表达量(P<0.05)。与对照组相比,CORT和CORT+BA组肝脏中脂肪酸合成酶(fasn)、固醇调节元件结合转录因子1(srebf1)、过氧化物增殖激活受体(pparα)及脂蛋白脂肪酶(lpl)的mRNA表达量无显著差异(P>0.05)。提示饲料中添加BA显著抑制由CORT诱导的肝脏TG合成。

图2 不同处理肉鸡肝脏脂代谢关键基因表达变化Fig.2 Changes of gene expression involving in hepatic lipid metabolism in broilers under different treatments
2.5 肉鸡肝脏脂代谢相关蛋白表达变化
由图3可知:BA显著缓解了由CORT引起的肝脏脂肪合成有关蛋白FASN和ACC的表达上调,以及脂肪酸氧化分解相关转录因子PPARα的蛋白表达水平下调(P<0.05);与CORT组相比,CORT+BA组肝脏中脂肪酸转移酶(CD36)的蛋白表达水平显著降低(P<0.05)。提示:CORT处理促进肉鸡肝脏中脂肪酸从头合成蛋白的表达,抑制脂肪酸的β氧化,而胆汁酸处理能抵抗CORT的上述作用,并抑制肝脏对外周游离脂肪酸的吸收。

图3 不同处理肉鸡肝脏脂代谢关键蛋白表达变化Fig.3 Changes of protein expression involving in hepatic lipid metabolism in broilers under different treatments A—C. 蛋白免疫印迹条带Protein blotting;D—G. 肝脏脂代谢关键蛋白表达水平Expression levels of key protein involving in lipid metabolism in liver.
3 讨论
外源性CORT注射可诱导家禽肝脏中脂质异常积聚和炎症反应,从而发展为脂肪肝综合征[8,16]。CORT通过GR动员组织从头合成脂肪酸,增加循环中的游离脂肪酸水平引发肝脏脂肪沉积增加。机体中糖皮质激素水平过高会促进肝外组织,尤其是肌肉组织蛋白的分解,导致肌肉萎缩。本研究采用皮质酮注射后同样引起了肉鸡腹部脂肪堆积,腹脂重和腹脂率显著升高,外周血液中游离脂肪酸水平显著升高,同时腿肌重显著降低,与之前的研究结果相吻合[17-18]。已有研究[13,15]表明,饲料中添加BA可减少腹脂沉积并增加胸肌重。本研究结果显示,饲料中添加BA不影响皮质酮引起的脂肪酸动员,但可显著缓解由皮质酮诱导的腹脂沉积和肉鸡的腿肌重和腿肌率降低,因此可能加速了肌肉组织而非脂肪组织对脂质的储存及转化。此外,BA添加使血清中HDLC水平著显著升高,提示对脂类代谢的有益作用。
当肝脏中脂质的合成速率超过其分解速率时,肝脏中出现脂质过载,产生脂质沉积,最终诱发脂肪肝[19]。在本研究中,尽管CORT处理组肉鸡肝重和肝指数无显著变化,但肝脏内出现了较多的脂滴空泡,油红O染色显示有大面积的脂滴分布,同时肝脏TG水平显著上升。而添加BA显著改善了肝脏中脂肪变性,降低了TG沉积。研究表明 GR 可以靶向结合到脂代谢相关基因启动子区域调节其转录表达,GC处理导致大鼠肝脏TG升高,主要是因为促进了脂肪酸从头合成过程[20-21]。在家禽中,CORT处理可以通过促进脂肪酸合成关键基因acc、fasn、scd1和sredf1的去甲基化修饰来促进其表达[22]。因此,为了进一步探究BA缓解肉鸡肝脏脂肪沉积的作用机制,我们检测了肝脏中与脂质合成、分解及转运有关的基因和蛋白的表达。
FASN、ACC、SCD1是调控肝脏中脂肪酸从头合成的关键酶,分别催化脂肪酸从头合成、长链脂肪合成以及单不饱和脂肪酸的合成。研究表明利用药物或者基因缺失等方式抑制这3种关键酶的合成,可有效改善糖尿病或基因模型小鼠的肝脏脂肪变性以及脂质代谢紊乱[23-25]。因此,抑制肝脏脂肪生成可能是缓解肝脏脂肪变性相关疾病的有效手段。本研究结果显示,饲料中添加BA显著抑制皮质酮引起的肝脏中scd1和scc基因表达及FASN和ACC蛋白表达的上调,从而抑制肝脏的脂质合成。BA对脂代谢的调控主要是通过激活受体实现的,其中FXR受体的激活在BA诱导的糖脂代谢调控中起关键作用。FXR可通过调节下游靶点PPARα来促进肝脏脂肪酸β氧化[10]。PPARα是一种转录因子核受体,对脂肪合成、脂肪酸氧化及运输等代谢途径具有转录调节活性[26-27]。研究发现PPARα的下游靶点包括CPT1a、SCD1和CD36等[28]。PPARα对CPT1a和CD36基因的表达具有正向调控作用,从而影响脂肪酸转运和吸收过程。CPT1a位于线粒体外膜,将脂肪酸从细胞质转移到线粒体中进行β氧化,是脂肪酸氧化分解的限速酶[29]。CD36为脂肪酸转位酶在大部分组织都有表达,在促进长链脂肪酸的摄取和细胞内运输中起着重要作用[30]。在脂肪肝患者和动物脂肪肝模型中CD36表达显著增加,而CD36敲除鼠对高脂引起的肝脏脂肪沉积具有抵抗作用[31-32]。本研究结果显示,饲料中添加BA显著上调了肉鸡肝脏中PPARα蛋白的表达和cpt1amRNA的表达。相对于CORT组,CORT+BA组中肝脏CD36蛋白的表达显著下调。因此,BA对肝脏脂肪沉积的缓解作用是通过抑制脂肪酸合成、促进脂肪酸氧化分解并抑制肝脏对外周脂肪酸的吸收实现。
BA可直接激活蛋白激酶诱导小异源二聚体伴侣受体(SHP)发生磷酸化,经过一系列分子级联反应导致代谢靶基因的抑制性修饰,降低肝脏中TG水平[33]。此外,BA还可激活磷酸鞘氨醇受体(S1PR2)调控脂代谢,喂食HFD的s1pr2敲除小鼠的肝脏脂质积累增加[34]。在肠道中,BA受体FXR的激活,可通过FXR-FGF15/19-SHP轴使肝脏中FASN发生DNA甲基化修饰,抑制脂肪合成[35]。因此,在CORT处理下,BA所引起变化的相关机制还有待进一步研究。
总之,本研究表明日粮中添加BA可通过对肝脏脂代谢关键基因和蛋白表达的调控,通过减少脂质合成,促进脂肪酸分解,抑制肝脏对脂肪酸摄取,缓解由皮质酮注射引起的肉鸡肝脏脂肪沉积。本研究为BA在家禽养殖中的合理使用提供了试验依据,对改善肉鸡健康,提升动物福利有重要意义。

