不同包被缓释尿素的瘤胃缓释效果的评价
曹力文,冯春燕,温世宝,郑文金,申军士*,毛胜勇,朱伟云
(1.国家动物消化道营养国际联合研究中心/南京农业大学动物科技学院消化道微生物研究室,江苏 南京 210095; 2.上海美农生物科技股份有限公司,上海 201807)
随着我国畜牧业的快速发展,优质饲料资源长期短缺,特别是蛋白质饲料资源短缺成为制约我国畜牧业发展的瓶颈。对于反刍动物来说,瘤胃微生物可以利用非蛋白氮作为氮源合成微生物蛋白,微生物蛋白在进入消化道后被消化、吸收,满足反刍动物机体的生长或生产需要[1-2]。因此,在反刍动物日粮中添加部分非蛋白氮可以达到减少对优质蛋白质饲料原料依赖的目的。尿素因其含氮量高、价格低廉、易于制取等优势,成为非蛋白氮饲料中的主导品种[3]。但尿素进入瘤胃后很快就会在瘤胃微生物所分泌脲酶的作用下水解为氨和二氧化碳,当日粮中尿素水平过高时,会使产氨的速度超过瘤胃微生物利用氨的速率,造成瘤胃内氨的积累[4-5]。多余的氨通过瘤胃上皮吸收入血到达肝脏,在肝脏尿素循环的作用下重新转化为尿素,最终大部分随尿液排出体外,造成尿素氮的浪费和对环境的污染[6-7]。缓释尿素技术可以减缓氨的释放速度,使能氮的释放更加趋于同步,提高瘤胃微生物对尿素氮的利用效率[8]。包被缓释尿素是目前最新的尿素缓释技术,多使用天然聚合物对尿素进行包被,具有缓释性佳、安全性高、适口性好等优点[9]。目前市售包被缓释尿素产品众多,但其质量良莠不齐,缓释效果不一。本研究通过体外发酵、体内瘤胃灌注和持续动态人工瘤胃模拟3个试验,逐步模拟真实生产中的瘤胃环境,探究缓释尿素在不同场景中的缓释效果及其对瘤胃氨浓度、发酵参数和微生物蛋白合成的影响,旨在为缓释尿素产品的有效利用提供理论依据。
1 材料与方法
1.1 体外发酵试验
1.1.1 试验动物及材料选取市面常见的1种常规饲料级普通尿素和4种商业包被缓释尿素(A、B、C、D),使用凯氏定氮法测定其含氮量。具体尿素含氮量见表1。发酵底物为4 g全混合饲料(青贮玉米,20%;花生秧,20%;玉米,27%;豆粕,13%;干酒槽及其可溶物(DDGS),11%;麸皮,5%;碳酸氢钠,1%;预混料,3%,以上均为质量分数)。瘤胃液供体为南京农业大学实验动物中心4只体况良好、体重相近(平均25.0 kg)的安装有瘤胃瘘管的公湖羊,日粮为精粗比60∶40(质量比)的全混合日粮(日粮组成与发酵底物相同),每日08:00和18:00饲喂,自由饮水。
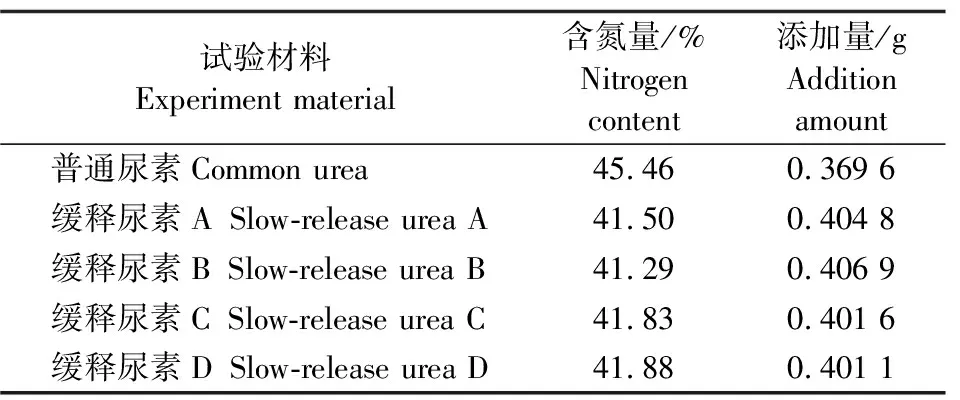
表1 普通尿素和各缓释尿素的含氮量及添加量Table 1 Nitrogen content and urea supplementation dose of common urea and slow-release urea
1.1.2 试验设计采用单因素试验设计,共分为5个组,每组4个重复。在1 000 mL发酵瓶中分别添加等氮含量的普通尿素和缓释尿素A、B、C、D。具体尿素添加量见表1。
1.1.4 样品采集分别在发酵0、1、3、6、9、12、24 h时采集2 mL发酵液,保存于-20 ℃冰箱用于氨氮浓度的测定。
1.2 瘤胃灌注试验
1.2.1 试验动物及材料试验原料为体外发酵试验所用普通尿素和4种缓释尿素中缓释效果最好的包被尿素(缓释尿素A)。灌注对象为12只体况良好、体重相近[(27.6±2.37)kg]的安装有瘤胃瘘管的公湖羊,随机平均分为2组,分别灌注普通尿素和缓释尿素。湖羊日粮为精粗比60∶40(质量比)的全混合日粮(日粮组成与体外发酵试验的发酵底物相同),每日08:00和18:00饲喂,自由饮水。
1.2.2 试验设计采用单因素试验设计,试验分为2个处理,分别灌注普通尿素(普通尿素组)和缓释尿素A(缓释尿素组)。普通尿素灌注剂量为湖羊日均干物质采食量的0.5%(统计试验前7 d动物的采食量来计算确定尿素灌注量)。灌注剂量见表2。普通尿素和缓释尿素灌注剂量计算公式如下:
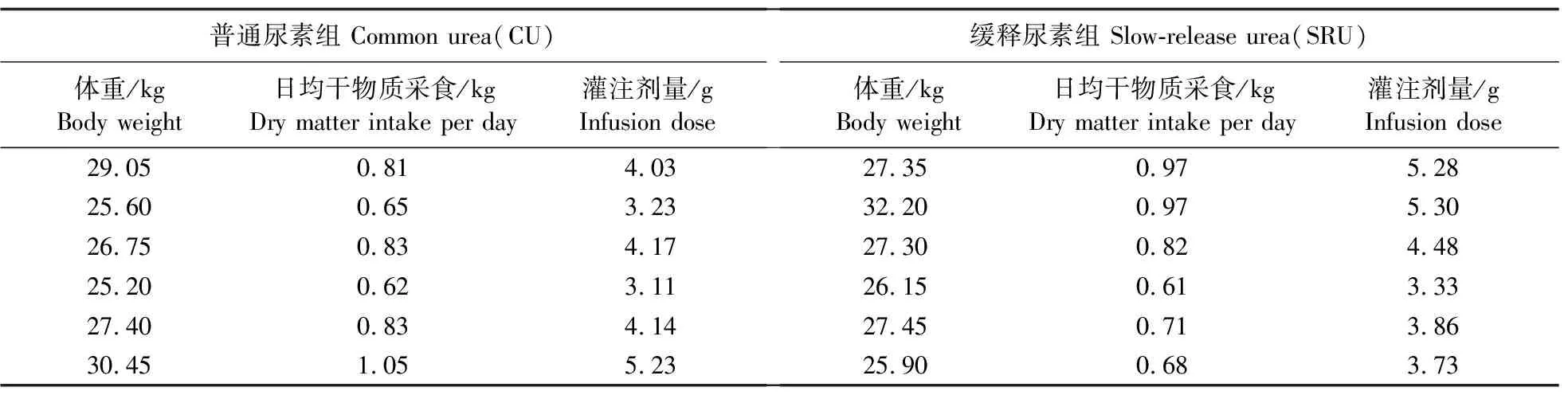
表2 育肥湖羊日均采食量和尿素灌注剂量Table 2 Dry matter intake and urea infusion dose of fattening Hu sheep
普通尿素组:灌注剂量(g)=日均干物质采食量(kg)×1 000×0.5%;
缓释尿素组:灌注剂量(g)=普通尿素组灌注剂量(g)×45.46%(普通尿素含氮量)/41.5%(缓释尿素A含氮量)。
1.2.3 尿素灌注和样品采集晨饲后2 h(10:00)通过瘤胃瘘管将尿素颗粒直接投入瘤胃内,并将尿素颗粒和瘤胃内容物充分混匀。在灌注前0 h和灌注后1、3、6 h分别采集50 mL 瘤胃液,用pH计测定pH值后保存于-20 ℃冰箱,用于氨氮浓度的测定。
1.3 人工瘤胃试验
1.3.1 人工瘤胃装置运行参数本研究所用持续动态人工瘤胃系统由沈维军等[11]在2012年研制的基础上改进而来,包括发酵装置、溢流装置、液体供应组件、数据检测组件和主控机构5部分。参照伍梦楠等[12]的方法设置运行参数。
1.3.2 瘤胃液来源及材料试验原料为体外发酵试验所用普通尿素和4种缓释尿素中缓释效果最好的包被尿素(缓释尿素A)。瘤胃液采自北京畜牧兽医所昌平基地内3只体况良好的荷斯坦奶牛。奶牛日粮为精粗比50∶50(质量比)的全混合日粮(青贮玉米,50%;豆粕,9.5%;棉籽,4.5%;菜粕,2%;DDGS,5%;喷浆玉米皮,2.4%;玉米粉,22.5%;石粉,0.7%;食盐,0.5%;氧化镁,0.3%;磷酸氢钙,0.3%;脂肪粉,1%;小苏打,0.8%;预混料,0.5%,以上均为质量分数)。每日09:00和21:00两次添加日粮作为发酵底物。
1.3.3 试验设计试验共分为3个发酵处理组,分别为:基础日粮+豆粕(普通日粮组)、基础日粮+普通尿素(普通尿素组)和基础日粮+缓释尿素(缓释尿素组),使用玉米补充普通尿素和缓释尿素组能量的缺乏。试验共重复进行3次,每次发酵持续7 d,前4 d为适应期,后3 d为采样期。试验日粮配方见表3。发酵过程始终保持在39 ℃恒温下进行,缓冲液以60 mL·h-1的恒定速率流入发酵罐内,每日09:00和21:00向发酵罐中加入20 g饲料。
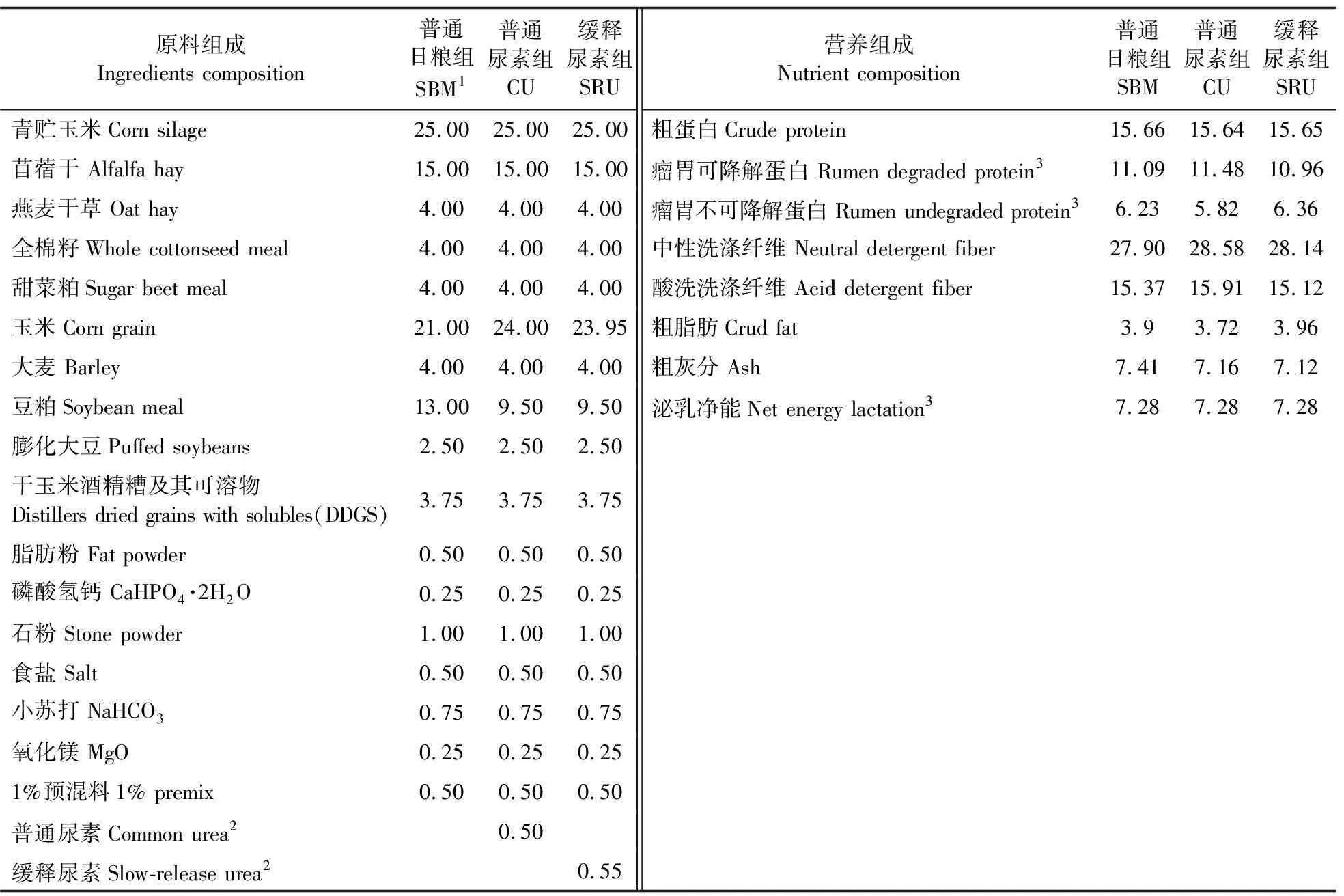
表3 试验日粮原料组成和营养组成Table 3 Ingredient and nutrient composition of the experimental diets %
1.3.4 瘤胃液接种试验开始前24 h将机器调试完好并在每个发酵罐中放入500 mL发酵缓冲液并预热,发酵缓冲液参照McDougall[13]经典配方配制。晨饲后2 h通过瘤胃瘘管采集瘤胃液,使用4层纱布过滤后倒入保温壶进行保温并迅速带回实验室接种。向每个发酵罐中加入500 mL过滤后的瘤胃液,接种完成后立即加入20 g饲料。
1.3.5 样品采集采样期每日09:00加料前后选择不同时间点进行采样。在加料前(0 h)和加料后1、2、4、7、12 h分别采集发酵液20 mL,用pH计测定pH值后保存于-20 ℃冰箱,用于氨氮浓度的测定。于加料前(0 h)和加料后4 h额外采集20 mL发酵液,保存于-20 ℃冰箱,用于挥发性脂肪酸浓度的测定。于加料前(0 h)和加料后12 h分别采集10 mL溢流液,保存于-20 ℃冰箱,用于微生物蛋白浓度的测定。
1.4 发酵参数的测定
尿素含氮量的测定:参照张丽英[14]的方法,取适量尿素加入10 mL浓硫酸,420 ℃消煮3 h后使用凯氏定氮仪测定样品含氮量。饲料常规成分的测定:将饲料样在65 ℃环境下烘干,粉碎后过40目筛,参照张丽英[14]的方法,在(105±2)℃烘箱中将饲料样烘干至恒重,以测定饲料中水分含量;取适量饲料样进行消煮后使用凯氏定氮仪测定饲料中粗蛋白含量;采用索氏脂肪提出器用乙醚抽提饲料样以测定饲料中粗脂肪含量;将饲料样放入马弗炉中经550 ℃灼烧以测定饲料中粗灰分含量;分别将中性洗涤剂和酸性洗涤剂加入纤维分析仪中测定饲料中中性洗涤纤维和酸性洗涤纤维含量。氨态氮浓度的测定:取发酵液样品流水解冻,参照Chaney等[15]的方法,以氯化铵为标准品,用比色法进行氨态氮浓度的测定。挥发性脂肪酸的测定:参照秦为琳[16]的方法进行挥发性脂肪酸的测定。取待测样品,经流水解冻后,4 ℃,12 000 r·min-1离心10 min,上清液经0.22 μm针式过滤器过滤后使用气相色谱仪(岛津GC-2014C)进行测定,其中柱温130 ℃,汽化温度180 ℃,检测温度180 ℃,压力为60 kPa,氢气压力为50 kPa,氧气压力50 kPa。
1.5 数据处理与分析
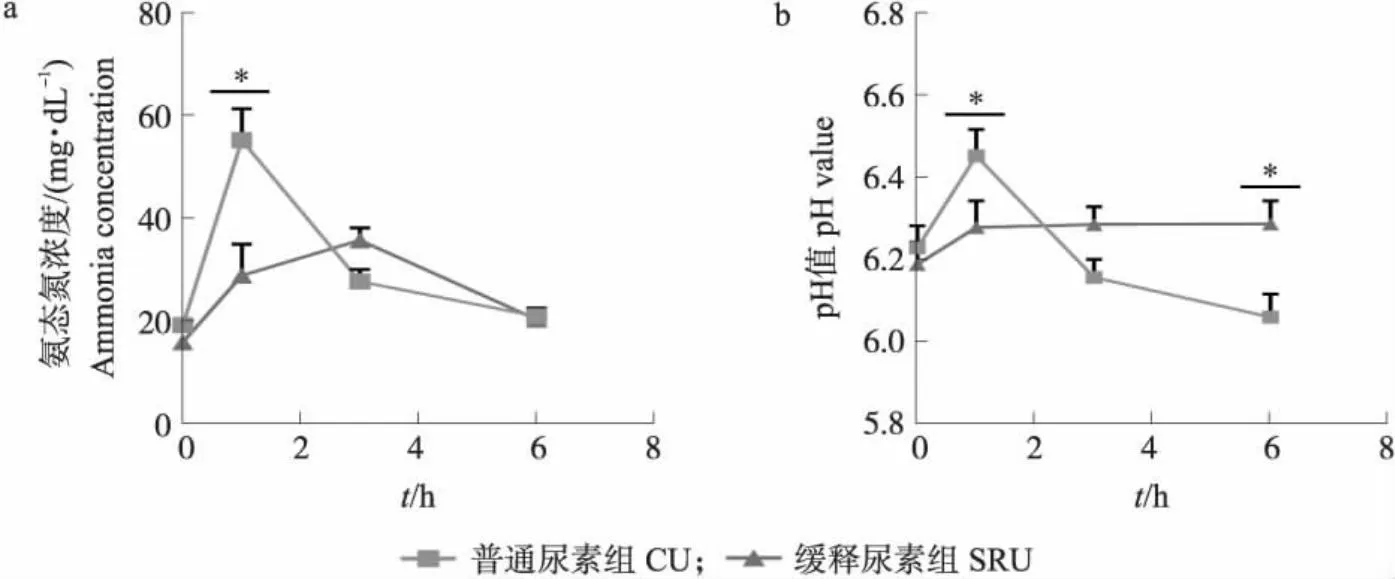
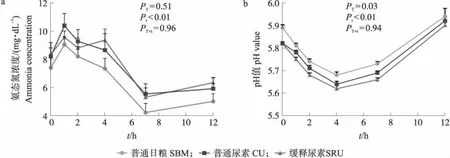
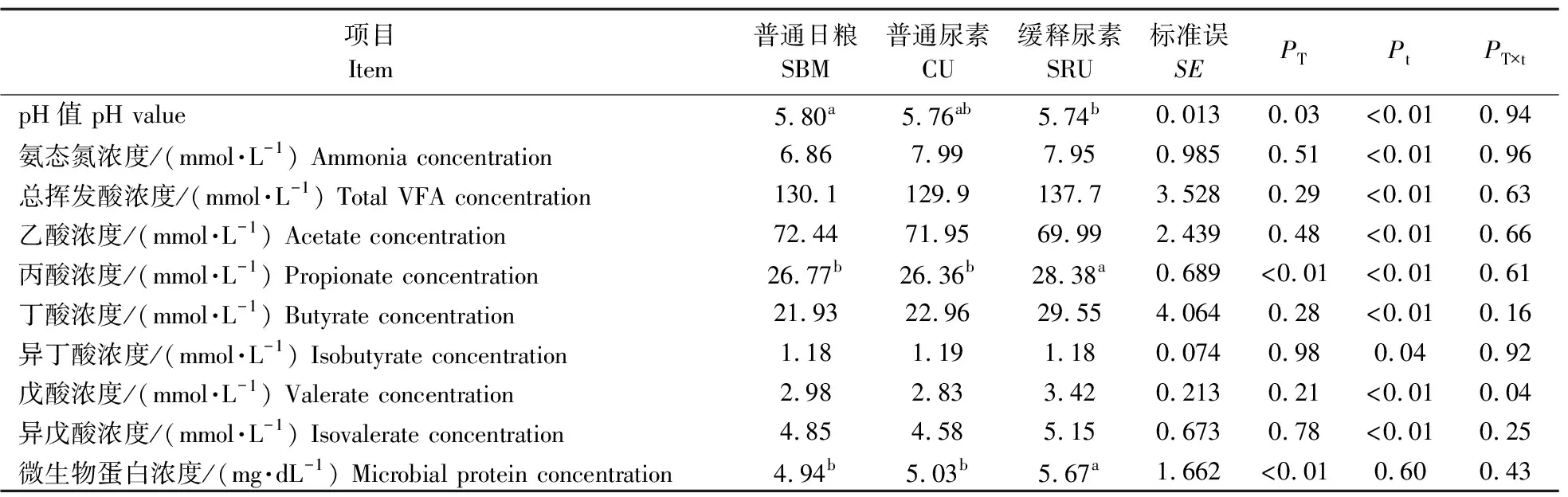
体外发酵试验数据使用SPSS 23.0软件进行分析,因时间和处理的交互作用显著,通过单因素方差分析(ANOVA)检验比较每个时间点的组间差异,再使用LSD法进行多重比较。瘤胃灌注试验数据使用SPSS 23.0软件进行分析,因时间和处理的交互作用显著,通过独立样本t检验比较每个时间点两组间的差异。人工瘤胃试验的数据采用SAS 9.4软件混合模型进行分析,处理、采样时间和采样时间与处理的交互作用作为固定效应。P≤0.05表示差异显著,0.05 由图1可知:在体外发酵的前12 h,不同处理组的氨释放速率不同。在发酵3 h时,缓释尿素A组和缓释尿素C组的氨态氮浓度均显著低于普通尿素组(P<0.05)。在发酵的9、12 h,缓释尿素A组和缓释尿素D组的氨态氮浓度均显著低于其他3组(P<0.05),且缓释尿素A组的氨态氮浓度显著低于缓释尿素D组(P<0.05)。 图1 不同处理对体外发酵氨态氮浓度动态变化的影响Fig.1 Effects of different treatments on dynamic change of ammonia concentration in the in vitro cultures*P<0.05. The same as follows. 如图2-a所示:向瘤胃灌注尿素后,2组的氨态氮浓度均呈现先升高后降低的趋势,相比于普通尿素组,缓释尿素组的氨态氮浓度变化曲线较为平缓。灌注后1 h时,普通尿素组的氨态氮浓度达到最高且显著高于缓释尿素组(P<0.05)。灌注后3 h时,缓释尿素组的氨态氮浓度达到最高且数值上高于普通尿素组,但差异不显著(P>0.05)。 图2 尿素灌注对育肥湖羊瘤胃氨态氮浓度(a)和pH值(b)动态变化的影响Fig.2 Effects of urea infusion on the dynamic change of rumen ammonia concentration(a) and pH value(b)in fattening Hu sheep 如图2-b所示:灌注尿素后普通尿素组的pH值呈现先升高后降低的趋势,而缓释尿素组的pH值升高后保持在相对稳定的范围内。灌注1 h时普通尿素组的pH值达到最高,显著高于缓释尿素组(P<0.05),灌注6 h时普通尿素组pH值降至最低且显著低于缓释尿素组(P<0.05)。 如图3-a所示:3个处理组的氨态氮浓度在09:00投料后均有先升高后降低的变化趋势。相比于普通日粮组,普通尿素组和缓释尿素组发酵罐内的氨态氮浓度均提高,但差异不显著(P>0.05)。3个处理组的氨态氮浓度均在发酵1 h时达到最高,在发酵7 h时降至最低。不同的是,在0~12 h时相比于普通日粮组和普通尿素组,缓释尿素组的氨氮浓度变化幅度较小。 图3 不同处理对持续动态人工瘤胃模拟系统氨态氮浓度(a)和pH值(b)动态变化的影响Fig.3 Effects of the different treatments on dynamic change of ammonia concentration(a) and pH value(b)in continuous artificial rumen simulation systemPT、Pt、PT×t分别为各处理组、时间点和处理与时间交互作用的P值。下同。PT,Pt,PT×t represent the P-value of treatment,time,and the interaction between treatment and time,respectively. The same below. 如图3-b所示:不同处理组的pH值变化趋势基本相同,随着发酵时间的延长,pH值先下降后升高。3个处理的pH值均在发酵4 h时降至最低,随后缓慢升高,在12 h时升至最高。如表4所示:经过7 d的发酵,普通尿素组的pH值显著高于缓释尿素组(P<0.05)。 表4 缓释尿素添加对持续动态人工瘤胃模拟系统发酵参数动态变化的影响Table 4 Effects of slow-release urea supplementation on dynamic change of fermentation characteristics in continuous artificial rumen simulation system 如表4所示:相比于普通日粮组和普通尿素组,缓释尿素组的微生物蛋白和丙酸浓度显著升高(P<0.05),总挥发性脂肪酸和丁酸的浓度有提高,但差异不显著(P>0.05)。3组间乙酸、异丁酸、戊酸、异戊酸的浓度差异不显著(P>0.05)。 尿素在瘤胃微生物分泌脲酶的作用下,进入瘤胃后首先分解为氨,随后被瘤胃微生物利用合成微生物蛋白,因此直接测定发酵体系内的氨态氮浓度即可体现尿素分解程度,评估其缓释效果。体外发酵试验周期短,样本容量大,且之前的研究发现体外培养法评估缓释尿素的缓释效果具有较高的准确性[17]。不过由于产物抑制、挥发性脂肪酸积累导致pH值下降等原因,经一定时间培养后会有微生物的活力下降、组成变化等问题,故体外发酵不能完全代表反刍动物瘤胃内发酵的情况。因此本研究首先通过体外发酵法评估了几种不同缓释尿素,并筛选出缓释效果最好的缓释尿素产品,随后通过瘤胃灌注法,将缓释尿素投注到育肥湖羊瘤胃内,评估其在瘤胃环境中的缓释效果。相比于普通尿素,缓释尿素能够降低瘤胃内氨态氮浓度,瘤胃内环境的改变会影响瘤胃内菌群结构[18-19],瘤胃菌群结构的变化又会导致微生物发酵产物的差异[20]。而短期发酵难以体现添加尿素对瘤胃发酵的影响,因此在体外发酵试验和瘤胃灌注试验中仅针对氨态氮浓度进行了测定。持续动态人工瘤胃装置可以满足长期发酵要求,能够实现发酵底物和缓冲液的连续进入和排出,且发酵参数接近活体反刍动物瘤胃内发酵状况[11]。因此本研究通过持续动态人工瘤胃装置探究日粮添加缓释尿素对微生物蛋白合成和瘤胃发酵的影响。 维持瘤胃内适宜的氨态氮浓度能够改善瘤胃发酵,促进微生物蛋白的合成,提高动物机体对尿素氮的利用效率,减少粪尿中氮排泄引起的环境污染[21]。体外发酵试验结果显示在体外发酵3、9和12 h的氨态氮浓度具有显著差异,说明4种缓释尿素在体外发酵前12 h的缓释效果不同。其中缓释尿素A具有最好的缓释效果,部分缓释尿素的尿素分解速度与普通尿素相近,可能是缓释尿素包被材料和包被技术的不同导致其缓释效果的差异。每100 mL瘤胃液或100 g内容物每小时可以将 80~100 mg尿素转化为氨[22],这一速率远高于本研究中的尿素水解速率,在本研究中所有处理组的尿素完全水解都需要24 h。这可能与瘤胃液接种量较少有关,初始微生物数量较少,因此需要更长的时间来分解高剂量的尿素。此外本研究添加尿素剂量超过实际生产中所添加的浓度,大量尿素分解产生的高氨浓度会抑制尿素酶的活性[23],这也可能在一定程度上降低了尿素的分解速度。最终根据体外发酵过程中分解产氨速度,本研究筛选出缓释尿素A进行后续试验。 本研究瘤胃灌注试验结果与预期相符,相比于普通尿素,缓释尿素降低了瘤胃内的尿素分解速度,这与Sinclair等[23]在山羊的瘤胃原位降解试验中得出的结果一致,说明缓释尿素能够同步氨与可发酵碳水中能量的释放,以提高尿素氮的利用效率。灌注后普通尿素组的最大氨态氮浓度超过最佳瘤胃细菌生长值(19.32 mg·dL-1)的2倍[25],虽然仍低于氨中毒的标准[26],但会导致大量的氨来不及被瘤胃微生物利用就随粪尿排出体外,造成尿素氮的浪费。此外,本研究发现相比于普通尿素,缓释尿素维持了瘤胃内pH值的稳定,这是由于缓释尿素能够持续分解产氨,尿素分解产生的氨为弱碱性且可以中和瘤胃发酵产生的酸,从而缓解瘤胃pH值的降低的问题[27]。普通尿素在瘤胃内快速分解产氨使瘤胃pH值在短时间内快速升高,而pH值的升高会促进瘤胃内游离氨浓度的升高和瘤胃上皮对氨的吸收,增加反刍动物氨中毒的风险[28-29]。以上结果说明,相比于普通尿素,缓释尿素能够维持瘤胃内氨态氮浓度和pH值的稳定,这与前人关于缓释尿素研究得出的结果一致[23]。 在前面2个试验结果的基础上,本研究又通过体外持续动态人工瘤胃装置模拟真实瘤胃环境,探究缓释尿素的缓释效果和对瘤胃发酵参数、微生物蛋白合成的影响。由于持续动态人工瘤胃装置采用了1 000 mL的发酵罐,瘤胃液和缓冲液的接种比例为1∶1,所需瘤胃液剂量较大,因此本试验采取奶牛为瘤胃液供体。本研究发现,虽然不同试验组在发酵过程中的总氨态氮浓度没有显著差异,但缓释尿素组的氨态氮浓度在早晨投料后的2~4 h间略有上升,说明缓释尿素延缓了尿素的分解时间,表现出了一定的缓释效果。前人研究发现,适宜的氨态氮浓度有利于瘤胃微生物的生长,提高微生物蛋白的合成效率[30]。此外,瘤胃中适宜的能氮比可以使微生物获取的能氮更加平缓,充分发挥微生物发酵效率,促进挥发性脂肪酸的合成[31]。在本研究中,缓释尿素维持了氮的同步释放,促进了微生物的生长,从而提高了微生物蛋白和丙酸的产量。此外,缓释尿素维持了氨态氮浓度的稳定,这可能促进了初级产丙酸菌的增殖,进而导致丙酸浓度的升高[32]。微生物蛋白和挥发性脂肪酸分别是反刍动物的主要蛋白来源和能量来源[2,33],其中丙酸作为主要的糖异生前体物,在瘤胃内的利用效率最高[34]。由此可见,在日粮中添加等氮含量的缓释尿素更有利于获得维持生命和生产所需的能量。健康的反刍动物瘤胃pH值为6.1~6.8,保持动态平衡,以维持瘤胃功能的正常运转[29]。在本研究中,日粮添加不同类型尿素没有显著影响发酵液pH值,但采样期所有试验组发酵液的pH值均降至5.8以下,低于正常的瘤胃pH值范围。发酵液的pH值受到碳水化合物发酵产酸、微生物对挥发性脂肪酸的吸收利用和食糜随溢流液外流的影响,当挥发性脂肪酸的产量超过微生物的利用能力时,会有一部分挥发性脂肪酸留在发酵罐内,造成发酵罐内挥发性脂肪酸的积累,从而降低发酵液pH值[35]。 综上,本研究选用3种方法全面评价了包被缓释尿素在不同环境中的缓释效果,其中体外批次发酵适用于多种缓释尿素产品的缓释效果的初步筛选,瘤胃灌注能准确反映缓释尿素在瘤胃内的缓释效果,持续动态人工瘤胃能一定程度体现缓释尿素对瘤胃发酵的影响。结果显示,不同缓释尿素产品在体外发酵中的缓释效果具有显著差异,包被尿素A缓释效果最好;体外发酵筛选出的缓释尿素在体内灌注试验条件下同样具有良好的缓释效果,且能够维持瘤胃内氨态氮浓度和pH值的稳定;持续人工动态瘤胃装置试验发现缓释尿素能够改善瘤胃发酵,促进微生物蛋白的合成。总的来说,缓释尿素能够降低尿素分解速度,维持适宜的瘤胃氨态氮浓度和pH值,提高尿素氮的利用效率,但对生长性能和瘤胃菌群的影响仍需动物饲养试验做进一步的验证。2 结果与分析
2.1 不同缓释尿素在体外发酵中的氨释放速率

2.2 尿素灌注对湖羊瘤胃氨态氮浓度和pH值的影响
2.3 不同处理对持续动态人工瘤胃发酵参数的影响
3 讨论

