神经营养因子受体Trkb对湖羊垂体细胞增殖及促性腺激素分泌的影响
陈培勇,蔡玉,杨花,徐辉,王锋,张艳丽
(南京农业大学动物科技学院羊业科学研究所,江苏 南京 210095)
酪氨酸激酶B受体(tyrosine kinase B receptor,Trkb)是神经营养因子家族的一种高亲和力受体。Trkb可以通过与其配体脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)结合,参与促进神经元的生长刺激、增殖和分化以及调节突触可塑性[1-3]。研究表明,Trkb及Bdnf除了在神经组织内表达外,在包括生殖系统在内的各种非神经组织中也有广泛表达,并发挥生理调控作用[4-5]。研究发现,Trkb在新生大鼠卵巢中原始卵泡中有表达,该结果提示Trkb可能参与卵泡生长或调节卵泡组装[6]。Trkb敲除小鼠的颗粒细胞增殖水平降低,卵泡组织明显丢失,并且伴随着大量的卵母细胞死亡[7]。这些结果均表明Trkb对卵泡发生和排卵发生的重要性。值得注意的是,在卵巢功能早衰小鼠模型中激活TRKB信号能够逆转卵泡损失并恢复卵母细胞数量,提高卵巢功能早衰小鼠的生育能力[8]。除此之外,激活TRKB信号能够使促性腺激素分泌恢复正常[8]。研究发现,BDNF/TRKB信号系统通过磷脂酰肌醇3激酶/蛋白激酶B通路(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)调控牛颗粒细胞增殖和孕激素合成[9]。此外,研究发现BDNF/TRKB信号系统表达于胎盘内合胞体滋养层和滋养细胞中,并通过增加胎盘滋养层细胞生长和存活促进胎盘发育,进而促进胎儿生长[10-11]。Trkb在雄性生殖中也发挥重要作用,前期有研究发现Trkb参与调控牛精子线粒体活性和精子凋亡,进而影响其生存能力[12]。此外,Trkb的基因多态性分析表明,该基因与绵羊产羔数相关[13]。上述研究结果均表明,Trkb在动物生殖调控中发挥重要作用。目前,关于Trkb功能研究大部分集中于卵巢颗粒细胞发育,在垂体内的调控功能尚不清楚。
垂体是哺乳动物体内重要的内分泌器官,能够通过响应下丘脑调控各种激素分泌调控应激、生长以及繁殖等各种生理功能,该器官在生殖轴调控中具有重要作用[14-15]。垂体可以通过分泌促卵泡素(follicle stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH)2种关键促性腺激素直接调控靶性腺发育和生殖活动[16]。在雄性中,FSH能够与睾丸支持细胞上相应受体结合从而影响精子发生,而LH通过刺激睾丸间质细胞促进雄激素分泌[17-19]。在雌性中,FSH通过刺激颗粒细胞促进卵子发生,而发情中期的LH峰可以触发排卵[20-21]。最近研究表明,Trkb参与调控绵羊外周血中促性腺激素浓度,推测Trkb可能调控绵羊垂体细胞状态从而影响促性腺激素分泌[22],但尚未开展进一步的研究。
湖羊以高繁殖力著称,是国家级绵羊资源保护品种,具有繁殖力高、四季发情、生长发育快等多种优点[23]。探究其垂体机能与调控机制对提高湖羊繁殖力有重要参考意义。据此,试验探究Trkb组织表达差异,以湖羊垂体细胞为研究对象,探究Trkb对垂体细胞增殖及促性腺激素分泌的影响,旨在为研究Trkb调控湖羊垂体分泌促性腺激素提供重要理论参考。
1 材料与方法
1.1 湖羊不同部位组织采集以及垂体细胞分离
于江苏省启东市瑞鹏牧业有限公司选取不同生长阶段的母羊:出生(1D)、5日龄(5D)、3月龄(3M)、6月龄(6M)和2岁龄(2Y)湖羊。分别选取不同生长阶段的湖羊3只,通过颈静脉放血方式处死后立即屠宰,采集心、肝、脾、肺、肾、下丘脑、垂体等组织存放于2 mL冻存管中,快速放入液氮中冻存,带回实验室,放在-80 ℃超低温冰箱中保存。此外,采集6M湖羊垂体并用预冷杜氏磷酸缓冲液(DPBS)冲洗3次后置于DMEM/F12(Gibico)培养液中用于垂体细胞分离。
采用Zheng等[24]的方法分离垂体细胞。在超净台中用手术镊剥离垂体组织中薄膜和上皮组织,分别使用1 mg·mL-1的Ⅳ型胶原酶和2.5 g·L-1胰酶(含EDTA)在37 ℃ 条件下依次消化15 min,以去除成纤维细胞并解离组织中垂体细胞。分离出的垂体原代细胞接种于含有10% 胎牛血清和1% 双抗(青、链霉素100 IU·mL-1)的DMEM/F12培养基中,置于37 ℃、5% 二氧化碳培养箱中培养。后续使用腺垂体标记蛋白(FSH和LH)对分离的垂体细胞进行鉴定。
1.2 构建过表达质粒
使用Trkb-CDS引物(表1)进行PCR扩增,琼脂糖凝胶电泳纯化回收目的产物。使用BamHⅠ和NheⅠ限制性核酸内切酶在37 ℃ 条件下酶切30 min,切胶后纯化。将纯化产物用T4DNA连接酶连接至pcDNA3.1(+)真核表达质粒,然后转入大肠杆菌Trans5α 感受态细胞,等待菌落长出。利用载体通用引物T7-bgh对菌液进行PCR扩增及测序,确保插入序列片段正确,然后进行质粒抽提并命名重组质粒为pcDNA-Trkb。

表1 qPCR相应目的基因的引物序列Table 1 qPCR primer sequence of corresponding target gene
1.3 总RNA提取、反转录及qPCR
采用Trizol 法(Invitrogen)提取湖羊各组织及垂体细胞的总RNA,按照反转录试剂盒(Vazyme)说明书操作合成cDNA。利用NCBI在线网站设计Trkb、卵泡刺激素β亚基(follicle stimulating hormone subunit beta,Fshβ)、促黄体素β亚基(luteinizing hormone beta,Lhβ)、增殖细胞核抗原(proliferating cell nuclear antigen,Pcna)、B细胞淋巴瘤/白血病2(B-cell CLL/lymphoma 2,Bcl2)、BCL2相关X蛋白(BCL2 associated X,Bax)以及肌动蛋白(actin beta,Actb)基因的引物(表1),由擎科生物合成引物。以反转录的cDNA为模板,进行荧光定量PCR检测各目标基因相对表达量。荧光定量检测体系为20 μL:SYBR Green Master 10 μL,上、下游引物各0.6 μL,cDNA 1 μL,补充ddH2O至20 μL。根据荧光定量试剂盒说明书(全式金)设置反应条件:94 ℃ 5 min;94 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环;72 ℃ 10 min。试验结果利用2-ΔΔCT方法计算各目的基因相对表达量。
1.4 垂体细胞转染试验
当6孔板中细胞密度处于50%~70%时,对照组转染空载质粒pcDNA-3.1,试验组转染Trkb质粒:取2.5 μL空载质粒pcDNA-3.1和pcDNA-Trkb质粒,分别与5 μL P3000混合于125 μL Opti-MEM中构成组分1;另取6.5 μL Lipofectamine 3000转染试剂混合于125 μL Opti-MEM中构成组分2,静置5 min后将 2组分混匀并静置10 min。弃去6孔板中原有培养液,用DPBS润洗1次细胞后,添加上述混合液,最后用含有10% 胎牛血清的培养液补至2 mL。处理48 h后收集细胞总RNA、细胞蛋白及上清液分别用于后续qPCR、蛋白免疫印迹(Western blot,WB)和酶联免疫吸附试验(ELISA)检测。
1.5 ELISA检测促性腺激素含量
根据绵羊FSH、LH相应的ELISA检测试剂盒说明书(卡迈舒)检测转染48 h后对照组和试验组细胞上清液中FSH和LH含量。
1.6 Western blot检测
按照细胞蛋白说明书用RIPA蛋白裂解液提取垂体细胞蛋白,用BCA蛋白浓度检测试剂盒(Beyotime)测定蛋白浓度。蛋白原液与蛋白变性试剂混合,在70 ℃下煮沸10 min以变性。变性后蛋白在160 V条件下电泳42 min,在120 V条件下转膜55 min,用50 g·L-1脱脂奶粉室温封闭2.5 h。在4 ℃条件下孵育一抗过夜(TRKB抗体购自ABcolonal;FSH抗体购自Abcam,LH和PCNA抗体购自AFFinity;BAX、BCL2和ACTB抗体购自Proteintech)。次日,TBST洗涤蛋白条带5次,每次7 min。使用HRP标记山羊抗兔IgG(Proteintech)室温孵育2 h。最后用ECL显影液拍照,使用ImageJ软件分析条带灰度值。
1.7 EdU检测转染后垂体细胞增殖
使用EdU细胞增殖试剂盒(Beyotime)检测垂体细胞增殖率。将垂体细胞接种于24孔板中,待细胞密度达到50%~60%进行转染,对照组加入空载体,试验组加入Trkb过表达质粒。在转染24 h后用EdU工作液孵育2 h,然后按照EdU试剂盒说明书进行操作,最后在激光共聚焦显微镜下拍照,使用ImageJ软件统计并分析细胞增殖情况。
1.8 细胞免疫荧光(IF)检测
将垂体细胞平铺至24孔培养板中,待细胞密度达到70%~80% 时用4%多聚甲醛(PFA)在室温条件下固定10 min,再用DPBS洗涤3次;用Triton X-100通透15 min,DPBS清洗3次后用3 g·L-1胎牛血清在室温条件固定90 min,分别孵育TRKB和FSH一抗过夜;次日用DPBS洗涤3次后在避光条件下孵育兔二抗1 h,使用共聚焦显微镜拍照。
1.9 数据处理与统计分析
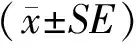
2 结果与分析
2.1 Trkb在湖羊组织中的差异表达分析
组织表达分析结果表明,TrkbmRNA在湖羊心脏、肝、脾、肺、肾、下丘脑、垂体等组织中均有表达,在垂体中具有较高的表达水平,且显著高于其他组织(P<0.05,图1-A)。此外,Trkb基因在垂体组织不同发育阶段差异表达,其中在6M的垂体组织中高表达,在5D和3M的垂体组织中表达水平较低(P<0.05,图1-B)。
图1 Trkb在湖羊不同组织(A)及不同发育阶段垂体(B)中的表达水平Fig.1 Expression levels of Trkb in different tissues(A)and pituitary at different developmental stages(B)of Hu sheep1)1D:1日龄1-day-old;5D:5日龄5-day-old;3M:3月龄3-month-old;6M:6月龄6-month-old;2Y:2周岁2-year-old.2)不同小写字母表示差异显著(P<0.05)。Different small letters indicate significant difference(P<0.05).
2.2 垂体细胞鉴定和TRKB表达
将分离得到的湖羊原代垂体细胞培养于培养皿中,在显微镜下观察发现细胞形态呈梭形(图2-A)。利用细胞免疫荧光技术对体外分离的湖羊原代垂体细胞进行鉴定,结果显示垂体标记蛋白FSH在大多数细胞中均有表达(图2-B)。目的蛋白TRKB在垂体细胞中也有表达,并主要表达在细胞质中(图2-C)。

图2 免疫荧光鉴定湖羊垂体细胞及TRKB表达定位Fig.2 Identification of pituitary cells by immunofluorescence stain and TRKB expression location of Hu sheep A.显微镜下垂体细胞形态Morphology of Hu sheep pituitary cells under microscope;B. FSH荧光染色FSH fluorescence staining;C. TRKB荧光染色TRKB fluorescence staining.4×、10×和20×分别代表4倍、10倍和20倍物镜倍数;Hoechst表示细胞核染色(蓝色)。4×,10× and 20× represent 4,10 and 20 objective multiples,respectively;Hoechst means staining the nucleus with blue.
2.3 Trkb过表达载体构建及过表达效率验证
如图3所示:对湖羊Trkb基因构建的过表达质粒(pcDNA3.1-Trkb)进行鉴定,琼脂糖凝胶电泳结果表明该质粒序列大小为2 526 bp(图3-A)。对质粒进行测序,结果与GenBank中绵羊Trkb基因CDS序列相一致(图3-B)。上述结果说明成功构建了湖羊Trkb基因的过表达载体pcDNA-Trkb。

图3 pcDNA-Trkb载体构建与过表达效率验证Fig.3 Construction of pcDNA-Trkb vector and verification of overexpression efficiency A. 限制性内切酶消化pcDNA-Trkb后的电泳图谱Electrophoretic map of pcDNA-Trkb after digestion by restriction endonuclease;B. BamHⅠ、NheⅠ、Trkb CDS启动子和终止子区域的序列Sequence at BamHⅠ,NheⅠ,Trkb CDS start and stop region;C、D. 转染pcDNA-Trkb质粒后Trkb mRNA和TRKB蛋白水平的表达Expression of Trkb mRNA and TRKB protein level after transfection of pcDNA-Trkb plasmid. *P<0.05, **P<0.01. The same as follows.
对湖羊垂体细胞进行Trkb过表达质粒转染试验,在转染48 h后检测Trkb的mRNA和蛋白表达情况。图3-C、D结果表明:与对照组相比,转染Trkb过表达质粒后,垂体细胞中Trkb的mRNA和蛋白水平表达量均显著提高(P<0.05)。
2.4 过表达Trkb对湖羊垂体细胞增殖的影响
如图4所示:与对照组相比,过表达Trkb极显著提高了垂体细胞中PcnamRNA的表达水平(P<0.01,图4-A)。Western blot 检测结果表明,过表达Trkb极显著提高垂体细胞中PCNA蛋白表达量(P<0.01,图4-B、C)。EdU试验结果表明,过表达Trkb基因极显著提高了垂体细胞EdU阳性率(P<0.01,图4-D、E)。上述结果表明,过表达Trkb可促进垂体细胞增殖。

图4 过表达Trkb对湖羊垂体细胞增殖的影响Fig.4 Effect of overexpression of Trkb on proliferation of Hu sheep pituitary cell A. 增殖标记基因Pcna mRNA相对表达量Relative expression level of proliferative marker gene Pcna;B、C. Western blot检测增殖标记蛋白PCNA的表达量Relative expression level of proliferation marker protein PCNA detected by Western blot;D、E. EdU检测垂体细胞增殖效率(蓝色是细胞核,红色是EdU阳性细胞,标尺为100 μm)EdU is used to detect the proliferative efficiency of pituitary cells(The blue is the nucleus and the red is EdU-positive cells. The scale is 100 μm.).
2.5 过表达Trkb对湖羊垂体细胞凋亡的影响
如图5所示:与对照相比,过表达Trkb显著增加了Bcl2在转录水平的表达量(P<0.01),并且显著提高了Bcl2/Bax比值(P<0.01,图5-A)。在蛋白水平上,Western blot试验结果表明,过表达Trkb极显著提高了BCL2的蛋白相对表达含量(P<0.01,图5-B)。过表达Trkb组细胞中BCL2/BAX蛋白相对表达水平的比值极显著高于对照组(P<0.01)。上述结果表明过表达Trkb可抑制垂体细胞凋亡。

图5 过表达Trkb对湖羊垂体细胞凋亡的影响Fig.5 Effect of overexpression of Trkb on cell apoptosis of Hu sheep pituitary cell A. 细胞凋亡相关基因Bax与Bcl2相对表达水平Relative expression levels of apoptosis-related gene Bax and Bcl2;B. Western blot检测细胞凋亡相关蛋白BAX与BCL2表达Expression of apoptosis related protein BAX and BCL2 detected by Western blot.
2.6 过表达Trkb对湖羊垂体细胞促性腺激素分泌的影响
由图6-A可见:与对照组相比,转染Trkb过表达质粒极显著提高了Fshβ和Lhβ的mRNA表达水平(P<0.01)。ELISA检测结果表明,过表达Trkb后培养液中FSH含量极显著提高(P<0.01),促进垂体细胞分泌FSH,但是对垂体细胞分泌LH没有显著影响(图6-B)。上述结果表明过表达Trkb可刺激湖羊垂体细胞促性腺激素FSH的分泌。
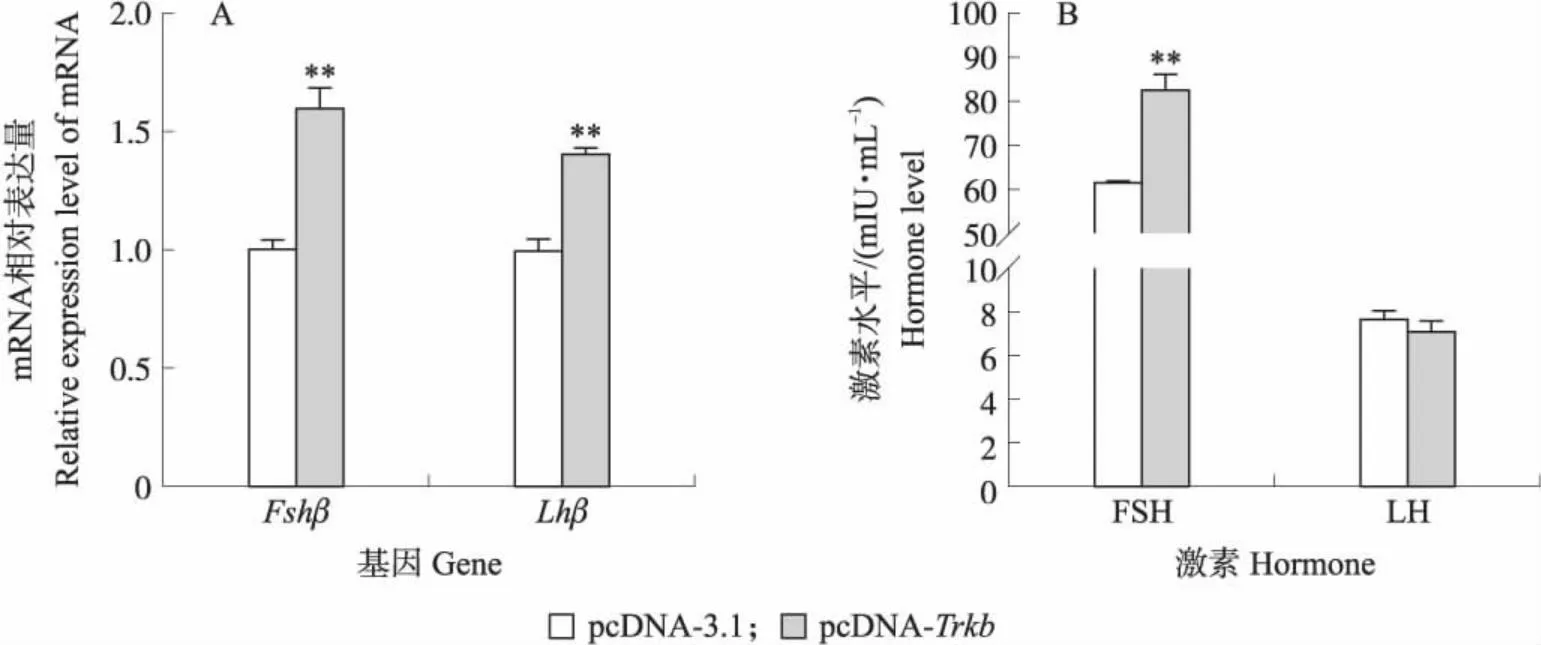
图6 过表达Trkb对湖羊垂体细胞促性腺激素分泌的影响Fig.6 Effect of overexpression of Trkb on gonadotropin secretion of Hu sheep pituitary cells A.促性腺激素相关基因Fshβ和Lhβ相对表达量Relative expression levels of gonadotropin-related genes Fshβ and Lhβ;B. ELISA检测促性腺激素FSH和LH分泌水平The secretion levels of gonadotropin FSH and LH detected by ELISA.
3 讨论
湖羊是我国著名的高繁殖率绵羊品种,是研究繁殖育种与肉羊多胎机制的理想对象。垂体作为下丘脑-垂体-性腺轴的中枢器官,能够感受下丘脑状态调控各种激素分泌并作用于下游靶腺,从而发挥调控机体生长、繁殖以及新陈代谢等生理功能[14]。因此,发掘湖羊垂体功能调控基因,探索湖羊垂体功能调控机制具有重要作用。目前,湖羊垂体功能基因的相关研究多集中于BMP家族及TGFβ信号通路。本课题组前期测序结果表明,Trkb基因在高繁殖力湖羊垂体中高度表达。本研究发现Trkb基因在湖羊不同组织中差异表达,在湖羊各组织中均有表达并且在垂体中高表达。此外,Trkb在不同日龄阶段的湖羊垂体中差异表达。这些结果提示,Trkb基因在湖羊垂体功能调控中发挥重要作用。因此,本试验以Trkb基因为研究对象,探究其潜在的调控功能,为探索湖羊垂体功能的调控机制提供理论支撑。
研究表明,Trkb能够与上游特异性配体结合并磷酸化胞内酪氨酸残基,进而激活下游信号通路,改变基因表达,最终影响细胞增殖、分化等生理功能[25]。前期在牛颗粒细胞中的研究表明,Trkb能够介导BDNF激活下游PI3K/AKT通路,促进牛颗粒细胞增殖和细胞活性[9]。此外,有研究表明Trkb能够与其高亲和力配体BDNF结合激活ERK通路促进子宫内膜Ishikawa细胞增殖[26]。另有研究报道,Trkb抑制剂K252能够阻断BDNF促进着床前胚胎由二细胞向囊胚阶段发育进程,降低细胞增殖,促进凋亡[27]。此外,研究发现激活BDNF/TRKB信号系统能够引起MAPK和PI3K信号级联,抑制内质网应激,从而诱导猪子宫内膜上皮细胞的增殖,抑制其凋亡[28]。上述研究结果均表明Trkb能够作为细胞信号通路关键环节调控生殖细胞增殖。本试验中,在湖羊垂体细胞中过表达Trkb基因后,湖羊垂体细胞增殖能力显著提高,并且细胞增殖标记基因Pcna在转录和蛋白水平表达量上调。此外,我们观察到过表达Trkb在转录和蛋白水平提高了BCL2蛋白表达水平以及BCL2/BAX比值,表明Trkb对湖羊垂体细胞具有抗凋亡的作用。
过表达Trkb对垂体细胞增殖的积极影响可能影响垂体细胞促性腺激素分泌水平,本研究进一步检测了过表达Trkb对促性腺激素分泌的影响。FSH和LH是由垂体前叶分泌的促性腺激素,能够直接作用于下游靶腺来影响类固醇激素分泌,在哺乳动物的生殖发育中起着至关重要的作用。对牛卵丘-卵母细胞复合物的研究结果表明,FSH能够促进COC中合成孕激素和雌激素。FSH在促性腺激素中的浓度比例可能会影响机体性器官发育[29]。此外,当FSH含量比例高于LH时,会导致卵巢发育受限[30]。调节促性腺激素分泌的网络机制是十分复杂的。一方面,垂体接收下丘脑分泌的促性腺激素释放激素的刺激,调控FSH和LH分泌并作用于下游靶腺;另一方面,性腺分泌的性激素又负反馈作用于垂体,进而影响FSH和LH分泌。此外,某些营养因子和非编码RNA也能作用于垂体调控促性腺激素分泌。在绵羊垂体的研究表明,连续3 d 脑室注射BDNF能够显著提高绵羊外周血中FSH浓度,这表明BDNF/TRKB可能参与调控绵羊垂体促性激素的合成与释放[22]。本试验中,体外过表达Trkb提高了垂体细胞中促性腺激素相关基因表达,这与上述研究结果相似。ELISA结果显示过表达Trkb显著提高FSH分泌水平,这进一步证实Trkb密切参与促性腺激素合成与分泌。
综上,本研究以湖羊垂体细胞为研究对象,通过体外过表达Trkb,初步验证Trkb可通过影响细胞增殖和凋亡来调节湖羊垂体细胞促性腺激素的分泌,这为深入探究Trkb调控垂体功能的分子机制提供了理论基础。
致谢:江苏省羊业科学研究所的全体师生在本试验样品采集、技术支持以及论文写作等方面给予指导与帮助,以致谢意。

