湖羊lncRNA-269的鉴定及转录调控分析
舒嘉傲,曹少先,孟春花,钱勇,张俊,张建丽,丁强,李隐侠*,李齐发
(1.南京农业大学动物科技学院,江苏 南京 210095;2.江苏省农业科学院畜牧研究所,江苏 南京 210014)
长链非编码RNA(long no-coding RNA,lncRNA)是非编码RNA家族的重要成员之一,一般通过影响临近基因表达(顺式作用)和调控远端基因表达(反式作用)2种方式[1-2]来调控细胞增殖和凋亡[3]、雌激素和孕激素的分泌[4]、DNA损伤与卵巢早衰[5]、卵母细胞的成熟等多种生物学进程[6]。在猪卵巢颗粒细胞中,lncRNATCONS_00814106作为一种竞争性内源RNA,通过吸收miR-1343调节转化生长因子β受体1(TGFBR1)的表达,进而促进猪颗粒细胞(GC)的增殖并抑制凋亡[7]。在小鼠卵巢中,lncRNAXist通过与细胞核中pre-miR-23b或pre-miR-29a结合阻止两者向细胞质输出,导致miR-23b-3p/miR-29a-3p成熟度降低,从而上调miR-23b-3p/miR-29a-3p的靶基因突触融合蛋白基因(STX17)表达,进而调控小鼠围产期卵母细胞丢失[8]。lncRNARose定位于细胞质,其表达下调导致小鼠卵母细胞减数分裂和早期的胚胎发育的异常,说明lncRNARose在哺乳动物卵母细胞成熟和胚胎发育中发挥重要功能[9]。在人的卵巢颗粒细胞系(KGN)中,lncRNAHCP5 通过miR-27a-3p/IGF-1轴调控KGN中细胞的增殖[7],同时也可通过影响邻近基因muts同源物5(MSH5)转录和DNA损伤修复参与调控卵巢早衰[5]。lncRNA还参与调节选择性剪接、细胞分化和细胞周期调节,并参与调节许多疾病的发生。例如:Wu等[10]发现lncRNABC200可参与细胞周期、调节癌症细胞的生长和侵袭;Zhang等[11]证实lncRNAMALAT1通过调节颗粒细胞TGF-β信号参与多囊卵巢综合症(PCOS)的病理生理过程。功能性lncRNA在人类和其他哺乳动物中的研究已有多例,而在高繁殖力湖羊中的发掘和相关功能还有待探索。
NR5A1基因是孤儿核受体NR5A(nuclear receptor 5A)家族第一个被发现的成员,也是一种重要的转录因子,与哺乳动物雌性生殖、卵泡发育、类固醇生成等关系密切[12-13]。NR5A1基因定位于绵羊的3号染色体,在湖羊中的研究发现NR5A1参与调控湖羊的卵泡发育[14],在核心启动子区鉴定的-388G/C突变与湖羊的产羔数显著关联[15],说明NR5A1基因是湖羊繁殖性能调控的关键基因。在湖羊NR5A1基因邻近处发现一个lncRNA-105611269(简称lncRNA-269),前期预试验发现湖羊血清中lncRNA-269 RNA的表达水平与NR5A1表达水平和雌二醇(E2)水平呈正相关,推测其可能通过顺式作用影响NR5A1表达从而参与调控湖羊繁殖。但lncRNA-269在湖羊中的序列特征及转录调控还未见报道。因此,本试验以湖羊为研究对象,扩增lncRNA-269基因全序列并分析其序列特征,检测其在湖羊组织中表达模式,扩增启动子区,分析启动子区活性和转录因子对lncRNA-269的转录调控作用,为解析lncRNA-269在湖羊卵巢中调控机制奠定理论基础。
1 材料与方法
1.1 试验材料
本试验中用来进行lncRNA-269组织表达谱鉴定的湖羊组织、全血和血清来自江苏省农业科学院六合动物试验基地羊场。湖羊屠宰后取其心脏、肝脏、脾脏、肺脏、肾脏、卵巢、子宫和肌肉组织于液氮保存并带回实验室,转入-80 ℃冰箱保存用于DNA和RNA的提取及后续试验。用来分离卵泡和卵巢颗粒细胞的湖羊卵巢来自江苏省太仓市东林屠宰场,新鲜卵巢取出后置于37 ℃生理盐水中,6 h以内带回实验室,分离颗粒细胞并培养用于后续研究。
1.2 湖羊卵巢卵泡分离以及卵巢颗粒细胞的分离和培养
湖羊卵巢用生理盐水冲洗干净,用剪刀剪去周围多余组织,再用生理盐水清洗2遍。用手术剪刀和镊子剥离中等大小卵泡(直径3~5 mm),观察卵泡状态和卵泡液的澄清度区分健康卵泡和闭锁卵泡。抽取每个卵泡的卵泡液,离心后上层卵泡液用来测雌二醇和孕酮的水平,进一步确认卵泡状态;下层颗粒细胞用来提取RNA备用;用注射器抽取直径3~5 mm健康卵泡中的卵泡液,1 500 r·min-1离心5 min后弃上清液,用PBS冲洗2遍,再加入含10%胎牛血清的DMEM/F12培养基(Gibico公司)混匀铺板,24 h后换液,观察颗粒细胞密度后进行后续试验。
1.3 湖羊RNA、DNA的提取及雌二醇和孕酮水平测定
采用高纯度RNA提取试剂盒(上海浦迪生物科技有限公司)提取湖羊各组织RNA和卵巢颗粒细胞RNA,采用常规酚/氯仿方法提取组织DNA,并用Nanodrop2000检测RNA和DNA的浓度和纯度,-80 ℃保存备用。使用ELISA检测试剂盒(北方生物科技有限公司)检测卵泡液中雌二醇和孕酮水平。
1.4 引物设计、PCR扩增与测序
根据 NCBI GenBank 数据库中湖羊lncRNA-269预测序列(序列号:XR_003588618.2),设计湖羊lncRNA-269全长引物(包括RNA部分序列和5′、3′调控区序列的引物)、定量PCR引物和启动子荧光素酶报告载体引物,由南京擎科生物科技有限公司合成。具体引物设计如表1。PCR扩增体系为25 μL,包括2×TaqMaster Mix(Dye Plus)酶12.5 μL,双蒸水8.5 μL,上、下游引物各1 μL,湖羊基因组DNA 2 μL。PCR反应程序:95 ℃ 5 min;95 ℃ 15 s,62 ℃ 15 s,72 ℃ 1 min,循环35次;72 ℃ 5 min。PCR产物经10 g·L-1琼脂糖凝胶电泳鉴定后,切取目的条带,使用琼脂糖凝胶回收试剂盒(北京擎科生物科技股份有限公司)纯化回收并连接pMD19-T载体(TaKaRa),转化DH5α后涂于含氨苄青霉素的LB培养板(氨苄青霉素浓度100 μg·mL-1),37 ℃倒置培养过夜后挑取单克隆摇菌,PCR鉴定后送北京擎科生物科技股份有限公司进行测序。

表1 本试验所用引物Table 1 Primers used in this study
1.5 RT-qPCR
使用 HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒(南京诺唯赞生物科技有限公司)将RNA逆转录为cDNA,包括500 ng总RNA、4×gDNA wiper 4 μL,加RNase-free ddH2O补充至16 μL,42 ℃反应2 min;随后在反应产物中加5×HiScript Ⅲ qRT SuperMix 4 μL,37 ℃反应15 min,85 ℃反应5 s。用ChamQ SYBR qPCR Master Mix(Low Rox Premixed)定量试剂盒(南京诺唯赞生物科技有限公司)进行RT-qPCR。反应体系(20 μL):2×ChamQ SYBR qPCR Master Mix(Low ROX Premixed)10 μL,ddH2O 7.2 μL,上、下游引物各 0.4 μL,cDNA 模板2 μL;反应程序:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环;熔解曲线 95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s。以GAPDH为内参基因,每个样品至少重复3次试验,采用2-ΔΔCT法计算目的基因的相对表达水平。
1.6 5′/3′RACE扩增
根据扩增获得的序列设计5′和3′特异性引物(5′ GSP和3′ GSP)用于lncRNA-269 cDNA末端的快速扩增。具体步骤:1)5′/3′ RACE-Ready cDNA合成:以湖羊卵巢组织mRNA为模板合成5′和3′ RACE的ready cDNA,包括mRNA 1 μg、5′/3′ CDS Primer 2 μL、dNTP Mix 2 μL、RNase-free双蒸水补充至13 μL/14 μL,于PCR仪中72 ℃反应3 min后置于冰上;加入5×FS Buffer 4 μL、10×Enzyme Mix 2 μL、5′ TS Oligo(5′扩增添加)1 μL,于PCR仪中42 ℃反应90 min、70 ℃反应15 min后置于4 ℃保存。2)配制cDNA末端快速扩增(RACE)反应体系(20 μL):5′/3′ RACE-Ready cDNA 2 μL、5′/3′ GSP(10 μmol·L-1)2 μL、10×Universal Primer Mix(UPM)2 μL、2×PCR Mix 10 μL、双蒸水4 μL;反应程序:98 ℃ 1 min;98 ℃ 10 s,63 ℃ 15 s,72 ℃ 3 min,25个循环;72 ℃ 5 min。以cDNA末端快速扩增产物为模板,设计巢式短引物进行普通PCR扩增,产物连接到pMD19-T载体后送至北京擎科生物科技有限公司进行测序,获取lncRNA-269 5′和3′序列。
1.7 载体构建、细胞转染及荧光素酶活性试验
设计带有保护碱基和酶切位点的特异性引物扩增不同长度的湖羊lncRNA-269启动子区片段和SMAD4 CDS区(表1)。随后分别利用限制性核酸内切酶XhoⅠ/NheⅠ和NheⅠ/Hind Ⅲ酶切目的载体和目的片段,置于16 ℃金属浴中连接过夜,对产物进行转化并挑取单克隆送公司检测。使用转染试剂Lipofectamine 3000(Invitrogen公司)将pcDNA3.1-SMAD4质粒转染湖羊卵巢颗粒细胞,48 h后收集细胞并提取RNA和蛋白进行表达水平检测;将pGL3-lnc-269的4个截短质粒转染卵巢颗粒细胞,48 h后用荧光素酶活性检测试剂盒(Promega公司)检测萤火虫荧光与海肾荧光活性并计算相对荧光活性(萤火虫荧光与海肾荧光的比值),分析lncRNA-269启动子区特征。
1.8 生物信息学分析
采用Promoter 2.0在线软件预测湖羊lncRNA-269的潜在启动子区。采用 JASPAR 在线公共数据库(http://jaspar.genereg. net/)分析湖羊lncRNA-269基因核心启动子区潜在的转录因子结合位点。采用CPC在线软件(http://cpc2.cbi.pku.edu.cn/)预测序列扩增拼接得到的lncRNA-269的蛋白编码能力。
1.9 染色质免疫沉淀(ChIP)-PCR试验
将湖羊卵巢颗粒细胞体外培养于10 cm细胞培养皿中48 h,依次加入135 μL 37%多聚甲醛、220 μL 2.5 mol·L-1甘氨酸,再置于37 ℃摇床110 r·min-1振摇10 min,促使蛋白质与染色质交联。收集细胞并利用超声波破碎仪将染色质碎片化。超声波破碎仪参数:40%输出功率,30个循环,每个循环打开破碎5 s、关闭冷却15 s。随后,在该体系中依次添加蛋白酶抑制剂和预先配制好的Protein A+G beads与SMAD4一抗混合物,并置于4 ℃条件下振摇孵育过夜,充分调取SMAD4-DNA复合物。最后利用5 mol·L-1氯化钠溶液解除交联,纯化后得到与SMAD4富集的DNA片段。以添加IgG一抗作为阴性对照组,以基因组DNA作为阳性对照组(Input)。设计引物SBE(SMAD4 binding element)和SBE-M分别扩增含有SMAD4结合位点和不含SMAD4结合位点的DNA片段,用于检验SMAD4特异和非特异性结合情况。引物信息见表1。
1.10 数据统计分析
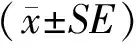
2 结果与分析
2.1 湖羊lncRNA-269 全序列扩增
分别设计5′GSP和3′GSP引物,利用RACE方法克隆lncRNA-269 5′UTR和3′UTR序列,设计2对引物P3和P4 扩增中间段序列,结果显示每对引物中间都有重叠区域(图1-A)。5′RACE和3′RACE分别获得比较明显的PCR条带,经过序列比对分析发现,5′RACE和3′RACE分别扩增获得611和1 020 bp序列,P3和P4引物分别获得1 065和885 bp序列(图1-B)。经过序列比对和拼接,最终得到湖羊lncRNA-269全序列,全长3 146 bp,与NCBI预测的全长同源性99.4%。通过CPC在线工具预测发现lncRNA-269转录本的蛋白编码能力为0.045,说明lncRNA-269无蛋白编码能力。

图1 湖羊lncRNA-269 5′UTR和3′UTR及中间序列引物设计示意图(A)和序列扩增(B)Fig.1 Schematic diagram of primer design(A)and amplification(B)of 5′ UTR,3′ UTR and middle segment sequence in lncRNA-269 of Hu sheep M1.1 000 DNA标准品;M2. 2 000 DNA标准品;GSP1和GSP2分别是用5′/3′RACE 的特异性扩增引物扩增的lncRNA-269特异性条带;P3和P4分别是用特异性引物扩增的lncRNA-269序列。M1. 1 000 DNA marker;M2. 2 000 DNA marker;GSP1 and GSP2 are specific amplification bands with 5′/3′RACE specific amplification primers,respectively;P3 and P4 are lncRNA-269 sequences with specific primers,respectively.
2.2 湖羊lncRNA-269组织表达分析
经RT-qPCR检测,结果(图2)发现lncRNA-269在湖羊肾、脾、肝、肺、子宫、卵巢、大肠、小肠和肌肉组织中均广泛表达,而在肌肉组织中相对低表达,在肾脏、脾脏和卵巢中相对高表达。

图2 lncRNA-269在湖羊不同组织(A)和卵泡(B)中的表达水平Fig.2 The expression level of lncRNA-269 in Hu sheep different tissues(A)and follicles(B) 不同大写字母代表差异极显著(P<0.01),不同小写字母代表差异显著(P<0.05)。Different uppercase letters represent significant differences(P<0.01),while different lowercase letters represent significant differences(P<0.05). *P<0.05. The same as follows.
分离卵巢卵泡,根据卵泡液中E2/孕酮比值并结合卵泡外观情况,区分健康卵泡和闭锁卵泡,RT-qPCR检测发现lncRNA-269在湖羊健康卵泡中的表达水平显著高于闭锁卵泡(P<0.05)。
2.3 湖羊lncRNA-269表达水平和NR5A1表达水平与血清E2水平的关系
以湖羊全血cDNA为模板,RT-qPCR检测lncRNA-269 RNA和NR5A1 mRNA的表达水平,并与对应羊血清中E2水平进行关联分析。结果(图3)发现:lncRNA-269 RNA表达水平与NR5A1 mRNA表达水平呈正相关,R2为0.522 2;lncRNA-269 RNA与血清中E2水平呈正相关,R2为0.654 1。推测lncRNA-269可能与NR5A1的表达及E2的合成存在关联。

图3 lncRNA-269 RNA与NR5A1 mRNA(A)相对表达水平和血清中E2水平(B)的相关性Fig.3 Correlation between relative expression level of lncRNA-269 with NR5A1 mRNA(A) and E2 level in serum(B)of Hu sheep
2.4 湖羊lncRNA-269 启动子区序列扩增与特征分析
将5′RACE得到的lncRNA-269转录起始位点T命名为+1,向前扩增湖羊lncRNA-269的启动子区。PCR扩增得到1 485 bp的湖羊lncRNA-269的启动子序列。JASPAR软件预测发现,lncRNA-269启动子区存在很多转录因子结合位点(图4),如 SMAD4、MYB、FOXO3和YY1等,提示这些转录因子结合位点可能参与调控lncRNA-269的转录。

图4 lncRNA-269启动子区序列特征分析Fig.4 The analysis of the promoter sequence characterization of lncRNA-269红色标记代表转录激活区;黄色标记代表转录抑制区。The red mark represents the transcriptional activation region;yellow mark represents transcriptional inhibition region.
分段扩增lncRNA-269启动子区序列,构建荧光素酶报告载体。荧光素酶活性分析结果(图5)显示:与pGL3-basic相比,plncRNA-269-1(-359~-17 nt)的荧光素酶活性极显著升高(P<0.01),而plncRNA-269-1(-359~-17 nt)与plncRNA-269-2(-359~-360 nt)和plncRNA-269-3(-941~-606 nt)间差异不显著,但是plncRNA-269-4(-1 485~-942 nt)荧光素酶活性下降,且与plncRNA-269-1、plncRNA-269-2和plncRNA-269-3间差异显著,表明湖羊lncRNA-269基因在-359~-17 nt区域内存在正调控的转录因子结合位点,在-1 485~-942 nt区域存在负调控的转录因子结合位点。

图5 lncRNA-269启动子区序列鉴定Fig.5 Promoter identification of lncRNA-269SGC:绵羊卵巢颗粒细胞Sheep granulosa cells;TSS:转录起始位点Transcription start site. **P<0.01. The same as follows.
2.5 转录因子SMAD4调控湖羊lncRNA-269的启动子活性
为了研究转录因子SMAD4是否参与调控lncRNA-269启动子活性,构建SMAD4过表达载体pcDNA3.1-SMAD4(图6-A)及SBE(SMAD4结合元件)突变型核心启动子区荧光素酶报告载体P4(plncRNA-269-4-Mut)。将pcDNA3.1-SMAD4转入卵巢颗粒细胞,SMAD4 mRNA和蛋白水平显著增加(图6-B、C)。将SMAD4过表达载体分别与含有野生型SBE和突变型SBE的lncRNA-269启动子区荧光素酶载体共转,结果发现,过表达SMAD4后,湖羊卵巢颗粒细胞中lncRNA-269启动子区活性极显著升高(P<0.01),但是对SBE突变型启动子区的荧光素酶活性无显著影响(图6-D)。说明SMAD4可通过湖羊lncRNA-269核心启动子区的SBE调控湖羊lncRNA-269的转录活性。

图6 转录因子SMAD4调控湖羊lncRNA-269启动子活性Fig.6 Transcription factor SMAD4 regulates the promoter activity of lncRNA-269 in Hu sheep A.SMAD4过表达载体构建示意图;B、C. 过表达SMAD4后上调卵巢颗粒细胞中SMAD4 mRNA 和蛋白表达水平;D. SMAD4 上调湖羊lncRNA-269 启动子活性。NC. 对照;SMAD4 OE. 过表达SMAD4。A. Schematic diagram of construction of SMAD4 overexpression vector;B,C. Overexpression of SMAD4 upregulated mRNA and protein level of SAMD4 in ovarian granulosa cells;D. SMAD4 upregulated the promoter activity of lncRNA-269 in Hu sheep. NC. Control;SMAD4 OE. SMAD4 overexpression.
为了更进一步分析SMAD4与lncRNA-269启动子区SBE位点的结合情况,利用SMAD4特异性抗体开展了ChIP-PCR试验。结果(图7)显示,SMAD4蛋白可富集SBE的DNA片段,证明转录因子SMAD4通过与启动子区的SBE位点直接结合进而增强lncRNA-269的转录活性。

图7 ChIP-PCR试验鉴定SMAD4与lncRNA-269启动子区特异性结合Fig.7 The specific binding of SMAD4 and lncRNA-269 promoter using ChIP-PCR assayInput和IgG分别指阳性对照和阴性对照。Input and IgG represent positive and negative control,respectively.
3 讨论与结论
lncRNA是哺乳动物基因组中很多基因座产生的多种转录产物,随着高通量测序技术的不断发展,大量功能性的lncRNA被挖掘和鉴定,参与多种生命进程包括动物的生长、繁殖、肉质等[16-18]。在晋南牛中鉴定的一个lncRNAADNCR,其通过靶向miR-204调控前脂肪细胞中SIRT1基因表达,从而抑制脂肪生成,且在其内含子1中发现一个新的SNP g.1263T>A突变,该突变与晋南牛的体重、胸围和臀长等生长指标显著相关[19];Hanper绵羊中lncRNAXist和Gtl2参与调控卵泡发育,进而调控绵羊的繁殖力[20]。本研究鉴定的lncRNA-269 组织表达谱发现其在湖羊卵巢中表达量较高,且在健康卵泡中高表达,推测lncRNA-269可能参与调控湖羊卵泡发育,进一步研究发现lncRNA-269的表达水平与绵羊繁殖力关键激素E2水平呈正相关,说明lncRNA-269可能参与调控湖羊繁殖性能。
研究发现大多数lncRNA在染色质上富集,很大一部分lncRNA具有顺式作用潜力,顺式作用的lncRNA依赖其转录的基因座,通过激活、抑制或者其他方式调节靶基因表达进而发挥生物学功能[21]。在小鼠上皮细胞中,定位于细胞核中的lnc-Cxcl2通过与Cxcl2基因启动子结合,募集核糖核蛋白La,从而顺式调控Cxcl2基因的转录[22];在肺细胞中,lnc-HMGA1通过顺式作用调控HMGA1基因表达[23]。本研究鉴定的lncRNA-269定位于绵羊的3号染色体,与调控湖羊卵泡发育和产羔数的NR5A1基因毗邻[14],lncRNA-269 RNA的表达水平与NR5A1 mRNA的表达水平呈现正相关,推测lncRNA-269可能通过顺式作用调控NR5A1表达进而参与调控湖羊繁殖性能。
为了解析lncRNA-269的表达调控,采用RACE方法结合PCR克隆技术获得了lncRNA-269 全长,在鉴定其转录起始位点的基础上,扩增获得其启动子序列,荧光素酶活性分析发现其启动子区存在一个转录激活区域(-359~-17 nt)和一个转录抑制区域(-1 485~-942 nt),软件预测发现一些转录因子结合位点如SMAD4、YY1、FOXO3、PDX1等与lncRNA-269启动子区结合。已有研究表明,转录因子可通过调控lncRNA启动子活性参与调控生物学进程,如转录因子叉头框C1(FOXC1)通过调控LINC00301启动子活性促进非小细胞肺癌肿瘤发生并触发免疫抑制微环境[24];转录因子上游刺激因子1(USF1)诱导lncRNAHAS2-AS1上调,促进胶质瘤细胞的侵袭和迁移[25]。本研究预测的与lncRNA-269启动子区结合的转录因子可能通过参与调控其启动子活性发挥调控作用。
转录因子SMAD4不仅是TGF-β信号通路中的介质和效应器,而且还是一种多功能调节剂,通过与靶基因启动子区SBE基序结合,调控靶基因表达,进而调控生物学功能包括细胞增殖、分化、凋亡等[26-28]。例如,在地塞米松诱导的人骨髓间充质干细胞(hBMSC)中,SMAD4通过转录激活GCN5表达抑制细胞凋亡,促进成骨的分化[29];SMAD4作为猪CYP19A1的转录因子,通过与CYP19A1基因启动子区内的SMAD4结合元件(SBE)直接结合,增强猪卵巢颗粒细胞中CYP19A1的表达和功能[30];SMAD4作为转录因子结合到FZD4启动子促进其表达进而调控卵巢颗粒细胞凋亡[31];SMAD4通过与猪miR-183-96-182簇启动子区SBE基序结合激活miR-183-96-182簇表达,下调其靶基因叉头框O1(FOXO1)表达进而抑制卵巢颗粒细胞的凋亡[32];SMAD4也可直接作用于lncRNASDNOR启动区SBE位点提高其启动子活性[31];本研究也发现转录因子SMAD4通过与lncRNA-269启动子区SBE位点特异性结合而上调lncRNA-269的启动子活性,表明lncRNA-269转录受到转录因子SMAD4的调控。
综上,本研究鉴定了绵羊3号染色体邻近NR5A1基因的lncRNA-269,其在健康卵泡中显著高表达,与NR5A1表达水平和血清中E2水平呈正相关,说明其可能通过顺式作用调控NR5A1表达进而调控湖羊繁殖性能;分析荧光素酶活性发现lncRNA-269启动子区存在一个正调控区(-359~-17 nt)和一个负调控区(-1 485~-942 nt),在正调控区发现的转录因子SMAD4参与调控lncRNA-269的转录。此结果为解析lncRNA-269的功能及其与NR5A1基因之间的调控关系奠定了理论依据。

