胰腺浆液性囊腺瘤手术切除患者172例的临床及影像学特征分析
王端 吴东 戴梦华 朱亮
1中国医学科学院北京协和医学院 北京协和医院消化内科,北京 100730;2北京协和医院基本外科,北京 100730;3北京协和医院放射科,北京 100730
胰腺浆液性囊腺瘤(serous cystic neoplasm,SCN)约占原发性胰腺囊性肿瘤的16%[1],主要好发于中老年女性,且女性发病年龄普遍早于男性[2]。SCN可发生于胰腺的任何位置,其中胰体和胰尾部发生率较高,且有逐年增加的趋势[2-3]。胰腺SCN常见的临床表现为非特异性腹痛,其他症状包括胰胆管梗阻、腹部肿块、乏力、恶心呕吐和体重减轻等,亦有相当比例的患者无症状,为影像学检查偶然发现[2,4]。SCN绝大多数为良性病变,预后良好,极少发生侵袭和转移,死亡率接近0%[5]。临床上对于SCN患者通常选择定期观察随访,只有临床症状明显、病灶较大、生长迅速或无法排除恶性可能的SCN才考虑手术切除[5-6]。一项322例手术切除的胰腺囊性病变回顾性分析结果显示,23.9%的患者是术后诊断为SCN的[7]。考虑到胰腺切除手术带来的创伤、术后并发症及远期的胰腺内外分泌功能损害,包括胰岛素依赖型糖尿病等[8],提高术前影像学诊断的准确性,从而避免不必要的手术具有重要的临床意义。本研究回顾性分析手术切除的172例SCN患者的临床与影像学特征及其变化趋势,探讨手术指征以及提高术前诊断准确性的方法。
资料与方法
一、研究对象
收集2014年9月至2022年4月间北京协和医院172例行手术切除并经病理学诊断为胰腺SCN患者资料,术前均行影像学检查。其中男性43例,女性129例,年龄20~80(51±14)岁。按手术时间将SCN患者分为2014—2018年间(84例)与2019—2022年间(88例)两个时间段进行比较分析。
二、观察指标和定义
1.临床资料:包括年龄、性别、临床症状、手术指征、手术方式、术后并发症、住院时长、围术期死亡率。术后并发症定义为术后90 d内出现胰瘘[9]、术后出血[10]、胃排空障碍[11]、术后感染等。围术期死亡定义为术后90 d内患者死亡。
2.术前影像学资料:包括是否进行超声造影、CT、增强MRI或MRCP、PET-CT、EUS以及EUS引导下的囊液抽吸分析。记录CT或MRI影像学报告中对于胰腺病变考虑的第一诊断。
CT及MRI图像资料由1名高年资放射科医师进行回顾性评估。影像学特征包括病灶位置(胰头部、胰颈部、胰体部、胰尾部和多发)、形态学分型(微囊型、微囊-大囊混合型、大囊型、单囊型和实性)[1]、平扫密度(明显低密度、稍低或等密度)、强化特征(均匀高强化、混杂高强化和除囊壁或少许分隔外无强化)、形状(类圆形或分叶状)、囊壁(菲薄或较厚伴强化)、分隔(无、纤细或粗大)、钙化(无、中央钙化或周边钙化)、纤维瘢痕、上游和下游胰管扩张、病变周围动脉或静脉改变及胆管有无压迫。
肿瘤的强化程度低于腰大肌定义为无强化或轻度强化,介于腰大肌和胰腺实质之间为中度强化,高于胰腺实质为高度强化;囊壁厚度≥2 mm为囊壁较厚,<2 mm为囊壁菲薄;主胰管直径>2 mm定义为主胰管扩张;胰腺病变周围的动脉发出分支进入病变内部定义为病变周围动脉改变;胰腺病变周围的静脉管腔受压定义为病变周围静脉改变。
三、统计学处理
采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验。计数资料以频数或百分比(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一、临床资料
172例患者中161例次(93.6%)行CT检查,102例次(59.3%)行MRI检查,16例次(9.3%)行EUS检查,12例次(7.0%)行超声造影检查,22例次(12.8%)行PETCT检查。术前影像学诊断:20例(11.6%)诊断为SCN,86例(50.0%)诊断为胰腺黏液性囊腺瘤(mucinous cystic neoplasm,MCN),35例(20.3%)诊断为导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm,IPMN),18例(10.5%)诊断为神经内分泌肿瘤(pancreatic neuroendocrine tumor,pNET),8例(4.6%)诊断为假性囊肿,5例(2.9%)诊断为胰腺实性假乳头瘤(solid pseudopapillary tumor,SPT)。手术指征:117例(68.0%)无法排除恶性可能,66例(38.4%)出现临床症状,26例(15.1%)病灶直径较大,8例病灶进行性增大。手术方式:24例(14.0%)行胰十二指肠切除术,144例(83.7%)行胰体尾切除术。术后并发症:胰瘘24例次,术后感染13例次,术后出血7例次,胃排空障碍6例次,其他并发症3例次,总并发症发生率为26.7%(46/172)。住院时长为(24.9±15.4)d。围术期间无患者死亡。
2014—2018年与2019—2022年间SCN手术患者的临床特征各变量间的差异均无统计学意义,具有可比性(表1)。
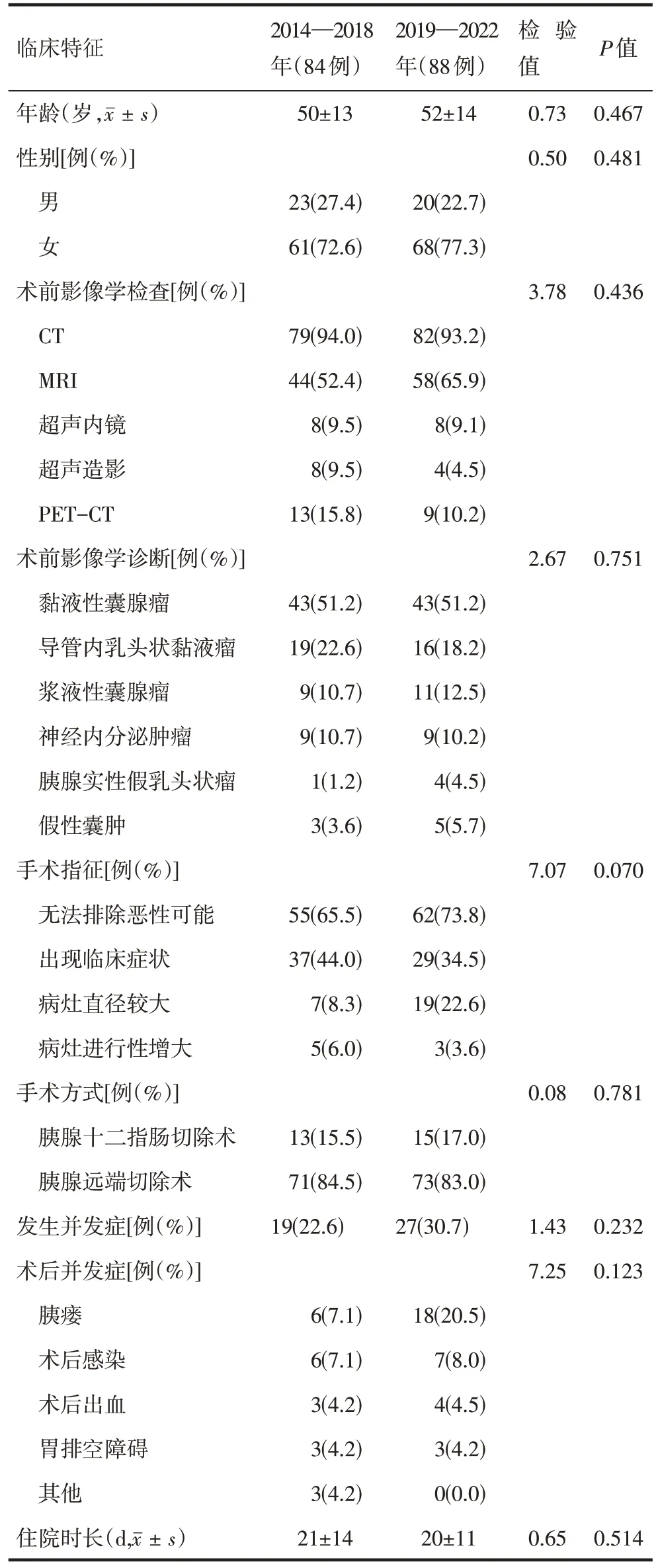
表1 2014—2018年与2019—2022年间胰腺浆液性囊腺瘤患者的临床特征比较
二、2014—2018年与2019—2022年间SCN患者的影像学特征比较
两组的SCN均以单发为主。形态学分型以微囊型和微囊-大囊混合型为主,单囊型、大囊型次之,实性SCN占比最少。与2014—2018年间比较,2019—2022年间SCN位于胰体尾部占比显著增加(图1A);手术切除的SCN微囊型占比显著增加,而微囊-大囊混合型占比显著下降(图1B);病灶中心钙化或周边钙化,以及病灶周围出现静脉改变的患者占比显著减少,差异均有统计学意义,其他影像学特征的差异均无统计学意义(表2)。术前影像学误诊为MCN、PNET患者的影像学特征见图2、图3。
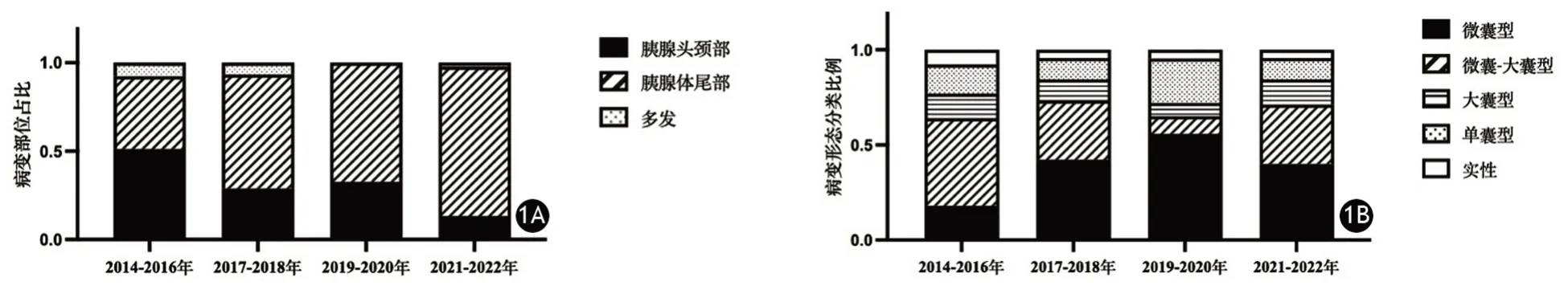
图1 不同年份胰腺浆液性囊腺瘤病变部位(1A)及形态学分型(1B)比较
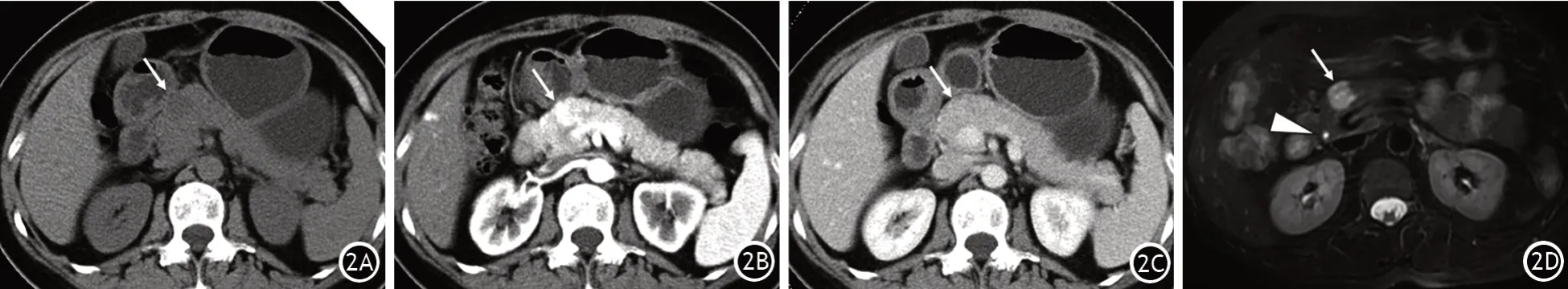
图2 胰腺浆液性囊腺瘤患者,术前影像学诊断为胰腺神经内分泌肿瘤。腹部平扫CT示胰颈部类圆形低密度病灶(↑,2A);增强CT动脉期示病灶强化明显高于周围胰腺实质,门静脉期示病灶强化程度较动脉期有所减低,与周围胰腺实质强化等同(2B)。磁共振T2加权相示病灶较周围胰腺实质呈T2高信号(2C),以胆总管腔内液体信号作为参照(△),可见并非典型囊性病灶的水样高信号(2D),可能与病灶内部有大量的纤细分隔有关
三、SCN不同术式间并发症发生率的比较
24例行胰十二指肠切除术的SCN患者中,13例(54.2%)出现术后并发症,其中5例次术后感染,4例次胃排空障碍,2例次胰瘘,2例次术后出血,1例次腹腔包裹性积液,1例次亚急性脑梗,3例次出现两种及以上并发症。144例行胰体尾切除术的SCN患者,33例(22.9%)出现术后并发症,其中22例次胰瘘,8例次术后感染,5例次术后出血,1例次胃排空障碍,1例次术后胰腺血肿,4例次出现两种及以上并发症。胰十二指肠切除术后并发症发生率显著高于胰体尾切除术,差异有统计学意义(P=0.010)。
四、SCN影像学特征与临床指标间的相关性
病灶长径≥40 mm的97例患者中44例(45.4%)出现临床症状,<40 mm的75例患者中22例(29.3%)出现临床症状,病灶长径≥40 mm的患者出现临床症状的概率显著高于病变长径<40 mm者;主胰管扩张的37例患者中24例(64.9%)出现临床症状,无主胰管扩张的128例患者中40例(31.2%)出现临床症状,主胰管扩张患者出现临床症状的概率显著高于无胰管扩张者,差异均有统计学意义(P值分别为0.032、<0.001)。
讨 论
SCN是一种预后良好的胰腺良性肿瘤,无症状患者通常无需采取手术治疗[4]。随着医学影像辅助检查的发展,胰腺囊性病变的检出率日益增加[12],因此提高术前影像诊断准确率,规避手术的创伤与风险变得日益重要。在临床实践中,常因SCN影像学表现不典型而无法排除其他具有恶变潜能的肿瘤,如MCN、IPMN、pNET等。一项针对27例SCN手术病例的回顾性分析显示,无法明确诊断是患者接受手术的最主要原因[3]。一项研究显示,133例接受手术切除的SCN患者中,只有25%在术前得到了正确诊断[13]。本研究纳入的172例患者,只有20例(11.6%)在术前影像学检查中被明确诊断为SCN,其他的被误诊为MCN(50.0%)、IPMN(20.3%)、pNET(10.5%)、假性囊肿(4.6%)、SPT(2.9%),且诊断准确率未随时间推移有显著提高。
CT和MRI是诊断胰腺囊性病变最常用的影像检查方法,PET-CT、EUS、超声造影、EUS-FNA也对诊断具有辅助价值。微囊型是SCN最常见与典型的影像学形态表现[2,14],纤维瘢痕、中央钙化和周围血管改变是诊断SCN的特异性CT征象,有助于与MCN、IPMN的鉴别诊断[15]。但SCN在CT中表现多样,部分病例缺乏钙化、纤维瘢痕等典型特征,而部分则可能出现类圆形、单囊型外观,或有分隔增厚、胰管扩张、胰腺实质萎缩等不典型表现,可能是术前误诊的重要原因[1]。本研究中93.6%患者术前行增强CT检查,通过对2014—2018年与2019—2022年间两个时段手术患者的影像学特征比较,发现病灶钙化、病灶周围静脉改变的占比显著下降,纤维瘢痕与上游胰管扩张占比也有所下降,这一变化趋势表明对于SCN典型影像特征的识别能力提高,也对临床医师提出了更高的要求。
EUS-FNA被推荐作为CT与MRI检查的辅助手段[5]。囊液分析中黏蛋白的存在和癌胚抗原>192 ng/ml对区分黏液性病变和非黏液性病变具有较高特异性,淀粉酶<250 U/L则能排除胰腺假性囊肿[16]。由于微囊型病变难以通过胰腺穿刺获得足够的囊液进行分析,因此EUS-FNA在胰腺囊性病变中多应用于单囊和大囊型肿瘤[3]。值得注意的是,本研究的172例手术患者中仅有7例在术前接受了EUS-FNA检查。笔者推测,一方面有创操作的风险限制了其应用的广泛性,另一方面EUS-FNA的阴性结果可能会使患者放弃手术,而选择保守治疗和随访观察,因此本研究的数据从一定程度上也反映了EUS-FNA应用率偏低的现状。今后对大囊型或微囊-大囊混合型病灶诊断不明时,更多地应用EUS-FNA或许能更好地识别SCN而避免不必要的手术。
胰腺外科手术的术后并发症常见,主要表现为胰瘘、术后出血、术后感染等,远期并发症包括消化与代谢功能损害,如胰岛素依赖型糖尿病[16-17]。本研究结果显示,26.7%患者出现术后并发症,胰瘘最多(14.0%)。2014—2018年与2019—2022年两时间段手术患者的住院时间、术后并发症发生率差异无统计学意义,这表明手术风险并未随近年手术技术提高、器械更新和护理水平的提高有显著降低,因此在做出手术决策时仍应当慎重,使患者避免不必要的创伤。胰体尾切除术相较于胰十二指肠切除术,胰腺头部结构得以保留,且通常不涉及消化道重建,因此术后恢复较快,术后并发症相对较少。本研究结果也表明胰十二指肠切除术的并发症发生率显著高于胰体尾切除术。术式的选择与胰腺肿瘤的部位相关,胰十二指肠切除术多用于病变位于胰腺头颈部的患者,而本研究观察到近年来手术病例中病变在胰腺头颈部的发生率显著下降,这一现象可能反映了临床医师在面临胰头病变切除有着更高手术风险时做出的手术决策较前更为慎重。
本研究的局限性主要体现为单中心SCN手术切除病例的回顾性研究,未能纳入非手术SCN病例队列对照,也未与具有相似影像学特征的其他胰腺疾病进行对比,在解读本研究的数据结果时应充分考虑到由于选择偏倚的存在,尚无法代表所有SCN的临床与影像学特征。
利益冲突所有作者声明无利益冲突
作者贡献声明王端:数据整理、统计学分析、论文撰写;吴东:研究指导、工作支持、论文审阅;戴梦华:工作支持、提供手术病例及临床数据;朱亮:研究设计、研究指导,影像学评估,论文审阅

