2型自身免疫性胰腺炎25例临床分析
赖雅敏 常晓燕 朱亮 周婧雅 杨红 郭涛 杨爱明 吴东 钱家鸣
1中国医学科学院北京协和医院消化内科,北京 100730;2中国医学科学院北京协和医院病理科,北京 100730;3中国医学科学院北京协和医院放射科;4中国医学科学院北京协和医院病案科,北京 100730
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一种特殊类型的慢性胰腺炎,表现多样,误诊漏诊率高。随着临床研究的不断深入,近年来AIP确诊率逐年上升[1]。但目前研究大多集中于1型AIP,2型AIP相对少见,我国2型AIP研究更为不足,影响了临床对该病的认识[2]。2型AIP又称为“特发性导管中心性胰腺炎”或“伴有粒细胞上皮变的胰腺炎”,好发于青少年,约30%的2型AIP患者合并炎症性肠病(inflammatory bowel disease, IBD)[3]。不同于1型AIP,2型AIP缺乏特异性的诊断标志物[4],因此临床诊断难度大,其发病机制及免疫学特征仍然未明[3]。本研究探讨2型AIP的临床特征和短期随访结果,并与1型AIP进行比较,以期加深对该病的认识。
资料与方法
一、研究对象
检索北京协和医院病案科住院病案首页管理系统2001年1月至2022年12月间出院诊断中包含“自身免疫性胰腺炎”与“溃疡性结肠炎”(ulcerative colitis, UC)或“克罗恩病”(Crohn's disease, CD)或IBD患者的临床资料,并补充门诊及内镜数据库中同类患者的临床资料。诊断依据2011年国际胰腺协会AIP国际共识诊断标准,排除:(1)经病理确诊为胆源性胰腺炎、胰腺肿瘤、1型AIP等胰腺其他疾病者;(2)无有效随访或随访时间<6个月者;(3)临床资料不全者。选取1985年1月至2016年12月间北京协和医院194例确诊为1型AIP患者的临床资料作为对照。本研究经医院伦理委员会审批(批号ZS1482)。
二、诊断标准
2型AIP诊断有5项核心指标[5]:(1)胰腺影像学,包括实质影像(parenchymal imaging,P)和胰管影像(ductal imaging,D);(2)血清学(serology,S);(3)胰腺外器官受累(other organ involvement,OOI);(4)组织学(histology,H);(5)对激素治疗的反应(response to steroid,R)。前4项分为2个等级。确诊2型AIP必须满足1/2级P+1级H,或1/2级P+伴IBD+2级H+R,即典型的胰腺影像学特征及典型的病理特征,或典型的影像学特征+合并IBD+对糖皮质激素治疗反应。疑诊2型AIP必须满足1/2级P+2级H,或1/2级P+伴IBD+R,即典型的胰腺影像学特征及较为典型的病理特征,或典型的影像学特征+合并IBD+对糖皮质激素治疗有良好反应。
影像学特征中的典型改变定义为胰腺弥漫性增大伴延迟增强(有时与边缘样增强相关),相对不典型改变定义为胰腺节段性或局灶性放大伴延迟增强。病理特征定义为镜下见胰腺导管管壁粒细胞浸润,伴或不伴粒细胞性腺泡炎症;同时IgG4阳性细胞缺失或很少(0~10细胞/高倍视野)][6-7],且排除恶性肿瘤。对糖皮质激素治疗反应的评估是在使用0.6~1.0 mg/kg泼尼松龙治疗2周~3个月后复查影像学和血清CA19-9水平[8],若影像表现改善且血清CA19-9水平无升高,则定义为治疗有反应。UC、CD、IBD的诊断符合中国2018年炎症性肠病指南[9]的标准。
AIP复发定义为在随访过程中再次出现相关AIP事件(胰腺相关疼痛、梗阻性黄疸、胰腺外表现等),同时存在胰腺外分泌和内分泌功能不全的表现。胰腺外分泌功能不全定义为粪便弹性蛋白酶<200 μg/g,或经过胰酶替代治疗改善了脂肪泻[9];胰腺内分泌功能不全以糖尿病为准。糖尿病的诊断标准为空腹血清葡萄糖水平>7 mmol/L或糖化血红蛋白>6%[10]。
三、观察指标
记录患者的性别、诊断时年龄、发病时间、临床症状、合并症、实验室及影像学检查结果、胰腺外器官受累情况、治疗方式及特殊用药。通过出院后门诊复查记录评估随访情况。
四、统计学处理
应用SPSS13.0软件进行统计学分析。计量资料以±s表示,组间比较采用t检验或方差分析;计数资料以例(%)表示,组间比较采用χ2检验、秩和检验或Fisher确切概率法。患者生存情况采用Kaplan-Meier分析。P<0.05为差异有统计学意义。
结 果
一、一般情况
共纳入25例符合2型AIP临床诊断标准的患者,其中16例为确诊患者,9例为疑诊患者。男性19例,女性6例。发病年龄11~73岁,平均40岁。10例有长期吸烟史,6例有饮酒史。1例合并胆囊结石。18例合并IBD,其中16例合并UC,1例合并CD,1例合并未定型结肠炎。
二、2型AIP诊断及治疗转归
23例(92.0%)患者有腹痛症状,其中3例以急性胰腺炎为首发表现,通过结肠镜、EUS确诊为2型AIP合并UC;2例患者初始表现为胰腺占位,因无法排除恶性肿瘤行外科手术,术后病理确诊为2型AIP;1例患者因UC缓解后腹痛并发严重抑郁状态,反复就诊后确诊为2型AIP。2例无症状,因体检偶然发现胰腺肿物,最终通过完善检查确诊。
25例患者均有较为典型的胰腺影像学特征(图1)。13例(52.0%)表现为胰腺弥漫肿大,12例(48.0%)表现为胰腺局灶或多灶性肿物,其中5例表现为胰腺局灶肿物合并胰腺弥漫肿胀。15例完成了EUS(图2)。
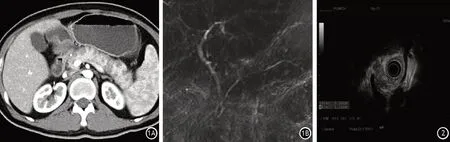
图1 患者男,29岁,2型自身免疫性胰腺炎合并溃疡性结肠炎。胰腺CT见胰腺饱满,增强后动脉期见多发斑片结节状低强化灶,分布较均匀,主胰管未见显影(1A)。MRCP显示肝内外胆管形态自然,主胰管形态欠规则,胰体部较长节段狭窄,狭窄节段上游主胰管无明显扩张(1B) 图2 患者女,19岁,2型自身免疫性胰腺炎合并溃疡性结肠炎。超声内镜下见腺头、尾部实质内多发片状强回声,直径0.5~11.1 cm,后方无声影;胆总管、胰管末见明显扩张,胰腺及胰周末见明确占位性病变
25例患者血清IgG4水平均在正常范围。中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibodies,ANCA)阳性率35.3%(6/17),抗核抗体(anti-nuclear antibody,ANA)阳性率29.2%(7/24)。1例ANCA和ANA同时阳性,3例急性胰腺炎患者血淀粉酶及脂肪酶升高。
16例病理确诊的患者中,2例为手术病理,1例为介入穿刺组织活检,13例(81%)为EUS-FNA。病理检查均见胰腺组织胰管管壁粒细胞浸润,胰管内较多中性粒细胞聚集(图3)。

图3 2型自身免疫性胰腺炎胰腺组织病理改变(苏木精-伊红染色 ×40)
2例手术患者术后恢复良好,未再出现腹痛发作。其余患者均在激素治疗后获得临床及影像学表现的缓解。所有患者均在诊断后随访6个月以上,均未出现复发证据,无胰腺炎再发(包括发作性上腹痛、胰酶升高及胰腺影像学改变),均无血清CA19-9异常。
三、2型AIP与1型AIP患者比较
与1型AIP患者比较,2型AIP发病年龄低;腹痛发病率高,无黄疸;胰腺外器官受累发生率低,且主要集中于肠道;血清IgG4水平均在正常范围内;无1例复发。两组上述差异均有统计学意义(表1)。
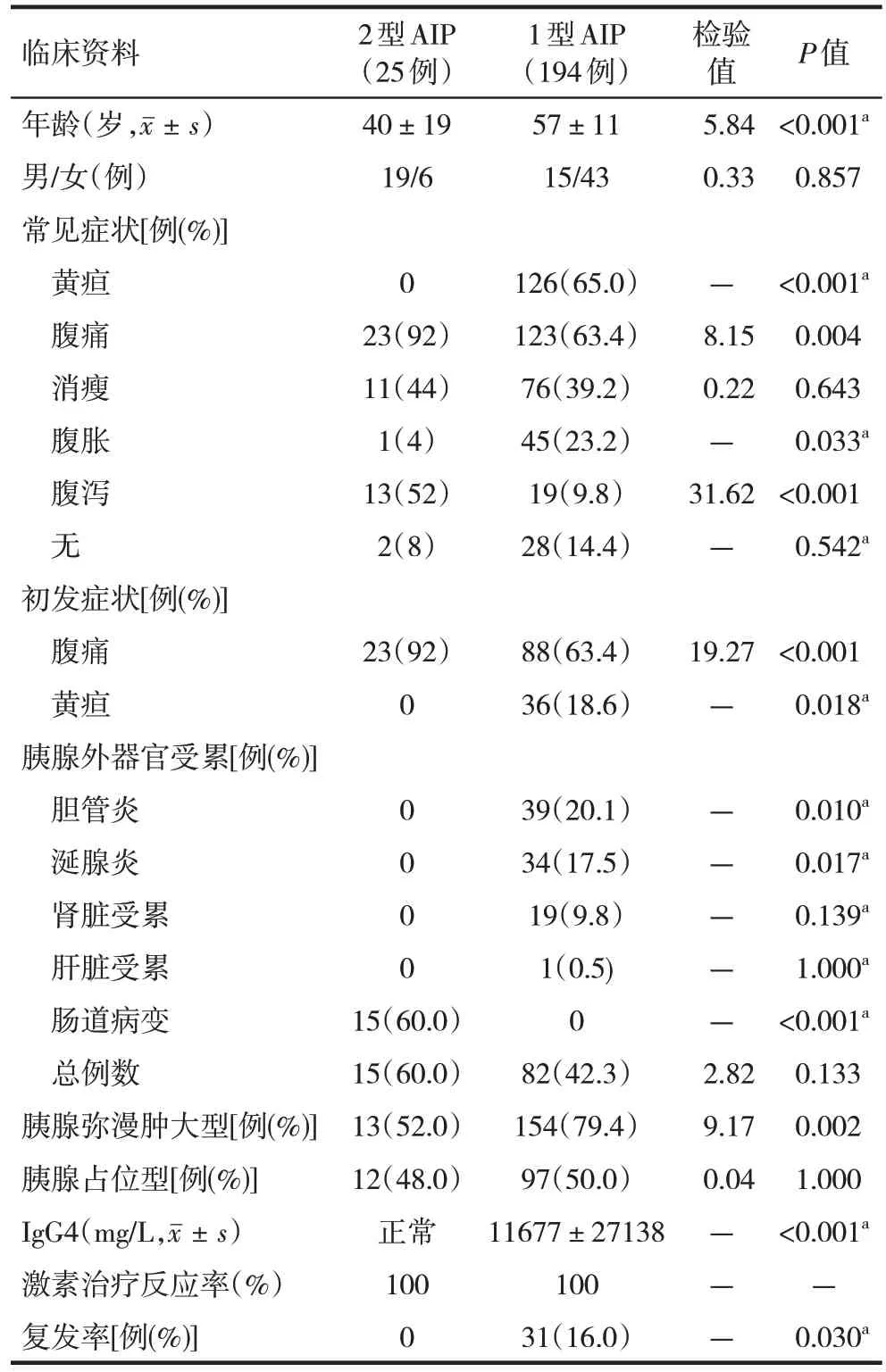
表1 2型AIP与1型AIP患者临床特征比较
四、2型AIP中合并IBD的相关特点
18例合并IBD的2型AIP患者年龄为(37±18)岁,男性13例,女性5例;IBD病史为(11.6±12.6)个月。16例合并UC(E3全结肠型15例,E1直肠型1例)的患者中,10例经影像学检查发现,4例行结肠镜检查发现,1例在AIP治疗好转后1年发现。1例CD患者合并多发肠道狭窄伴肠瘘,CD病情发作间期出现胰腺炎。1例未定型结肠炎患者在肠瘘穿孔手术恢复期发现胰腺炎。
讨 论
2型AIP的发病率和患病率在全球范围内有所不同,欧洲和北美的发病率较高,而亚洲和其他地区较低。Conti等[11]纳入10个国家共1 064例AIP患者,其中2型仅占8.08%。Kamisawa等[12]的一项研究报道,2型AIP患者在165例日本AIP患者中只有2例(1.2%),在124例韩国患者中有7例(5.6%)。近年来有研究提示亚洲2型AIP有所增加[7]。本中心既往研究在2016年以前仅有6例2型AIP,占AIP患者的3%。本次研究提示该比例达到约4%,呈增加趋势。
本研究结果显示,与1型AIP比较,2型AIP患者发病年龄低,最常见症状为腹痛,60%患有IBD,与文献报道的腹痛是2型AIP最常见的临床症状,且大多数患者同时患有IBD的研究结果一致[8]。无痛性黄疸是1型AIP最常见的临床症状,常累及胰腺外器官,而2型AIP极少出现黄疸,胰腺外器官较少累及[5]。本组无1例出现黄疸,无胰腺外器官累及,提示2种类型AIP的发病机制可能存在差异,值得深入探讨。本研究发现多数2型AIP患者合并肠道炎症性病变。3例患者因胰腺炎原因未明行结肠镜发现UC,进而确诊2型AIP,提示详细询问症状并合理选择相应检查,对于2型AIP诊断具有重要意义。2型AIP可能与IBD的活动不平行,与文献报道一致[13]。总之,由于IBD同样可能有腹痛和消瘦等表现,可导致临床忽视及漏诊。肠道受累应当成为2型AIP机制研究的切入点。
本组部分患者是在IBD治疗过程中通过影像学评估发现胰腺病变后被诊断为2型AIP。2型AIP的影像学特征和1型AIP一样多变。弥散型胰腺肿胀须注意和急性水肿性胰腺炎[14]鉴别。局灶性肿物可以是胰腺肿瘤,也可能是以胰腺肿物为表现的AIP[15]。本组患者多表现为胰腺弥漫增大,甚至出现与1型AIP相同的包壳征(capsule-like rim),其次表现为胰腺占位病变,与文献报道一致[16]。虽然基于增强CT的临床研究证实,放射组学分析可以定量测量病灶内异质性,有助于区分肿块型胰腺炎和胰腺恶性肿瘤,然而这些特征很难用肉眼检测到,需要借助特殊的技术支持实现[17],暂时还难以广泛应用。因此,单纯依靠影像学对于2型AIP的诊断价值有限。结合病史和影像学可以显著提高2型AIP的临床发现。
EUS对2型AIP的诊断具有重要价值。2型AIP的综合诊断需结合病史、影像、病理及糖皮质激素的治疗反应来确定,诊断难度较大。本组早期有2例胰腺占位病变患者因症状不典型,均按胰腺肿瘤行外科手术,术后病理确诊为2型AIP;3例患者最初因为腹痛、胰酶升高、影像学上胰腺肿胀,符合“急性胰腺炎”的诊断标准。但因治疗效果不佳,患者反复就诊,最终均通过EUS确诊,和国外报道相似[18]。目前,EUS-FNA的诊断意义已获国际共识推荐[19-20]。本组2018年以来发现的2型AIP均经EUS-FNA获得组织而确诊,占所有病例的50%(7/14),提升了对AIP的诊断水平。故建议对不明原因胰腺占位,应尽可能通过EUS-FNA进一步取得病理学证据,排除恶性肿瘤的同时可有助发现2型AIP。
本组所有2型AIP患者的IgG4水平都在正常范围内,这有助于鉴别1型和2型AIP。其他指标如ANA和ANCA阳性率仅为29.2%和35.3%,灵敏度和特异度均不高。因2型AIP缺乏特异的诊断血清学标志物,导致这类患者和胰腺肿瘤、胰腺炎如急性水肿性胰腺炎和慢性胰腺炎很难鉴别。
本研究通过6~12个月的随访,2型AIP对激素治疗反应良好,未见复发,也无严重的并发症或合并症,无恶性肿瘤发生,说明2型AIP短期预后较好。故对激素反应不佳或者反复发作的胰腺炎患者,不要轻易诊断2型AIP。这类患者的长期预后还需要更深入的研究。
本研究存在一定局限性:(1)属于回顾性的临床研究,对2型AIP的筛选进行了非常严格的剔除,可能导致选择性偏差。(2)随访时间较短,例数较少,对于长期预后研究不够。希望通过对该病的不断学习和积累,与国内其他医疗中心一起,加深对该病的理解和认识,提高诊治水平。
利益冲突所有作者声明无利益冲突
作者贡献声明赖雅敏、钱家鸣:初稿撰写、审阅及修改;常晓燕、朱亮:数据结果可视化、分析及整理;杨红、郭涛、杨爱明:方法设计及数据分析;钱家鸣、吴东:方法设计、实验督导、稿件修改及经费获取

