肿瘤治疗的细胞药物递送系统的研究进展
马宝南,孙丽娜,韩美华
中国医学科学院 北京协和医学院 药用植物研究所,北京 100193
根据世界卫生组织发布的《2022 年世界卫生统计报告》中的数据显示,目前全球非传染性疾病中,癌症的死亡率排名前5 位[1],且死亡风险仍有升高的趋势[2-4]。截止2020 年底,全球新发癌症病例约有1 930 万,癌症死亡病例近1 000 万[5-6]。癌症的传统的治疗方法主要为手术[7]、化学疗法[8-9]和放射疗法[10]。但这些临床治疗手段效果仍然不理想,存在治疗局限性[11]、易复发[12]、不良反应大[13-16]、治疗窗口窄[17]等问题。因此,需要研发具有体内长循环、生物利用度高、可以特异性靶向肿瘤的递送系统,来达到更好的治疗癌症的目的[18-20]。纳米颗粒作为药物载体在癌症治疗的靶向递送方面取得了较深远的影响[21],其靶向作用可分为主动靶向和被动靶向,其中主动靶向可促进肿瘤细胞自身对纳米颗粒的主动摄取[22],如抗体–药物偶联物;被动靶向下,由于肿瘤的增强渗透滞留效应(EPR)和增强的渗透效应,使得纳米颗粒被允许优先积累在肿瘤细胞周围[23-24]。目前临床上以被动靶向的纳米药物居多,而主动靶向较难实现[25],并且这两者也由于肿瘤微环境中的高间质流体压力而限制了他们在肿瘤周围的积累[26]。纳米颗粒对人体也存在一定的毒性和药效局限性问题[27-28]。
近年来,研究者们开始探索仿生药物递送系统,其中基于细胞或其衍生物的纳米仿生给药系统是目前新型给药系统的研究热点[29-30]。该纳米仿生给药系统利用细胞天然的同型或异型黏附性质[31],通过物理或化学手段修饰细胞或其衍生物[32-33],使药物进入其内部或负载在其表面,得到具有主动靶向性的药物递送载体[34]。这种载体可具备高载药量、控释特性[35];具有良好的生物相容性、低免疫原性和天然靶向性[36-37];可与活细胞的柔性形态结合。在减少药物被免疫系统攻击的同时提高了药物在组织上积累和作用的效率以及靶向肿瘤能力[38-40]。其中通常被用作药物载体的包括活细胞、死细胞和外泌体。不同的细胞具有不同的活性、靶向性[41]。本文总结了活细胞、死细胞、外泌体及其药物递送系统的载药特点和在肿瘤治疗中的应用,为肿瘤治疗提供了更多的治疗手段。
1 活细胞及其药物递送系统
目前,人体中的一些功能细胞已经被研究应用于不同的领域,已知在药物递送方面,利用活细胞进行药物输送的载体主要有干细胞、血细胞、免疫细胞等,其原理分别为干细胞在损伤部位的修复能力、血细胞的循环能力以及免疫细胞的能力来延长药物在体内的循环时间,以进入肿瘤组织,进行靶向药物输送[42](图1)。血细胞来源于造血干细胞,主要分为红细胞、血小板和白细胞,其中白细胞包含了免疫细胞,分为中性粒细胞、T 淋巴细胞和巨噬细胞。

图1 肿瘤微环境中的细胞(由Figdraw 绘制)Fig.1 Cells in tumor microenvironment (by Figdraw)
1.1 干细胞
干细胞是未分化的细胞,根据发育阶段分为胚胎干细胞和成体干细胞。其中成体干细胞中的间充质干细胞是一种多能前体细胞,具有高度的自我更新和多向分化潜能[43];且有较好的自我增殖能力、肿瘤归巢能力、低免疫原性[44-45];具有强大的肿瘤穿透能力和在肿瘤部位长期驻留能力[46],可作为治疗癌症(如肺腺癌[47])的药物递送载体。Cao 等[48]证明了使用间充质干细胞可以实现将生物相容性SiO2纳米颗粒封装的光敏剂递送至肿瘤后进行光热治疗,实现了有效的肿瘤破坏。Litvinova 等[49]研究人类间充质干细胞包载微胶囊的实验显示,人类间充质干细胞可以在适当的条件下有效地装载合成的微胶囊,并且可以保留间充质干细胞细胞的完整性、运动性和孔迁移能力(8 μm)。Huang 等[50]基于间充质干细胞的多功能平台,通过整合间充质干细胞的肿瘤靶向递送和介孔SiO2纳米粒子靶向原位胶质母细胞瘤证明了间充质干细胞载药纳米粒比单独的纳米粒子具有更高的肿瘤摄取效果。
同时,在研究间充质干细胞装载各种抗癌药物输送至肿瘤部位的实验中发现,间充质干细胞对一些细胞毒性较大的抗癌药物具有较高的耐药性。如Pessina 等[51]证明间充质干细胞可以在较高浓度的紫杉醇溶液中存活,并可以选择性将紫杉醇递送至白血病细胞中。Kalimuthu 等[52]证实了阿霉素没有影响间充质干细胞的肿瘤归巢能力。
1.2 血细胞
基于血细胞(红细胞、血小板和白细胞)的载体在肿瘤靶向药物输送方面具有很多特性,使其成为较理想的药物载体[3],如降低免疫原性并延长药物在体内的循环时间;一般情况下,血细胞具有生物降解性,不会因载体生物降解而产生有毒产物[54];由于其膜上具有特定的蛋白质标记,靶向递送血细胞是机体的本能[55];由于血细胞膜的限制或亲和力,药物将以受控方式释放,使稳态浓度波动显著降低。因此,血细胞是载药细胞的重要来源之一。
1.2.1 红细胞 红细胞作为一类无核细胞呈双凹形,其整个内部体积和扩展表面均可用于运输各种化合物[56];并且红细胞是血液中最丰富的血细胞类型,具有生物相容性、高载药量、低免疫原性等特点[57-58]。由于红细胞表面的CD47 蛋白与SIRPa 的相互作用可以调节免疫系统中巨噬细胞的吞噬摄取[59],使其可以在体内长时间循环。红细胞本身对机体无毒,可完全被生物降解[60];同时其半透膜可以防止药物被快速清除而实现缓释[61]。以红细胞为载体的递送系统,针对红细胞工程开发了多种策略,主要分为基因工程方法和非基因工程方法[62]。基因工程方法中,可以在红细胞表面引入编码酶识别位点的非天然基因,从而使治疗性蛋白质或药物能够共价连接到红细胞表面[63]。非基因工程方法主要包括封装、吸收和生物偶联[64]。
在肿瘤的治疗方面,由于红细胞没有遗传物质,减少了肿瘤转化的可能性[65]。红细胞作为药物载体,可通过细胞内酶的代谢将非渗透性药物转化为可扩散活性药物来实现递送一些抗癌分子的效果,既可提高其疗效,又能降低抗癌药物的毒性[66]。Pierige 等[67]将2-Fluoro-ara-AMP 以游离形式封装在红细胞中,在乳腺癌细胞系(MCF-7、MDA-MB-435 细胞)上进行了测试,结果显示该药物可以抑制癌细胞的增殖,并可以实现缓慢而持续地输送到血液循环中。Bachet 等[68]将L-ASP 封装到红细胞(ERY-ASP)中以评估其对胰腺癌治疗效果,结果显示患者对其耐受性良好。此外,一些研究发现,可以利用红细胞制备用于治疗癌症的纳米递送载体疫苗[69-70]。Han 等[71]发现负载肿瘤抗原的纳米红细胞体可以与抗程序性死亡配体1(PD-L1)阻断相结合,在体内引发抗原反应,从而抑制B16F10、4T1肿瘤模型中的肿瘤生长。
1.2.2 血小板 血小板同红细胞一样,是一种无核细胞[72],寿命为9~10 d,是药物递送载体的良好选择[73]。其主要的生理作用为止血,可应对手术等相关的血管损伤[74]以及在炎症和抗菌宿主防御方面发挥了重要作用[75]。血小板内部含有多种因子以促进血管的生成和再生细胞的增殖,如生长因子、趋化因子和细胞因子[76]。这些生理作用表明血小板作为药物载体具有高安全性和可再生性。另一方面,血小板微粒是循环系统中最丰富的微粒,具有消除合成和聚合物药物输送系统的不良反应[77]。作为药物载体,血小板可以通过体外工程化进入血液循环,也可以通过在体内结合前药或纳米颗粒搭便车来实现靶向给药[78]。
对于癌症的治疗,有大量研究表明血小板在提供刺激、激活趋化因子分泌方面发挥了重要作用,从而创造了促进转移性肿瘤种植和最终肿瘤过度生长所需的适宜微环境[79]。因此,血小板具有维持肿瘤血管完整性和促进肿瘤转移的作用[80]。Sarkar等[81]以血小板为递送载体将阿霉素递送到肺腺癌细胞系(A549)中,结果表明与游离药物相比,载药血小板在体外和体内模型中诱导细胞毒性的效率更高。由于血小板的存在,使得阿霉素等抗癌药物的毒性降低,并增强了对肿瘤细胞生长的抑制作用[82]。此外,血小板还可以作为骨髓瘤异种移植体内成像的载体,Dai 等[83]利用卡比拉胺来抑制血小板聚集,将血小板与抗肿瘤蛋白结合,以实现骨髓瘤肿瘤体内外靶向和成像。
1.2.3 白细胞 白细胞作为血细胞之一,在血液中具有自由循环和选择性靶向发炎的血管系统以应对癌症等功能[84]。白细胞最突出的作用体现在免疫方面。根据其染色时的形态、着色等特征,白细胞作为免疫细胞用于肿瘤靶向递送系统的药物载体有3 种类型[85]:多形核白细胞中的中性粒细胞、淋巴细胞中的T 细胞和单核细胞巨噬细胞。这些免疫细胞具有先天性和特异性靶向作用、低免疫原性、提高疗效等特点[86]。由于白细胞在肿瘤微环境中的作用[87]和具有与肿瘤细胞共同的物理特性[88],可以将纳米治疗药物输送到肿瘤部位。纳米粒子可以通过“搭便车策略”掺入到白细胞中或在其表面固定,也可以利用白细胞衍生的膜成分包裹纳米粒子[89]。
(1)中性粒细胞 人体中最丰富的白细胞为中性粒细胞,占到循环白细胞数量的50%~70%[90],是炎症反应中最快到达炎症部位的免疫细胞[91],其从循环部位到炎症部位的迁移是一个自然过程,并具有高特异性和流动性[92]。因此,中性粒细胞是运输药物或纳米药物的优秀细胞载体,可以延长药物在体内的循环时间,且不会被免疫系统清除[93-94]。现有研究表明由于纳米粒内化不影响中性粒细胞的存活、凋亡或激活,中性粒细胞可以装载纳米药物复合物以解决药物本身的毒性[95]。
研究显示,中性粒细胞不仅可以在炎症部位起作用,还存在于肿瘤微环境中,具有抗肿瘤功能[96],并且显示出固有的肿瘤归巢和药物携带特性[97]。Chu 等[98-99]在研究中性粒细胞在肿瘤治疗中的作用时发现,纳米粒子可以通过在体内劫持中性粒细胞或通过控制肿瘤微环境促进中性粒细胞的浸润来增强治疗效果。Hao 等[100]将PLGA 纳米颗粒与CXCL1 水凝胶组合,在黑色素瘤小鼠模型中进行实验证明了内源性嗜中性粒细胞可以在体内参与纳米粒子递送来实现抑制肿瘤的目的。也有研究发现,中性粒细胞可以穿透血脑屏障治疗脑部的相关疾病[101]。Xue 等[102]将含有紫杉醇的脂质体中性粒细胞递送到经手术切除的神经胶质瘤小鼠中,发现其可以抑制肿瘤的复发,从而证明了中性粒细胞介导的药物递送的有效性。
(2)T 细胞 T 细胞是人体中第2 丰富的白细胞[103]。因其作为适应性免疫系统的一部分,可以特异性识别抗原,且每个细胞仅呈递一种抗原,所以极具特异性,是一种优秀的靶向细胞[104]。同时当T细胞遇到各自的抗原时,其受体会导致细胞表面还原电位增加,进而发出信号,分泌细胞,可诱导抗原呈递细胞死亡的蛋白质,最终导致细胞凋亡[105]。T 细胞的这两个特性表明了其在药物递送和肿瘤治疗中的重要潜能[39]。
在肿瘤治疗中,嵌合抗原受体T 细胞是目前研究学者关注的一个热点,其被研究应用于治疗脑胶质瘤和黑色素瘤[106],且被美国食品药品管理局批准用于淋巴瘤[107]。Stephan 等[108]证明了将载有辅助药物的纳米颗粒结合到过继性T 细胞疗法模型中可以显著消除肿瘤,表明T 细胞是一种可以用于主动靶向药物递送的、有前途的载体。此外,Pohl-Guimaraes 等[109]证明了经过RNA 修饰的T 细胞可以穿过血脑屏障作为一个多功能平台,将治疗大分子药物递送到中枢神经系统恶性肿瘤部位。
(3)巨噬细胞 巨噬细胞是最大的一种白细胞类型[110],是先天免疫系统的主要吞噬细胞,根据其位置和宿主要求,巨噬细胞可以通过周围微环境的调节来表现出不同的表型和功能特性,具有功能特异性[111]。在各种刺激下可被极化成不同功能的表型,一般可分为M1 型和M2 型[112]。M1 型巨噬细胞可以捕获、吞噬和裂解肿瘤细胞,并表达一系列免疫刺激细胞因子;M2 型巨噬细胞则在肿瘤微环境中充当免疫抑制剂,表达多种抗炎分子[113]。由于巨噬细胞具有良好的生物相容性,是丰富的表面受体;可以感知趋化信号,并高效地定位肿瘤[114];在体内可以延长药物的循环和释放、增强药物稳定性、降低免疫原性[115],因此其在癌症治疗药物递送方面具有巨大潜力。巨噬细胞特异性药物递送系统纳米载体的巨噬细胞靶向策略可分为两类:被动靶向(主要由含有大量巨噬细胞的单核吞噬系统驱动)和主动靶向(主要由配体受体相互作用驱动)[116]。
肿瘤微环境主要呈低pH 值和缺氧状态[117-118],会吸引巨噬细胞积聚在肿瘤的血管缺氧部位[119]。Pang 等[120]利用巨噬细胞的内在归巢特性,使其作为“特洛伊木马”携带载药纳米颗粒穿过血脑障碍,最终到达脑肿瘤部位。肿瘤微环境中存在的肿瘤相关巨噬细胞可以增强或介导细胞毒剂和检查点抑制剂的抗肿瘤活性[121],是影响进展、转移和肿瘤复发的癌症的关键参与者[122]。Qiu 等[123]开发了一种以巨噬细胞为载体来治疗三阴性乳腺癌术后复发的研究,将紫杉醇和白藜芦醇装载在R8 修饰的聚乙二醇化脂质体中,通过巨噬细胞的摄取进行封装,进而构建了具有高载药量和炎症/肿瘤趋向性的细胞介导载体,以达到增强术后肿瘤复发的治疗效果。
细胞载药过程和作用在不同生理条件下的作用优势见图2。
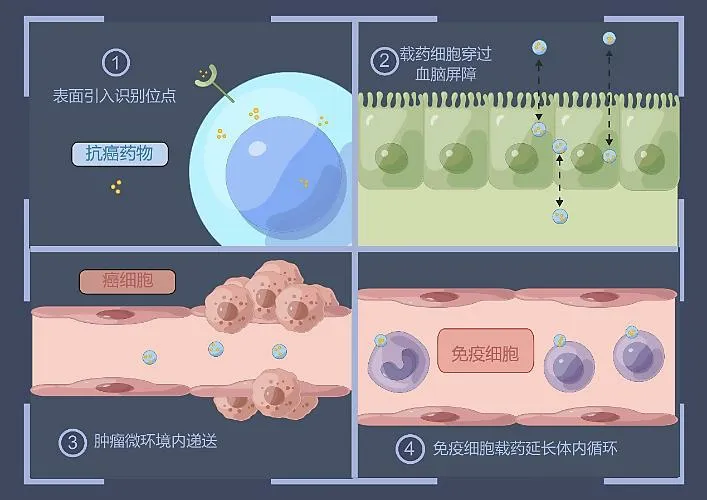
图2 细胞载药过程和作用在不同生理条件下的作用优势(由Figdraw 绘制)Fig.2 Process of cell drug loading and its action advantages under different physiological conditions (by Figdraw)
2 死细胞及其药物递送系统
目前,细胞载药中多以活细胞载体为主,在治疗肿瘤时多依赖于肿瘤微环境的作用以及细胞本身的特点和作用,但在药物有效性、靶向性方面还有待提高,如活细胞内药物负载可能会导致细胞特性的变化、会改变细胞表面蛋白和细胞膜的流动性,从而影响细胞活性,并增加免疫原性[124];或当活细胞用于靶向肿瘤的药物递送和癌症治疗中时,其与癌细胞载药相比不具有同源靶向性[125]。因此,具有治疗性的死细胞(低温休克的癌细胞)成为了治疗肿瘤疾病的新选择。Ci 等[126]基于急性髓性白血病癌变细胞本身“骨髓归巢”的特点将急性髓性白血病细胞用液氮处理使其冷冻休克(完全丧失增殖能力),构建具有骨髓靶向功能的递药系统,在消除致瘤性并保持细胞结构完整性的同时,提高化疗药物阿霉素在骨髓内的富集,并抑制急性髓性白血病细胞增殖。
3 细胞衍生物外泌体及其药物递送系统
外泌体是一种内源性细胞的外囊泡,是细胞衍生物中最常见、应用于载药最多的一类囊泡,其直径为40~100 nm,含有蛋白质、脂质等生物分子[127],其脂质双分子层可以保护药物的正常运输[128],保证药物在体液中循环,具有血液循环稳定性强、长期安全等特点[129-130]。由于不同细胞分泌的外泌体携带不同的信号分子,且基于本身尺寸小的特点,因此外泌体是一种可以实现靶向递送的天然纳米药物载体[131]。外泌体的来源主要是干细胞、免疫细胞(T 细胞、NK 细胞、巨噬细胞等)以及肿瘤细胞衍生的外泌体[132]。此外,外泌体还具有“归巢”的能力,即可以靶向该外泌体的源细胞。
外泌体的分离纯化方法主要有超速离心法[133]、免疫分离法[134]和超滤法[135]。载药方法分为两类(图3[136]),一类是在供体细胞中直接载药,分为转染和共孵育;另一类是形成外泌体后载药,主要有电穿孔和直接混合法。在癌症的治疗方面,外泌体可以通过表面的膜蛋白与受体细胞相互作用,将抗癌药物选择性地递送到癌细胞表面或内部,这种递送药物的方式可以克服多药耐药相关蛋白(如P-糖蛋白)介导的耐药性[137]。同时,外泌体还具备生物利用度高的特性,可以通过血脑屏障等生物屏障[138]。
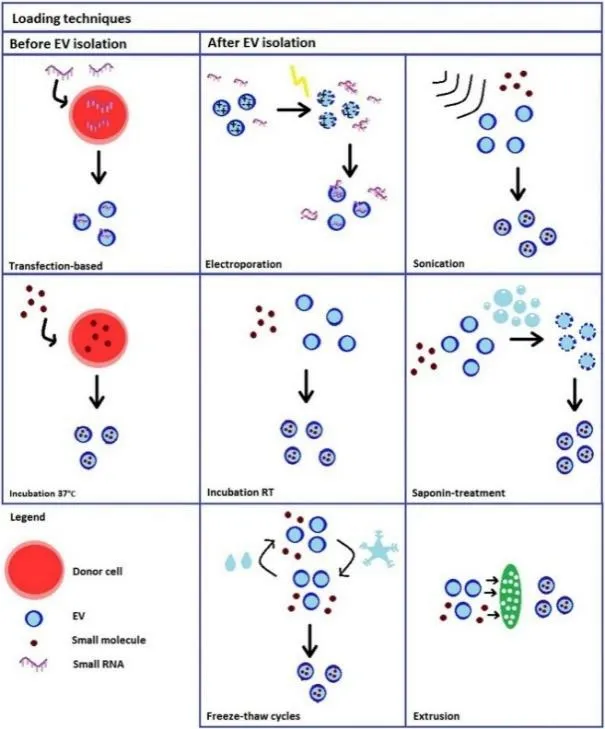
图3 外泌体的两类载药方法Fig.3 Two kinds of drug loading methods of exosomes
外泌体作为小分子药物递送载体已经被许多研究者进行了广泛的研究。外泌体可以递送多种药物,包括亲水性药物和疏水性药物,如阿霉素[139]、多巴胺[140]、姜黄素[141]、紫杉醇[142]。Haney 等[143]基于巨噬细胞的外泌体载药紫杉醇和阿霉素在肺转移的小鼠模型中表现出高抗癌的效果,同时靶向三阴性乳腺癌在免疫活性BALB/C 小鼠中的原位小鼠T11 肿瘤和无胸腺nu/nu 小鼠中显示出抗肿瘤作用。Osterman 等[144]证明用胰腺癌的外泌体载姜黄素可以增强姜黄素的功效。Sun 等[145]使用供体细胞为人腺癌细胞、小鼠乳腺肿瘤细胞的外泌体负载姜黄素,通过实验数据表明外泌体递送的姜黄素在血液中更稳定,且浓度更高,并增强了靶标特异性。
不同载药细胞的优势和应用的总结见表1。

表1 不同载药细胞的优势和应用Table 1 Advantages and applications of different drug-loaded cells
4 结语和展望
在肿瘤的治疗中,细胞载药由于其内源性的特点,在靶向性、生物相容性等方面展现出了较多的优势,但该类给药系统应用于临床仍然面临着一些挑战:首先,药物负载在细胞内部可能会导致细胞特性的变化,会改变细胞表面蛋白和细胞膜的流动性,从而影响细胞活性,并增加免疫原性[124]。如红细胞作为载体时,会影响细胞的生物相容性,从而导致药物暴露[151]。其次,有些细胞类型如巨噬细胞,作为载体时需要细胞在体液中保持循环状态,从而达到迁移和归巢,并在肿瘤部位大量释放药物[152],然而,体内的细胞保护机制可能会排泄游离的药物,并中和它们的内吞作用,导致治疗药物在到达肿瘤部位之前提前释放[153]。此外,当细胞用于靶向肿瘤的药物递送和癌症治疗中时,其与癌细胞载药相比不具有同源靶向性[125],会影响药物在肿瘤部位的释放效果。目前关于死细胞载药的相关研究较少,存在一定的不确定性,有关癌细胞在体内的代谢和安全性,即是否会诱导肿瘤的发生等都有待进一步探究。
利益冲突所有作者均声明不存在利益冲突

