瑞马唑仑对颅脑损伤大鼠脑组织损伤及TLR4/MyD88/NF-κB通路的影响
王东亚, 乔 丹, 陈炜佳, 张懿兰, 范艳霞, 刘博峰
(河北省保定市第二医院, 河北 保定 071000)
颅脑损伤是神经外科常见的一种神经系统损伤性疾病,主要是由于钝性创伤或机械力创伤导致脑功能、神经功能暂时或永久性损害,其主要病理特征为神经炎症、氧化应激、细胞凋亡、线粒体障碍等[1]。随着经济发展,其发病率逐年上升,由于颅脑损伤具有高致残率和高病死率,严重影响患者生存健康,给患者家庭及社会带来沉重的经济负担。目前主要通过手术颅内血肿清除术+去骨瓣减压术,扩大颅内空间,降低颅内压以控制病情发展,但术后易出现脑积水、硬膜下积液、骨窗脑组织疝等并发症,甚至导致病情恶化[2]。寻求新的治疗方法减轻颅脑损伤迫在眉睫。TLR4/MyD88/NF-κB通路参与颅脑损伤引起的神经炎症、细胞凋亡等过程并发挥重要调控作用,研究显示,抑制TLR4/MyD88/NF-KB通路,可以减少下游炎症因子的释放,减轻神经炎症反应,保护脑组织损伤[3]。瑞马唑仑是重症患者常用的一种可诱导和维持全身麻醉的新型苯二氮卓类镇静药物,瑞马唑仑联合右美托咪定能够改善患者的血流动力学,降低炎症因子水平,保护创伤性颅脑损伤[4]。但是关于瑞马唑仑是否可以通过调控TLR4/MyD88/NF-KB通路减轻颅脑损伤大鼠脑组织损伤尚不清楚,本文主要探索瑞马唑仑对颅脑损伤大鼠脑组织损伤及LR4/MyD88/NF-KB通路的影响,以期为颅脑损伤治疗提供新的方法。
1 材料与方法
1.1主要材料:质量200±20g SPF级SD大鼠购于滨州医学院(生产许可SCXK:(鲁)2021-0005);瑞马唑仑(200814AK)购于江苏恒瑞医药公司;LPS(511219ps)购于美国Invivogen公司;TUNEL染色试剂盒(C1091)及TNF-α(PT516)、IL-1β(PI303)、IL-6(PI328)ELISA试剂盒购自上海碧云天生物公司;Bax(5023)购于CST公司;TLR4(ab22048)、MyD88(ab219413)、NF-κB(ab32360)、p-NF-κB p65(ab239882)、Bcl-2(ab185002)购于英国abcam公司。
1.2方 法
1.2.1造模与分组处理:将大鼠分为Control组、BI组、Rem-L、Rem-M、Rem-H组、Rem-H+LPS组;Control组:仅暴露脑硬膜,不进行颅脑打击;BI组:麻醉大鼠后将其大脑固定,剃毛备皮、消毒,无菌环境下打开头部,剥离骨膜,中线颅顶骨暴露出来,然后在冠状缝后、中线旁区域用牙科钻钻打骨窗,并用40g的圆柱形击锤在20cm高度自由落体击打骨窗,最终导致大鼠颅脑损伤,骨蜡封闭骨窗,缝合头皮,饲养笼正常饲养[5];造模成功后,Rem-L、Rem-M、Rem-H组分别腹腔注射5、10、20mg·kg-1·d-1瑞马唑仑(注射剂量由大小鼠之间剂量换算而得)[6];Rem-H+LPS组腹腔注射20mg·kg-1·d-1瑞马唑仑及腹腔注射0.4mg·kg-1·d-1LPS[7]。对照组和模型组腹腔注射与Rem-L、Rem-M、Rem-H组等量的生理盐水;连续14d。
1.2.2神经功能评分:给药结束后,通过对各组大鼠进行运动、感觉和平衡训练,从运动、感觉、平衡、反射4个方面进行神经功能综合评估,记录其mNSS评分[8]。评分与神经功能损伤呈正比,0分代表完全正常,总分18分。
1.2.3脑组织含水量检测:完成神经功能评分后,各组随机选择6只麻醉处死,取出脑组织称量湿重,随后将其放入60℃烤箱烘干48h,称其干重,脑组织含水量%=(脑组织湿重-干重)/脑组织湿重×100%。
1.2.4炎症因子水平检测:各组随机选择6只大鼠断头处死并于冰上分离出大脑组织,加入PBS,冰上研磨,3000r/min离心15min,取上清,ELISA试剂盒检测脑组织中TNF-α、IL-1β、IL-6水平。
1.2.5脑组织形态学观察:从各组剩余大鼠中随机选择6只处死,取脑组织,4%多聚甲醛固定,石蜡包埋切片,脱蜡、苏木精染色,水洗后伊红染色,水洗、脱水、二甲苯透明,中性树脂密封,光学显微镜下观察脑组织形态学变化。
1.2.6细胞凋亡检测:取1.2.5制作的石蜡切片,脱蜡后加入不含DNase的蛋白酶K,37℃反应30min,洗涤3次,3%过氧化氢溶液室温孵育20min,加入生物素标记液,37℃避光孵育60min,洗涤后滴加标记反应终止液,室温孵育10min,加Streptavidin-HRP工作液,室温孵育30min,滴加DAB显色液,室温孵育5~30min,苏木素染色液进行细胞核染色,再次洗涤3次,脱水、透明、封片,显微镜下观察染色结果。
1.2.7蛋白免疫印迹检测TLR4、MyD88、NF-κB、P-NF-κB p65、Bax、Bcl-2蛋白:取各组剩余6只大鼠脑组织,提取其总蛋白测定蛋白浓度,随后进行电泳分离、转PVDF膜,封闭液室温封闭,加入TLR4、MyD88、NF-κB、P-NF-κB p65、Bax、Bcl-2一抗过夜孵育,洗膜后加入二抗室温孵育,清洗后加入ECL显色液显色并照相,Image J软件分析各蛋白表达水平。
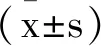
2 结 果
2.1瑞马唑仑对BI大鼠神经功能评分的影响:与Control组相比,BI组大鼠神经功能评分上升(P<0.05);与BI组相比,Rem-L、Rem-M、Rem-H组大鼠神经功能评分依次下降(P<0.05);与Rem-H组相比,Rem-H+LPS组大鼠神经功能评分上升(P<0.05);见表1。
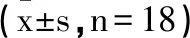
表1 各组大鼠神经功能评分
2.2瑞马唑仑对BI大鼠脑组织含水量的影响:与Control组相比,BI组大鼠脑组织含水量上升(P<0.05);与BI组相比,Rem-L、Rem-M、Rem-H组大鼠脑组织含水量依次下降(P<0.05);与Rem-H组相比,Rem-H+LPS组大鼠脑组织含水量上升(P<0.05);见表2。
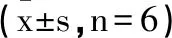
表2 各组大鼠脑组织含水量
2.3瑞马唑仑对BI大鼠炎症因子水平的影响:与Control组相比,BI组大鼠脑组织TNF-α、IL-1β、IL-6水平上升(P<0.05);与BI组相比,Rem-L、Rem-M、Rem-H组大鼠脑组织TNF-α、IL-1β、IL-6水平依次下降(P<0.05);与Rem-H组相比,Rem-H+LPS组大鼠脑组织TNF-α、IL-1β、IL-6水平上升(P<0.05);见表3。
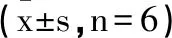
表3 各组大鼠炎症因子TNF-α IL-1β IL-6水平
2.4瑞马唑仑对BI大鼠脑组织形态学变化的影响:Control组大鼠脑组织神经元细胞分布均匀、结构清晰,核仁大且圆;与Control组相比,BI组大鼠脑组织神经元变性坏死,数量减少,体积缩小,脑皮质厚度变薄,细胞核结构模糊,核仁消失;与BI组相比,Rem-L、Rem-M、Rem-H组大鼠脑组织神经元细胞损伤逐渐减少,细胞结构相对较清晰;与Rem-H组相比,Rem-H+LPS组大鼠脑组织神经元细胞数量减少、体积缩小,脑皮质厚度变薄,核结构模糊;见图1。

图1 各组大鼠脑组织形态学变化(HE,×200)
2.5瑞马唑仑对BI大鼠脑组织神经凋亡的影响:与Control组相比,BI组大鼠脑组织神经元凋亡率、Bax表达上升,Bcl-2表达下降(P<0.05);与BI组相比,Rem-L、Rem-M、Rem-H组大鼠脑组织神经元凋亡率、Bax表达依次下降,Bcl-2表达依次上升(P<0.05);与Rem-H组相比,Rem-H+LPS组大鼠脑组织神经元凋亡率、Bax表达上升,Bcl-2表达下降(P<0.05);见图2、图3、表4。
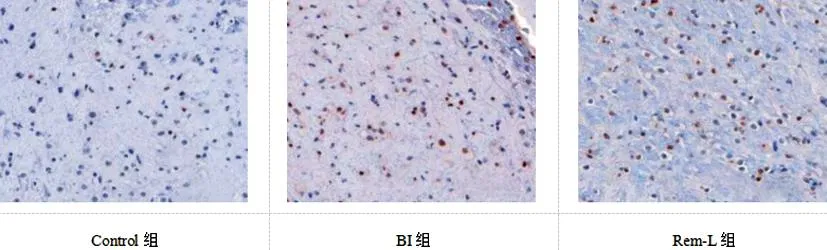
图2 各组大鼠脑组织神经元凋亡情况(TUNEL染色,显色法)(×100)

图3 Western blot检测Bax、Bcl-2蛋白表达
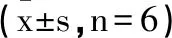
表4 各组大鼠脑组织神经元凋亡情况
2.6瑞马唑仑对BI大鼠TLR4/MyD88/NF-κB通路的影响:与Control组相比,BI组大鼠脑组织TLR4、MyD88、NF-κB、p-NF-κB p65表达上升(P<0.05);与BI组相比,Rem-L、Rem-M、Rem-H组大鼠脑组织TLR4、MyD88、NF-κB、p-NF-κB p65表达依次下降(P<0.05);与Rem-H组相比,Rem-H+LPS组大鼠脑组织TLR4、MyD88、NF-κB、p-NF-κB p65表达上升(P<0.05);见图4、表5。
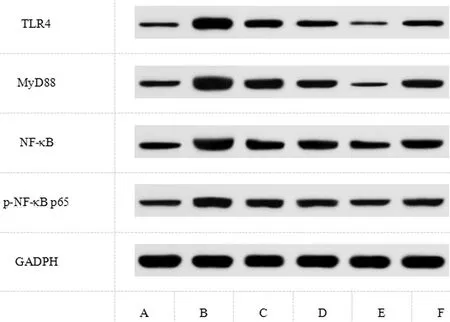
图4 Western blot检测TLR4、MyD88、NF-κB、p-NF-κB p65蛋白表达
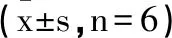
表5 各组大鼠TLR4 MyD88 NF-κB p-NF-κB p65表达水平比较
3 讨 论
颅脑损伤根据时间发展又分为原发性和继发性颅脑损伤,其中原发性颅脑损伤指当下外力直接作用于头部引发的脑组织损伤,继发性颅脑损伤是在原发性颅脑损伤基础上,引起脑组织缺氧缺血、脑水肿、炎症反应、氧化应激损伤、细胞凋亡、线粒体功能障碍等,导致颅脑损伤加重。瑞马唑仑作为一种镇静药物可以抑制神经炎症、减少神经元凋亡,发挥神经保护作用[9]。
在颅脑损伤时,各种刺激信号可以促进炎症介质的表达,从而促进下游炎症因子TNF-α、IL-1β、IL-6的大量释放及聚集,细胞凋亡关键基因Bax、Bcl-2被激发,诱导细胞凋亡,加重颅脑损伤。其中,TNF-α是中枢神经系统细胞分泌的炎性因子,可以促进自由基生成和脑水肿发生,导致脑神经元坏死,颅脑损伤加重。IL-1β在引发局部炎症反应的同时可诱导凋亡基因Bcl-2/bax的表达,促进神经元细胞的凋亡。IL-6是由IL-1β活化后诱导产生和释放,主要通过诱导单核巨噬细胞产生和释放更多的免疫炎症介质,扩大炎症的级联反应,诱发继发性脑损伤[10]。研究显示,下调损伤大脑组织及血清TNF-α、IL-1β和IL-6的表达,可以减轻损伤大脑组织的炎症反应,改善脑水肿,进而改善创伤型颅脑损伤大鼠的神经功能[11]。抑制Bax蛋白表达,可以减少神经元细胞凋亡,减轻神经功能缺损,保护颅脑损伤大鼠的损伤神经元[12]。另外瑞马唑仑预先给药可以下调Bax表达,上调Bcl-2表达,抑制神经元凋亡,减轻小鼠丘脑出血性脑损伤[13]。本文研究显示,瑞马唑仑可以降低TNF-α、IL-1β和IL-6水平,下调Bax表达,上调Bcl-2表达,减轻神经炎症反应,抑制神经元凋亡,说明瑞马唑仑可以改善颅脑损伤大鼠的脑组织损伤。
TLR4/MyD88/NF-κB通路在颅脑损伤的发病过程中发挥重要作用,当模式识别受体TLR4被激活后可以通过其关键衔接蛋白MyD88依赖性途径传递信号,激活不同的转录因子如NF-κB,使其磷酸化促进炎性细胞因子TNF-α、IL-1β、IL-6的产生,调控Bcl-2、Bax蛋白表达促进细胞凋亡,加重颅脑损伤[14]。研究显示,抑制TLR4/MyD88/NF-κB通路,可以减轻炎症反应,减轻颅脑损伤大鼠的神经炎性损伤,发挥神经元保护作用[15]。本文研究显示,瑞马唑仑可以降低TLR4、MyD88、NF-κB、p-NF-κB p65表达水平,而TLR4激活剂可以部分逆转瑞马唑仑对TLR4/MyD88/NF-κB通路的抑制作用,说明瑞马唑仑可以通过抑制TLR4/MyD88/NF-κB通路,改善颅脑损伤大鼠的脑组织损伤。
综上所述,瑞马唑仑可以通过抑制TLR4/MyD88/NF-κB通路改善颅脑损伤大鼠的脑组织损伤。本研究仍存在局限性,瑞马唑仑对于TLR4/MyD88/NF-κB通路的作用机制尚不清楚,需要进一步实验验证。

