高糖高脂环境下抑制自噬对矢车菊素-3-O-葡萄糖苷保护胰岛β细胞损伤的影响
李 恒, 张翠兰
(海南西部中心医院内分泌科, 海南 儋州 571700)
胰岛β细胞是主要的胰岛细胞,其主要功能是合成并分泌胰岛素,调节机体血糖水平。胰岛β细胞损伤后功能障碍和胰岛素抵抗是2型糖尿病的主要致病因素[1]。处于高糖高脂(high glucose and high fat,HGHF)环境下的胰岛β细胞不仅会发生死亡,还会影响胰岛素分泌水平,导致糖尿病的发生发展[2]。因此,减少或抑制HGHF环境下胰岛β细胞损伤能够延缓糖尿病的发生,这也是有效控制病情持续性恶化而引起多种发病症的关键步骤。矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)是一种广谱存在的花青素类型,属于类黄酮组多酚,主要源于黑色、紫色或红色蔬菜水果中。C3G具有抗炎、抗氧化作用,对于多种疾病如癌症、心血管疾病、肠道疾病和神经退行性疾病的防治中均能够产生积极效应[3]。研究表明,较高的膳食花青素摄入量与较低的糖尿病发生风险相关[4],此外,C3G能够减轻胰岛蛋白和β-淀粉样蛋白(amyloid β peptide 1-42,Aβ1-42)刺激下的胰岛β细胞损伤[5]。然而,C3G抗糖尿病作用的潜在分子机制尚未明确。鉴于此,本研究采用葡萄糖与棕榈酸建立体外HGHF环境,观察C3G对HGHF环境下胰岛β细胞糖脂毒性的抵抗效果并探究其作用机制,以期为糖尿病新治疗方案的开发提供思路。
1 材料与方法
1.1主要材料与试剂:MIN6小鼠胰岛β细胞购于深圳市豪地华拓生物科技有限公司,胎牛血清购于南京森贝伽生物科技有限公司,RPMI-1640 培养液和胰蛋白酶购于美国ScienCell公司,葡萄糖、棕榈酸及3-MA购于美国Sigma公司,C3G和DCFH-DA活性氧荧光探针购于北京康瑞纳生物科技有限公司,CCK-8检测试剂盒购于北京普利莱基因技术有限公司,MDA比色法测试盒、SOD比色法测试盒及GSH比色法测试盒购于武汉伊莱瑞特生物科技股份有限公司,胰岛素ELISA检测试剂盒购于上海远慕生物科技有限公司,Trizol试剂盒购于美国Invitrogen公司,通用反转录试剂盒和荧光定量试剂盒购于北京索莱宝科技有限公司,蛋白裂解液购于上海雅吉生物科技有限公司,BCA蛋白定量试剂盒购于北京天根生化科技有限公司,PVDF膜和ECL化学发光液购于上海碧云天生物研究所,LC3-Ⅱ、LC3-Ⅰ、Beclin-1、Bax、Bcl-2、Cleaved Caspase-3、GAPDH抗体及辣根过氧化物酶标记抗体购于英国Abcam公司。
1.2方 法
1.2.1细胞培养:胰岛β细胞使用含10%胎牛血清的RPMI-1640培养液培养,置于37℃、5%CO2恒温箱内,待细胞生长至融合度达到80%以上时,采用0.25%胰蛋白酶消化,进行常规传代。
1.2.2CCK-8法:将胰岛β细胞以每孔5×103个的密度接种于96孔板中,过夜培养后,换用含10、20、30、40、50μmoL/L C3G的培养液处理24h,以未经处理的胰岛β细胞作为对照组,采用CCK-8法检测各处理组细胞活力,按照试剂盒说明书步骤操作,多功能酶标仪测定各孔在490 nm 处的吸光度(OD),计算细胞活力,细胞活力(%)=[(OD处理组-OD空白组)/(OD正常组-OD空白组)]×100%。再将胰岛β细胞以每孔5×103个的密度接种于96孔板中,使用含25mmoL/L葡萄糖与0.5mmoL/L棕榈酸的培养液建立高糖高脂环境,同时添加10、20、30、40、50μmoL/L C3G处理,同样以未经处理的胰岛β细胞作为对照组,单独25mmoL/L葡萄糖与0.5mmoL/L棕榈酸处理的胰岛β细胞作为HGHF组,24h后收集细胞,按照CCK-8法检测各处理组细胞活力。
1.2.3分组与处理:将胰岛β细胞以每孔2×105个的密度接种于6孔板中,在37℃、5%CO2恒温箱过夜培养至细胞贴壁后,分为4组:①对照组,胰岛β细胞在普通培养液中培养24h;②HGHF组,使用含25mmoL/L葡萄糖与0.5mmoL/L棕榈酸的培养液建立HGHF模型,培养细胞24h;③HGHF+C3G组,使用含25mmoL/L葡萄糖与0.5mmoL/L棕榈酸、40μmoL/L C3G的培养液培养细胞24h[6];④HGHF+C3G+3-MA组,使用含25mmoL/L葡萄糖与0.5mmoL/L棕榈酸、40μmoL/L C3G的培养液培养细胞24h,同时添加10mmoL/L自噬抑制剂3-MA处理细胞,3-MA给药剂量参考文献中的剂量[7]。结束后,收集以上4组细胞,CCK-8法检测各处理组细胞活力。
1.2.4氧化应激指标检测:将胰岛β细胞以每孔1×105个的密度接种于6孔板中,按1.2.3分组处理后,添加1μmoL/L DCFH-DA荧光探针,37℃孵育30min,PBS洗涤,采集荧光图像,Image J分析荧光强度。并收集各处理组细胞,弃上清,加入裂解液提取总蛋白,分别按照MDA、SOD、GSH的检测试剂盒说明书,对细胞总蛋白中各指标进行测定。
1.2.5ELISA法:收集各处理组胰岛β细胞,弃上清后,PBS洗涤,分别添加含2.8mmoL/L和16.7mmoL/L葡萄糖的KRBH缓冲液,37℃孵育1h,1000r/min离心20min,收集上清,按照胰岛素ELISA试剂盒说明书测定上清液中胰岛素分泌量。
1.2.6实时荧光定量PCR:采用Trizol法提取各处理组胰岛β细胞的总RNA,检测RNA纯度与浓度。通过逆转录反应获得cDNA,使用荧光定量试剂盒进行扩增,按照说明书配置25μL反应体系,设置条件为95℃、30s;95℃、5s,60℃、30s,40cycles,在CFX96仪上进行反应。反应结束后,获得扩增曲线与溶解曲线,通过2-△△Ct法分析各个待测样本内目的基因的mRNA相对表达量,以GAPDH作为内参。引物见表1。

表1 基因引物序列
1.2.7Western blot:在各处理组胰岛β细胞中加入裂解液充分裂解细胞,离心后收集上清,BCA法定量。根据蛋白浓度在上样孔中加入等量蛋白,通过10%SDS-PAGE电泳分离后转移至PVDF膜,脱脂奶粉封闭 2h,TBST 洗涤,分别加入Bax、Bcl-2、Cleaved Caspase-3抗体(1∶1000),4 ℃摇床孵育过夜,次日,TBST洗膜,加入对应二抗(1∶5000)继续孵育2h,采用ECL化学发光液显影,凝胶成像仪采集蛋白条带,ImageJ分析灰度值,以 GAPDH 作为内参,以目的蛋白与内参蛋白的灰度值之比作为目的蛋白相对表达量。
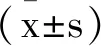
2 结 果
2.1C3G对高糖高脂环境下胰岛β细胞活力的影响:与对照组比较,10、20、30、40、50μmoL/L C3G处理对胰岛β细胞活力均具有显著的促进作用(P<0.05),但各浓度之间的活力差异无统计学意义(P>0.05),见图1A。HGHF组胰岛β细胞活力显著低于对照组(P<0.05),而与HGHF组比较,在高糖高脂环境下,20、30、40、50μmoL/L C3G能够显著提高胰岛β细胞活力(P<0.05),且随着C3G浓度升高,细胞活力越高(P<0.05),但40、50μmoL/L C3G处理下细胞活力之间差异无统计学意义(P>0.05),见图1B,因此后续选择40μmoL/L作为C3G的处理浓度。

图1 各处理组胰岛β细胞活力
加入自噬抑制剂3-MA抑制自噬水平后,对4组胰岛β细胞活力进行检测比较发现,与对照组比较,HGHF组细胞活力显著降低(P<0.05);与HGHF组比较,HGHF+C3G组细胞活力显著升高(P<0.05);而与HGHF+C3G组比较,HGHF+C3G+3-MA组细胞活力则显著降低(P<0.05)。见图2。

图2 各处理组胰岛β细胞活力
2.2C3G对高糖高脂环境下胰岛β细胞氧化应激的影响:利用DCFH-DA荧光探针法检测各组胰岛β细胞内ROS含量,以绿色荧光评价ROS水平。与对照组比较,HGHF组细胞荧光强度显著升高(P<0.05),表明ROS含量增加;与HGHF组比较,HGHF+C3G组细胞荧光强度显著降低(P<0.05),表明ROS含量减少;与HGHF+C3G组比较,HGHF+C3G+3-MA组细胞荧光强度显著降低(P<0.05),表明ROS含量增加。此外,对各组胰岛β细胞内MDA、SOD、GSH进行检测发现,与对照组比较,HGHF组细胞中MDA含量显著上升(P<0.05),SOD活性和GSH-Px含量显著下降(P<0.05);与HGHF组比较,HGHF+C3G组细胞中MDA含量显著下降(P<0.05),SOD活性和GSH-Px含量显著上升(P<0.05);与HGHF+C3G组比较,HGHF+C3G+3-MA组细胞中MDA含量显著上升(P<0.05),SOD活性和GSH-Px含量显著下降(P<0.05)。见表2。
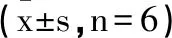
表2 各处理组胰岛β细胞中各氧化应激指标比较
2.3C3G对高糖高脂环境下胰岛β细胞胰岛素分泌水平的影响:分别以2.8mmoL/L和16.7mmoL/L浓度的葡萄糖刺激各组胰岛β细胞后对胰岛素分泌水平进行检测,结果显示,HGHF组胰岛素分泌水平显著低于对照组(P<0.05);HGHF+C3G组胰岛素分泌水平显著高于HGHF组(P<0.05);但与HGHF+C3G组比较,HGHF+C3G+3-MA组胰岛素分泌水平又显著降低(P<0.05)。见表3。
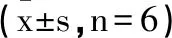
表3 各处理组胰岛β细胞分泌胰岛素水平比较
2.4C3G对高糖高脂环境下胰岛β细胞中自噬信号相关蛋白表达的影响:qRT-PCR检测结果显示,与对照组比较,HGHF组胰岛β细胞中Atg5、LC3、Beclin-1的mRNA相对表达量显著下调(P<0.05);与HGHF组比较,HGHF+C3G组细胞中Atg5、LC3、Beclin-1的mRNA相对表达量显著上调(P<0.05);与HGHF+C3G组比较,HGHF+C3G+3-MA组细胞中Atg5、LC3、Beclin-1的mRNA相对表达量显著下调(P<0.05)。见图3。
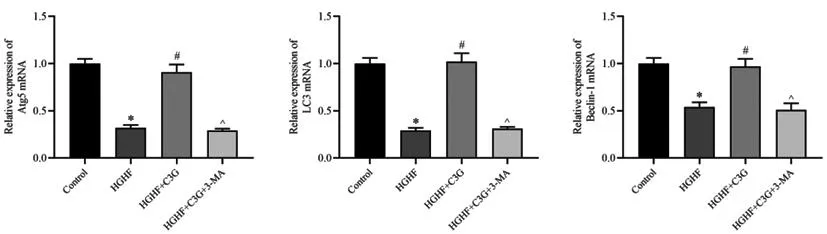
图3 各处理组胰岛β细胞中Atg5、LC3、Beclin-1的mRNA表达水平
Western blot 检测结果显示,HGHF组胰岛β细胞中LC3-Ⅱ/LC3-Ⅰ比值、Beclin-1蛋白相对表达量显著低于对照组(P<0.05);与HGHF组比较,HGHF+C3G组细胞中LC3-Ⅱ/LC3-Ⅰ比值、Beclin-1蛋白相对表达量则显著上调(P<0.05);但HGHF+C3G+3-MA组细胞中LC3-Ⅱ/LC3-Ⅰ比值、Beclin-1蛋白相对表达量又显著低于HGHF+C3G组(P<0.05)。见图4。
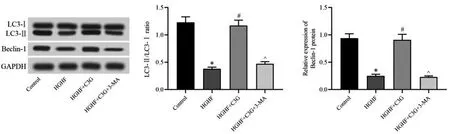
图4 各处理组胰岛β细胞中LC3-Ⅱ/LC3-Ⅰ比值与Beclin-1蛋白表达水平
2.5C3G对高糖高脂环境下胰岛β细胞凋亡信号相关蛋白表达的影响:Western blot检测结果显示,与对照组比较,HGHF组胰岛β细胞中Bax、Cleaved Caspase-3的蛋白相对表达量显著上调(P<0.05),Bcl-2蛋白相对表达量显著下调(P<0.05);与HGHF组比较,HGHF+C3G组细胞中Bax、Cleaved Caspase-3的蛋白相对表达量显著下调且Bcl-2蛋白相对表达量显著上调(P<0.05);与HGHF+C3G组比较,HGHF+C3G+3-MA组细胞中Bax和Cleaved Caspase-3的蛋白相对表达量显著上调、Bcl-2蛋白相对表达量显著下调(P<0.05)。见图5。

图5 各处理组胰岛β细胞中Bax、Bcl-2及Cleaved Caspase-3蛋白表达水平
3 讨 论
2型糖尿病是一种进展缓慢的全身性疾病,病因尚不明确。慢性高脂血症和高血糖是2型糖尿病的典型特征,反复或持续暴露于高葡萄糖和高脂质如饱和脂肪酸环境中时,会导致胰岛β细胞损伤,并损害胰岛β细胞分泌胰岛素的功能。近年来,关于C3G在糖尿病及其并发症中的研究报道不断增加。例如,C3G可以直接促进一氧化碳介导的内皮细胞转运胰岛素水平,从而改善胰岛素抵抗[8];C3G抑制高血糖环境诱导的人视网膜内皮细胞的迁移与侵袭,并减少糖尿病视网膜病变小鼠的视网膜血管渗漏和血管生成[9];C3G能改善糖尿病肾病小鼠的肾功能以及肾组织损伤[10]。由此可见,C3G在糖尿病的治疗中具有较高的潜在价值。本研究使用不同浓度C3G处理胰岛β细胞后,结果显示,胰岛β细胞活力升高,提示C3G对胰岛β细胞活力具有促进作用;此外,在HGHF环境下加入C3G进行干预,能提高胰岛β细胞活力,增加胰岛素分泌水平。以上结果表明,C3G对HGHF环境下的胰岛β细胞具有保护作用。
糖毒性和脂毒性可诱导细胞发生氧化应激反应,这与胰岛β细胞功能障碍和细胞凋亡的发生机制有关。长时间的高糖超负荷会增加细胞中ROS的产生,导致新陈代谢紊乱和细胞内信号传导途径异常。高浓度的游离脂肪酸也会诱导ROS生成,进而影响胰岛β细胞的活性和功能[11]。MDA作为脂质过氧化的最终分解产物,其反映了细胞的脂质过氧化速率或强度,在高糖环境下MDA含量的高低能间接体现胰岛β细胞的损伤程度,即浓度越高表示细胞受损程度越大。SOD作为一种关键的细胞内抗氧化剂,可去除细胞内超氧阴离子自由基,GSH-Px则作为清除剂,通过减少过氧化氢和脂质氢过氧化物来保护细胞膜结构和功能的完整性,这两种指标升高也能反映胰岛β细胞受损[12]。本研究结果显示,HGHF环境下培养的胰岛β细胞中ROS含量和MDA含量上升,SOD活性和GSH-Px含量下降;而在HGHF环境下加入C3G干预的胰岛β细胞中ROS含量和MDA含量下降,SOD活性和GSH-Px含量上升,说明C3G能够抑制HGHF环境下胰岛β细胞内过度的氧化应激,改善细胞损伤。
自噬是一种溶酶体降解途径,通过降解受损蛋白质和细胞器来维持细胞代谢稳态。胰岛β细胞功能与自噬有着千丝万缕的联系。在HGHF环境下自噬通量被阻断,胰岛β细胞受损,胰岛素分泌异常[13]。以往有研究表明,C3G会增加细胞进行选择性自噬的能力,在不利因素下允许细胞靶向特定底物进行降解,以维持细胞内稳态[14]。本实验结果显示,在HGHF环境下加入C3G干预的胰岛β细胞中,Atg5、LC3、Beclin-1 mRNA表达上调,LC3-Ⅱ/LC3-Ⅰ比值与Beclin-1蛋白表达上调,促凋亡因子Bax、Cleaved Caspase-3蛋白表达下调而抑凋亡因子Bcl-2蛋白表达上调。由此推测,C3G对HGHF环境下胰岛β细胞的保护作用可能与其诱导自噬有关。为了验证此推测,加入自噬抑制剂3-MA作用后,C3G对HGHF环境下胰岛β细胞损伤的改善效应消失,该结果进一步明确了C3G对HGHF环境下胰岛β细胞的保护作用与促进自噬有关。
综上所述,本研究表明C3G对HGHF环境下胰岛β细胞具有保护作用,C3G改善能HGHF刺激下的胰岛β细胞活性和胰岛素分泌水平,抑制氧化应激反应,下调促凋亡因子Bax、Cleaved Caspase-3蛋白表达,上调抑凋亡因子Bcl-2蛋白表达,该作用机制可能与其促进HGHF环境下胰岛β细胞的自噬水平有关。本研究进一步揭示了C3G作为抗糖尿病药物的潜力,为新药物开发提供了参考依据。

