血清CAR LMR T淋巴细胞亚群与多发性骨髓瘤患者预后的相关性分析
达海丽, 张旭光, 田卫伟, 解菊芬
(1.山西省汾阳医院, 山西 汾阳 032200 2.山西医科大学第三医院血液科, 山西 太原 030000)
多发性骨髓瘤(MM)是一种恶性肿瘤,起源于骨髓中的浆细胞,它被称为“多发性”是因为它可以在骨髓中同时形成多个骨髓瘤灶[1]。MM的确切原因尚不完全清楚,有一些与其发生相关的风险因素被认为与病因有关,包括年龄、遗传、免疫系统异常等。MM的发生情况相对较罕见,但在老年人中较多[2]。根据统计数据,在全球范围内,每年约有13万人被诊断出患有MM,尽管不是常见的癌症类型,但MM仍然是一种严重且难以治愈的疾病,需要及时诊断和治疗[3]。MM在进展期时,肿瘤细胞可以侵犯脊髓和周围神经,导致压迫性症状,如神经根痛、瘫痪和感觉异常,另外,MM可导致骨骼病变,引起疼痛、骨折和骨质疏松等问题,严重影响患者的生活质量,因此,对其预后情况进行评估十分重要。C反应蛋白与白蛋白比值(CAR)常用于评估炎症状态和疾病活动性,尤其在肿瘤领域中被广泛研究,较高的CAR值通常与炎症反应、恶性肿瘤的进展和预后较差相关。淋巴细胞/单核细胞比值(LMR)通常可反映机体免疫状态和炎症状况,也可作为一种炎症指标和预后评估指标,较高的LMR值通常与较好的预后关联,而较低的LMR值则可能与免疫功能抑制、炎症反应或预后差有关[4]。T淋巴细胞亚群是外周血液中T淋巴细胞的不同亚群,常见的T淋巴细胞亚群包括CD4+和CD8+细胞,这些亚群在免疫应答中起着重要的作用。例如,CD4+细胞可以协调和调节免疫反应,而CD8+细胞则起着杀伤病原体和感染细胞的作用,T淋巴细胞亚群的变化可以反映机体的免疫状态和炎症程度[5]。基于此,本研究通过分析上述指标与MM患者预后的关系,旨在为提高对其预后预测价值提供依据。
1 资料与方法
1.1临床资料:选取2020年1月至2022年1月诊治的105例MM患者作为研究对象,设立为观察组,同期选取75例健康体检者设立为对照组,并根据MM患者治疗后随访2年是否出现复发或死亡分为预后不良组(n=34)和预后良好组(n=71)。诊断标准:符合“中国多发性骨髓瘤诊治指南(2020年修订)”中关于MM的诊断标准[6],经病理检查确诊。纳入标准:①经临床确诊为MM,初次患病;②入组前未接受相关治疗;③预计生存期6个月;④认知功能正常。排除标准:①患有其他恶性肿瘤;②患有精神障碍类疾病;③患有自身免疫性疾病。观察组中,男性53例、女性52例,年龄50~64岁,平均值(57.23±2.74)岁;ISS分期:Ⅰ期27例、Ⅱ期46例、Ⅲ期32例。对照组中,男性38例、女性37例,年龄51~65岁,平均值(57.41±2.81)岁;两组一般资料比较,差异无统计学意义(P>0.05)。
1.2检测方法:采集所有患者入院后清晨空腹静脉血4mL,通过3500r/min离心10min后,取上层血清低温保存待测。通过日本希森美康公司XE5000全自动血液分析仪检查、白蛋白、淋巴细胞、单核细胞,计算CAR、LMR值。采用美国BD Bioseiences流式细胞仪检测CD3+、CD8+、CD4+指标,计算CD4+/CD8+值。对所有患者进行2年随访,依据是否出现复发或死亡分为预后不良组与预后良好组。
2 结 果
2.1预后不良组与预后良好组的一般资料比较:预后不良组的年龄、性别、ISS分期与预后良好组比较,差异无统计学意义(P>0.05)。见表1。
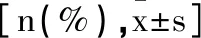
表1 两组一般资料比较
2.2血清CAR、LMR、T淋巴细胞亚群比较:观察组的CAR、CD8+高于对照组,而LMR、CD3+、CD4+、CD4+/CD8+低于对照组(P<0.05)。见表2。

表2 两组CAR LMR T淋巴细胞亚群比较
2.3预后不良组与预后良好组的CAR、LMR、T淋巴细胞亚群比较:预后不良组的CAR、CD8+高于预后良好组,而LMR、CD3+、CD4+、CD4+/CD8+低于预后良好组(P<0.05)。见表3。

表3 两组CAR LMR T淋巴细胞亚群比较
2.4二元Logistic回归分析:以预后为因变量(1=预后不良,2=预后良好),以“CAR、LMR、CD3+、CD4+、CD8+、CD4+/CD8+”为协变量,进行二元Logistic回归分析,结果显示,CAR、CD8+升高和LMR、CD3+、CD4+、CD4+/CD8+下降会对MM患者预后产生影响(P<0.05)。见表4。
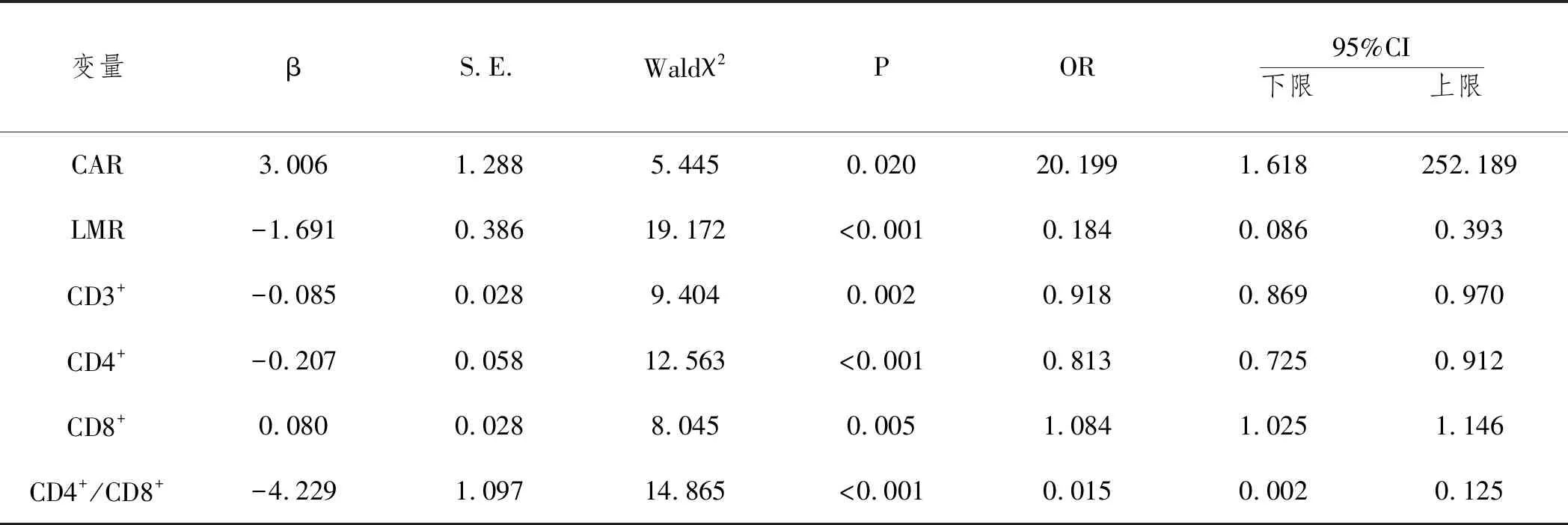
表4 MM患者预后的二元Logistic回归分析
2.5诊断效能分析:ROC曲线分析显示,CAR、LMR、CD3+、CD4+、CD8+、CD4+/CD8+、T淋巴细胞亚群综合参数预测MM患者预后的AUC值分别为(0.637、0.792、0.726、0.767、0.669、0.750、0.853,P<0.05)。见表5和图1。
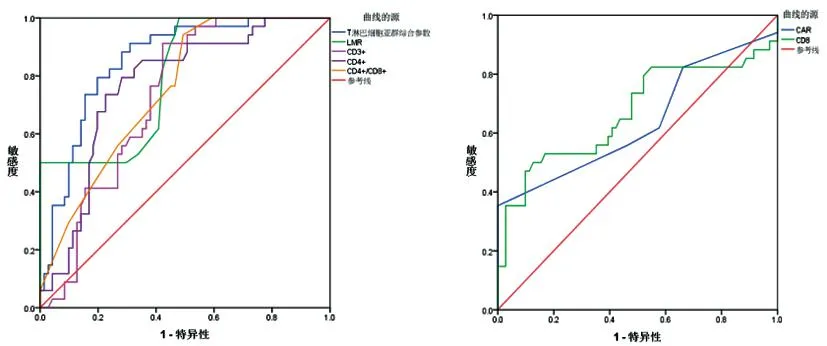
图1 CAR、LMR、T淋巴细胞亚群预测多发性骨髓瘤患者预后的ROC曲线分析

表5 CAR LMR T淋巴细胞亚群预测MM患者预后的效能分析
3 讨 论
MM是一种不可治愈的疾病,但可以通过治疗控制病情,并延长患者的生存时间[7]。MM预后评估可以帮助医生确定适合患者的最佳治疗方案,对于预后较好的患者,可能会选择更积极的治疗方法,以争取长期生存和疾病控制;而对于预后较差的患者,可能会采取更保守的治疗策略,以提高生活质量和缓解症状。根据预后评估结果,可以大致预测患者的生存期,这有助于患者和家属做出未来的打算和决策,并提前做好心理和生活上的准备[8]。
苏传勇等[9]在2022年的一项研究中发现,MM患者的T淋巴细胞亚群展现出异常,且与预后情况有关。安然等[10]研究结果指出,外周血淋巴细胞亚群可以反映MM患者的免疫水平,且对其预后情况具有较好的诊断价值。上述学者研究对本研究具有一定的指导价值。本研究结果显示,观察组的CAR、CD8+较对照组高,LMR、CD3+、CD4+、CD4+/CD8+较对照组低,这可能是因为:MM患者存在异常增殖的浆细胞,它们产生大量的免疫球蛋白,导致血液中的白蛋白浓度降低。同时,炎症刺激和破坏也会导致C-反应蛋白的升高,因此,CAR值相较于健康人群更高。MM会导致免疫功能受损,在MM患者中,T淋巴细胞亚群的表达情况可能发生改变,这包括了CD8+细胞的数量增加或者功能异常,这些改变可能与MM细胞产生的抑制性因子、免疫耐受机制等多种因素有关。因此,CD8+细胞指标相较于健康人群可能升高。MM患者的免疫系统功能受到抑制,这种抑制可能涉及到多个方面,包括浆细胞的异常增殖和免疫调节细胞功能的改变等,由于免疫系统受损,淋巴细胞的数量可能减少,导致LMR降低。MM是由浆细胞恶性增殖引起的,这些恶性浆细胞会占据骨髓的空间,导致其他免疫细胞如淋巴细胞的数量减少,故CD3+、CD4+细胞在MM患者中可能降低。MM患者的免疫系统可能发生失衡,包括CD4+和CD8+细胞亚群的比例改变。因在MM中CD4+细胞的数量可能相对较低,导致CD4+/CD8+比值的降低。而后,本研究对患者进行了2年的预后随访,结果显示,预后不良组CAR、CD8+较预后良好组高,LMR、CD3+、CD4+、CD4+/CD8+较预后良好组低,究其原因在于:预后不良的MM患者常常伴随炎症反应的增加,而CAR是一种炎症标志物,持续的炎症反应可导致C-反应蛋白水平升高,从而导致CAR增加。预后不良的MM患者可能存在更强的免疫活性,CD8+细胞是辅助T细胞亚群之一,具有细胞毒性作用。在MM中,CD8+细胞可能被激活并增加其数量,以对抗恶性浆细胞的增殖。预后不良的MM患者免疫系统可能受到抑制,包括细胞免疫和体液免疫的异常。CD3+和CD4+是重要的免疫细胞,它们参与抗肿瘤免疫应答,调节免疫活性,预后不良的MM患者可能存在淋巴细胞数量减少的情况,导致LMR、CD3+、CD4+细胞水平较低。预后不良的MM患者免疫功能可能发生失衡,包括淋巴细胞亚群的异常变化。CD4+和CD8+细胞是T细胞的两个重要亚群,它们的比值(CD4+/CD8+)可用于评估免疫状态,预后不良的MM患者可能存在CD4+细胞减少或CD8+细胞增加,导致CD4+/CD8+比值下降。除此之外,本研究将上述6个指标纳入到回归分析中,发现均与患者预后有关,且均对诊断MM患者预后具有较好的诊断效能,探究其机制在于:不同的指标可以从不同角度反映患者的免疫状态和肿瘤发展情况,比如,LMR是衡量炎症和抗肿瘤免疫应答的重要指标,CD3+、CD4+、CD8+细胞数量可以反映T细胞的免疫活性,CD4+/CD8+比值可以评估免疫失衡情况。联合应用这些指标可以更全面地了解患者的免疫状态,并更准确地判断其预后情况。
综上所述,MM患者的血清CAR、LMR、T淋巴细胞亚群呈现异常表达,对上述指标进行检查能够为MM患者预后评估提供科学依据。但本研究还存在着不足的地方,例如未纳入更多相关指标进行分析,且未将所有指标进行联合诊断,在今后将会针对此改进。

