两种小鼠尾静脉采血法进行血糖检测的比较分析
金会艳,李浩瑜,李 响,刘丁瑜,李 凡
(1.昆明医科大学基础医学院实验教学中心机能学实验室,云南 昆明 650500;2.昆明医科大学第一临床学院,云南 昆明 650500;3.昆明医科大学基础医学,云南 昆明 650500;4.云南大学医学院,云南 昆明 650500)
C57BL/6J 小鼠的生理机能较哺乳类动物更接近人类[1],并且在高脂饮食诱导下,C57BL/6J 小鼠患肥胖症[2]、胰岛素抵抗[3]和2 型糖尿病的易感性较其他品系的小鼠高[4-6],因此C57BL/6J 小鼠是糖尿病、动脉粥样硬化及代谢性相关疾病研究的常用实验动物。血糖检测则是诊断糖尿病和监测其治疗效果的有效、快捷方法。在检测小鼠血糖的过程中,尤其是连续多次采血时,科学有效的采血方式是获得准确血糖值的关键环节。此外,成功的血液采集对于实验动物也非常重要[7]。现有小鼠采血方法有鼠尾采血、摘眼球采血、眼眶后静脉丛采血、心脏采血和断头采血等方法[8,9]。由于鼠尾血管丰富,因此从鼠尾静脉采集血液样本被广泛应用。但关于刺破尾静脉采血与剪尾采血两种方法检测的血糖值是否有差异的报道较少。因此,本研究通过比较刺破尾静脉采血法与剪尾采血法检测血糖值来评价两种采血方法的差异及其所测血糖值的相关性,从而探讨一种稳定、有效,且更符合实验动物伦理学的科学检测小鼠末梢静脉全血血糖值的实验方法,现报道如下。
1 材料与方法
1.1 实验动物 SPF 级C57BL/6J 小鼠12 只,10~11周龄,雄性小鼠,体重(23.08±0.34)g,购自云南大学实验动物中心,实验动物生产许可证:SCXK(滇)K2021-0001。饲养于云南大学实验动物中心SPF 级动物饲养室,实验动物使用许可证:SYXK(滇)K2021-0002。动物房室温20 ℃~25 ℃,湿度30%~60%,12 h 明暗交替。小鼠自由进食、进水。
1.2 主要试剂与仪器 小鼠静脉可视尾注固定器YAN-Q9(上海玉研科学仪器有限公司),血糖仪、配套试纸条及一次性采血针(ACCU-CHEK Performa,德国罗氏公司),眼科剪,75%酒精,棉签。
1.3 方法
1.3.1 实验动物分组 12 只小鼠自由进食进水,于上午8∶00 分别采取尾静脉刺破采血和剪尾采血两种方法检测其血糖值,两种采血方法间隔5 min。采血前小鼠置于小鼠固定器中,尾巴自固定器内底部顺出,以便采血(图1)。所有实验操作均通过云南大学实验动物中心批准,并按照实验动物使用3R[10]和福利原则[11]进行操作。

图1 小鼠固定图
1.3.2 刺破尾静脉采血法检测小鼠血糖 小鼠置于固定器中,调整适当位置,使小鼠尾部置于红外灯上,并让小鼠静置1 min,使小鼠处于平静状态。在红外灯的照射下,小鼠尾静脉清晰可见,在小鼠尾部后1/3 处,用棉签压迫尾静脉近心端,75%的酒精消毒后,用一次性采血针刺破血管,待血液自然流出(图2)。用血糖仪吸取血液至血糖试纸感应区,读取血糖值,并用棉签压迫采血点止血。

图2 刺破尾静脉采血法
1.3.3 剪尾采血检测小鼠血糖 完成刺破尾静脉采血检测血糖后,小鼠从固定器中取出,自由活动5 min。小鼠再次固定于固定器中,并让小鼠静置1 min,使小鼠处于平静状态。小鼠尾部置于红外灯上保温,75%的酒精消毒后,在小鼠尾尖部,用眼科剪剪断尾部使血液自然流出(图3)。用血糖仪吸取血液至血糖试纸感应区,读取血糖值,并用棉签压迫止血。1.4 统计学方法 采用IBM SPSS 25.0 统计软件进行分析,计量资料用()表示,采用配对t检验。采用线性相关和回归分析两种采血方式检测血糖值的相关性。P<0.05 表示差异有统计学意义。
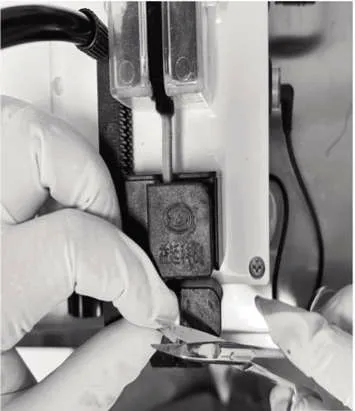
图3 剪尾采血法
2 结果
2.1 刺破尾静脉采血法与剪尾采血法检测小鼠血糖值比较 刺破尾静脉采血法检测血糖值为(7.58±0.92)mmol/L,与剪尾采血法的(7.61±1.02)mmol/L 比较,差异无统计学意义(t=-0.203,P=0.843)。
2.2 刺破尾静脉采血法与剪尾采血法检测小鼠血糖值的相关性分析 由绘制的散点图可见,刺破尾静脉采血法检测血糖与剪尾采血法检测血糖值有正线性趋势,可进行相关性分析。Pearson 相关性分析显示,10~11 周龄的雄性C57BL/6J 小鼠刺破尾静脉采血法检测血糖值与剪尾采血检测血糖值有相关性(t=0.827,P=0.001)。进一步采用回归分析两种采血方法检测血糖值的关系得到,回归分析方程式为:y(剪尾采血法)=1.898+0.746x(刺破尾静脉采血法),见图4。

图4 刺破尾静脉采血法与剪尾采血法检测血糖值的散点图
3 讨论
C57BL/6J 小鼠体型小、繁殖快、成本低、易控制,对饮食导致的血糖升高易感,因此常用于血糖代谢异常等相关疾病的研究中。成功采集血液样本是准确检测血糖值的关键步骤[12]。目前,小鼠采血的方式较多,不同的采血方法对小鼠的损伤程度、采血间隔及采血量要求等各不相同,因此选择合适的采血方式,从而获得高质量的血样,是得到科学实验数据、实验成功的基础,尤其是需要连续监测血糖的情况下,如口服糖耐量试验、胰岛素耐量试验等。连续采血监测血糖值,为临床上糖尿病及其并发症等相关研究提供了大量血糖数据[13]。
在正常生理体位下,小鼠尾部有4 根明显可见的血管,即背腹面各有1 根动脉,两侧各有1 根静脉[14]。对于连续多次少量的采集血样,尾静脉采血是最佳取血方式,但在采血过程中,刺破尾静脉与剪断尾尖获取血样检测的血糖值是否有差异的研究较少。本研究在鼠尾采血的方法中再细化取血样操作方法,以刺破尾静脉与剪断尾尖获取血样来检测血糖值,从而评价两种取血方法的异同及适用性,结果显示刺破尾静脉采血法与剪尾采血法取样后检测的血糖值比较,差异无统计学意义(P>0.05),且刺破尾静脉采血法与剪尾采血法取样后检测的血糖值呈线性正相关,提示在检测小鼠微量血糖时,采用刺破尾静脉采血法和剪断尾尖采血法均可得到相同的结果。一方面,由于采血前小鼠固定于小鼠静脉可视尾注固定器中,小鼠处于相对平静状态,检测的血糖值相对稳定。已有研究显示[15,16],应激会引起交感神经兴奋,肾上腺素和去甲肾上腺素分泌增加,从而使血糖升高。另一方面,小鼠固定于小鼠静脉可视尾注固定器中,并使小鼠尾部置于红外灯上保温,保证采血全过程尾静脉充分扩张,刺破静脉或剪断尾尖时,血液自然流出,避免挤压血管,影响血液生物学参数,从而影响血糖水平[17]。虽然两种采血方式检测出来的血糖值无差异,但在具体实验中,如口服糖耐量实验中,在2 h 内完成多次采血,选用刺破尾静脉采血是最佳方法,主要是因刺破血管损伤小,易止血,可反复多次操作[18]。而剪尾采血法每次取血时需要剪断尾尖,如此反复,小鼠损伤大,不能更好地满足实验动物福利原则[19];且越靠近鼠尾根部剪尾,小鼠疼痛感增加,应激反应增强,从而导致血糖出现波动,实验数据较不准确[20]。
综上所述,刺破尾静脉采血法与剪尾采血法测出来的血糖值无差异,但考虑实验的可操作性、实验结果的稳定性及实验动物福利原则,刺破尾静脉采血法优于剪尾采血法,值得临床应用。

