Paxlovid对肺移植患者他克莫司血药浓度影响的研究
任 涵,梁 艳,张莎莎,朱笳悦,张文想,王 炎,牛玉坤,彭紫琪,马明玥,郭冬杰
0 引言
奈玛特韦片/利托那韦片组合包装(Paxlovid)作为治疗新型冠状病毒感染的口服小分子药物,目前在成人伴有进展危重症高风险因素的轻中度患者中得到了广泛应用。其中,利托那韦片是细胞色素P450(CYP)3A抑制剂,同时与很多药物发生相互作用[1-3]。他克莫司(Tacrolimus,TAC)是器官移植患者免疫治疗方案常用的钙调磷酸酶抑制剂,治疗窗窄,个体差异大[4-6]。肺移植患者使用Paxlovid时,利托那韦片会通过抑制CYP3A4的代谢从而升高TAC的血药浓度,增加药物在体内的暴露,因此,关于肺移植患者使用Paxlovid的安全问题应得到关注。由于Paxlovid与部分药物存在相互作用,推荐在使用Paxlovid期间停止使用TAC[7],防止TAC血药浓度过高增加不良反应的发生率。但是,目前关于在使用Paxlovid期间TAC血药浓度变化的研究较少。本文通过5例病例分析了Paxlovid对肺移植患者TAC血药浓度的影响。
1 对象和方法
1.1 研究对象 回顾性分析2022年11月至2023年1月中日友好医院肺移植术后新型冠状病毒感染患者的资料,纳入标准:①肺移植术后患者;②使用Paxlovid前TAC达到稳态血药浓度;③Paxlovid使用疗程达5 d;④在Paxlovid使用前、使用期间及停用后均测定TAC血药浓度。排除标准:①严重肝肾功能不全;②在服用Paxlovid及TAC期间接受过体外膜肺氧合(Extracorporeal membrane oxygenation,ECMO)、连续肾脏替代疗法(Continuous renal replacement therapy,CRRT)及透析等影响TAC血药浓度的治疗;③使用Paxlovid及TAC期间服用过其他会影响TAC血药浓度的药物,如唑类药物等。
1.2 TAC血药浓度的测定 TAC经口服或鼻饲给药,每日剂量分别于早晚2次服用,给药时间间隔12 h。在服用Paxlovid前12 h以及Paxlovid使用期间停止使用TAC,每次均于清晨服药前30 min静脉采血2 ml,置于乙二胺四乙酸(EDTA)抗凝管中。本中心使用美国雅培公司的Architect i1000SR分析仪,采用化学发光微粒子免疫法测定TAC全血血药浓度,TAC血药浓度的测定按照他克莫司检测试剂盒(美国雅培公司)的说明书进行预处理。
1.3 统计分析 记录患者的性别、年龄、体重、体重指数(BMI)、新型冠状病毒核酸检测转阴时间、TAC血药浓度(包括Paxlovid给药之前、给药期间、重新启用TAC之前以及启用后的TAC血药浓度,C)、TAC的给药剂量(D)、标准血药浓度(TAC血药浓度/对应给药剂量,C/D)、肌酐、肾小球滤过率(eGFR)、总胆红素、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)。本文以描述性分析作为主要的数据统计方法。
2 结果
2.1 临床资料 本研究共纳入了5例符合条件的患者,均为男性,平均年龄为53.2岁(35~67岁),平均体重为69.1 kg(59.0~83.6 kg),BMI为21.5 kg/m2(19.5~24.3 kg/m2)。整个监测过程中患者肝肾功能的变化波动在正常范围内,见表1。所有患者均服用300 mg的奈玛特韦片和150 mg的利托那韦片,并且在服用Paxlovid期间停止使用TAC。以患者服用Paxlovid前的TAC剂量作为基线剂量,稳态血药浓度作为基线浓度,之后分别在使用Paxlovid期间以及使用Paxlovid后测定TAC血药浓度,记录启用TAC的时间和剂量,并计算TAC的标准血药浓度(C/D),见表2。开始服用Paxlovid作为第1天(D1)。
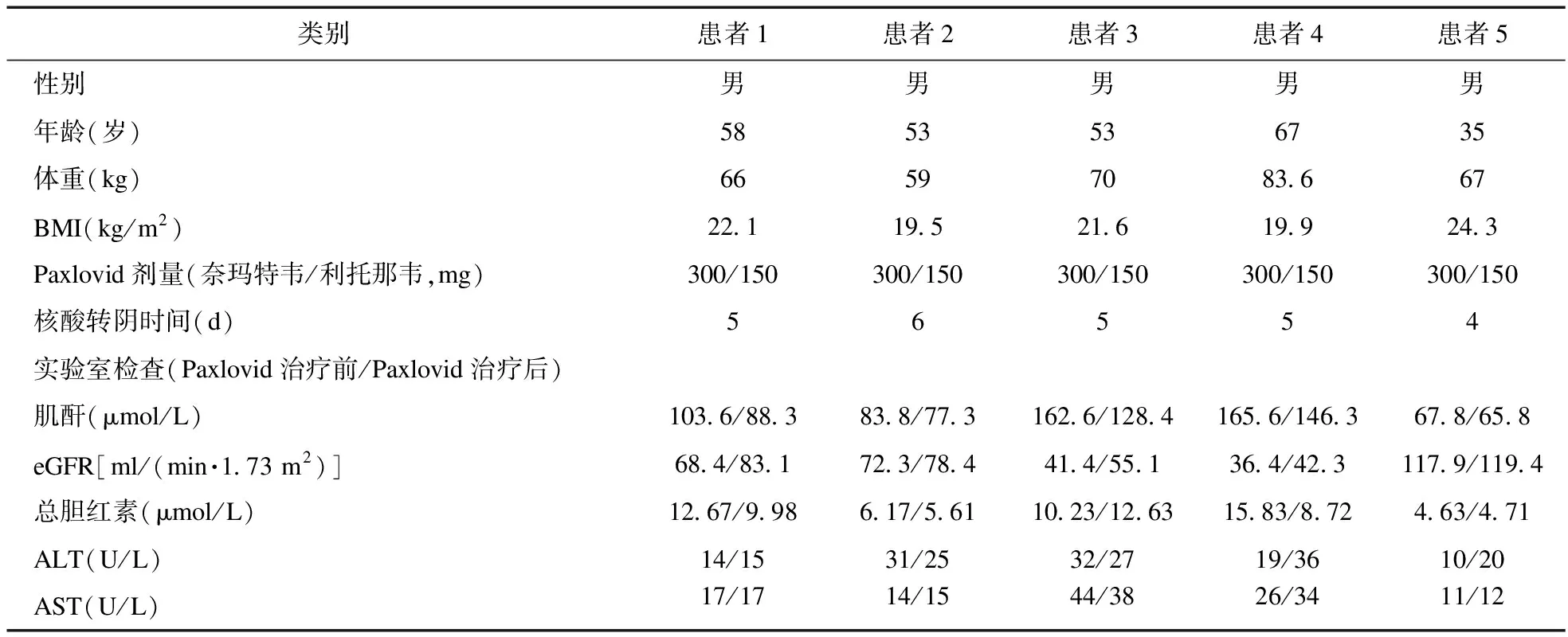
表1 5例肺移植患者的基本资料
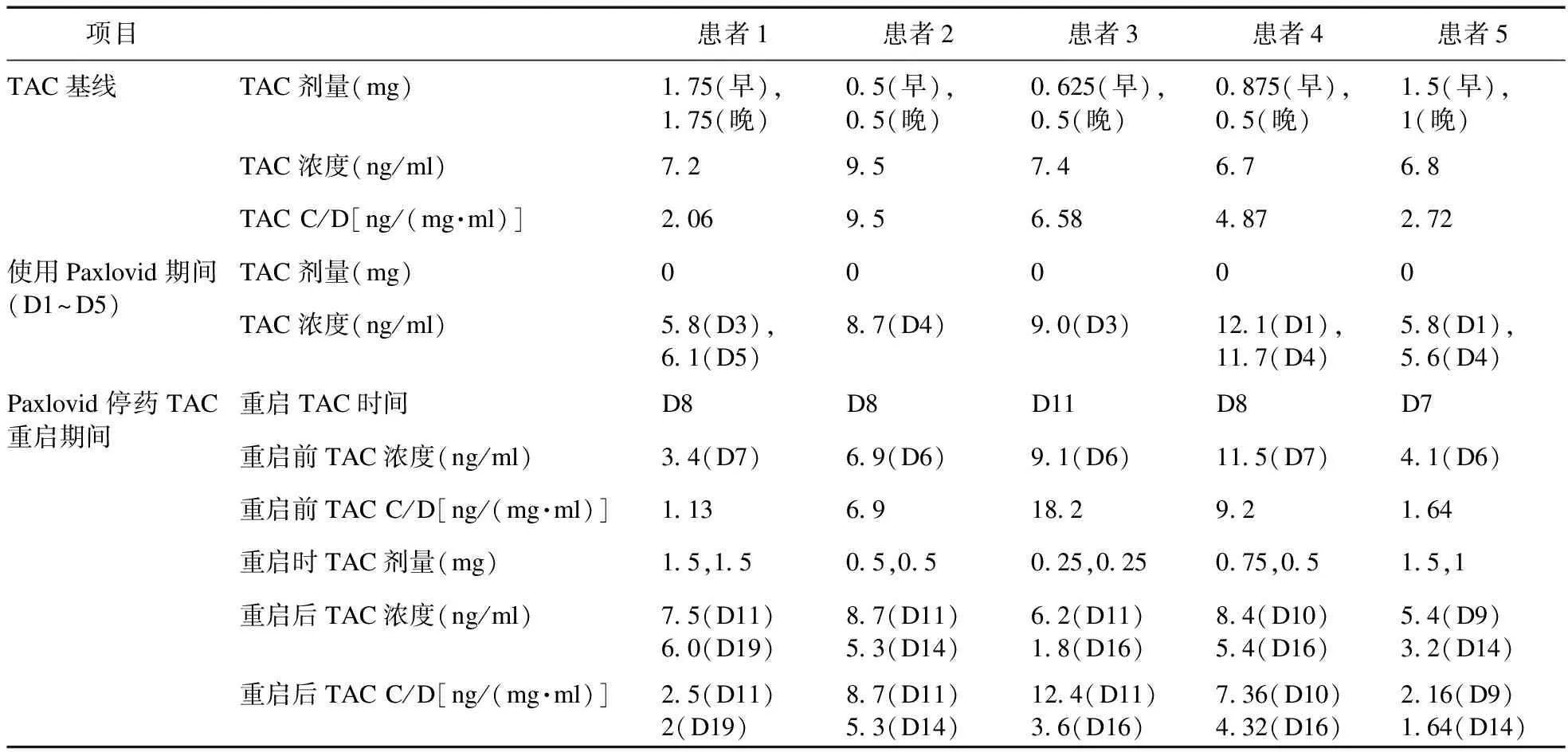
表2 5例患者使用Paxlovid前后TAC谷浓度和剂量
2.2 使用Paxlovid期间TAC浓度变化情况 与基线水平相比,在Paxlovid治疗期间(D1~D5),患者1、2、5的TAC血药浓度分别下降19.4%、8.4%、14.7%,而患者3和患者4在Paxlovid治疗期间,TAC血药浓度不仅没有降低,反而分别升高了21.6%、80.6%;患者3在第3天(D3)TAC血药浓度由基线水平的7.4 ng/ml升至9.0 ng/ml;患者4在开始使用Paxlovid第1天(D1)时,TAC血药浓度即由6.7 ng/ml升至12.1ng/ml,见表3、图1。
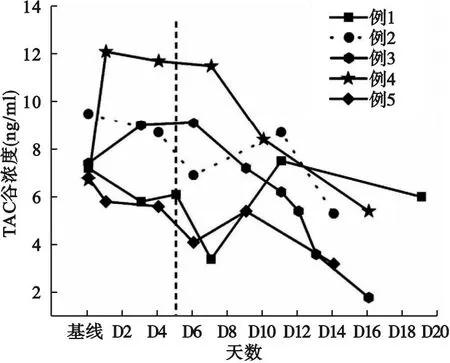
图1 5例患者在Paxlovid使用前后他克莫司血药浓度的变化
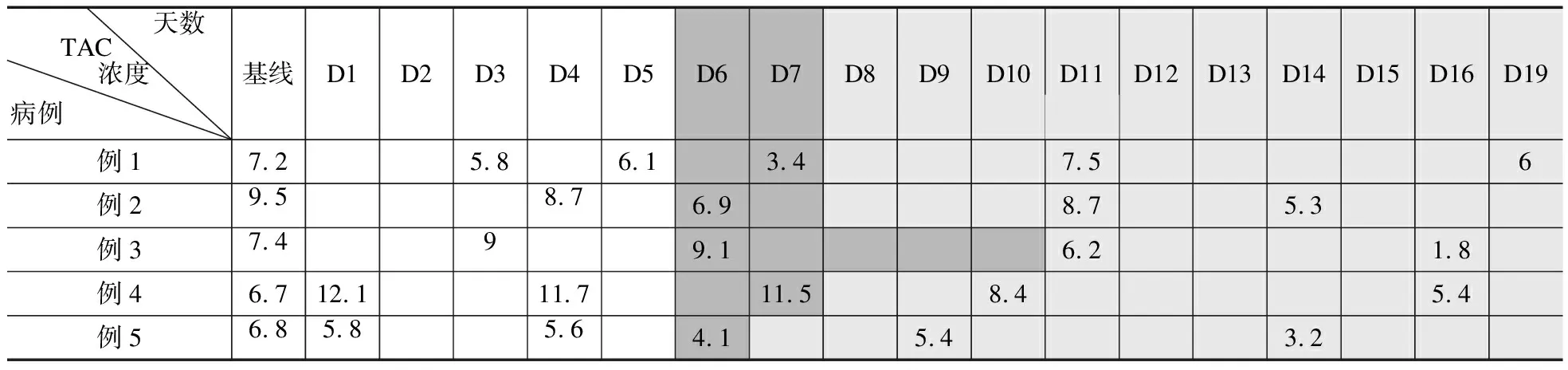
表3 5例患者使用Paxlovid前后TAC的浓度变化
2.3 Paxlovid停药之后TAC浓度变化情况 与Paxlovid治疗期间最后一次测得的TAC浓度相比,在完成Paxlovid治疗后与重新启用TAC之前(患者1、2、4:D6~D7;患者3:D6~D10;患者5:D6),除患者3升高0.1 ng/ml外,其余4例患者TAC浓度均有所下降,平均约23.4%(1.7%~44.3%)。停用Paxlovid一段时间后,5例患者开始以不同剂量重新启用TAC。患者1、患者2和患者5 的TAC谷浓度和相应的C/D出现了先上升后下降的趋势:服用TAC 3~5 d(D9~D11)后的血药浓度比启用TAC之前(D6~D7)平均增长了59.5%(26.1%~120.6%);之后以相同剂量继续服用,继续用药之后的TAC血药浓度明显下降,平均约下降33.3%(20.0%~40.7%)。而患者3和患者4在Paxlovid停药之后(D5之后),TAC谷浓度及相应的C/D则基本一直处于平稳下降的状态。见表3、图1。
2.4 重新启用TAC的时机以及起始剂量 4例患者均于Paxlovid停药后2~3 d(D7~D8)开始恢复TAC的使用,仅患者3因为感染原因在停用Paxlovid 后第11天重启TAC。
2.4.1 重新启用TAC时的血药浓度 4例患者分别在TAC血药浓度为基线水平的47.2%、72.6%、83.8%、60.3%时开始恢复使用TAC,而患者4在TAC浓度为基线水平的171.2%时开始启用TAC。
2.4.2 重新启用TAC的剂量 患者2和患者5以基线剂量重新启用TAC,患者1、患者3和患者4分别以85.7%、44.4%、90.9%的基线剂量开始恢复使用。
3 讨论
本研究中,5例肺移植患者都有肺部基础疾病,有发展成为重症或危重症COVID-19的风险。有研究表明,感染COVID-19的实体器官移植患者接受Paxlovid的治疗是有益的[8]。根据COVID-19的诊断标准和抗病毒治疗的标准方案[9],给予该5例患者Paxlovid口服,所有患者均完成了5 d的治疗。
Paxlovid是由奈玛特韦片和利托那韦片共同组成的复合包装。奈玛特韦作为一种蛋白酶抑制剂,经过CYP3A4酶代谢,能够抑制新冠病毒3CL蛋白酶的活性,从而阻断病毒的复制[10]。而利托那韦是CYP3A酶的抑制剂,两者合用能够减缓奈玛特韦的代谢,增加奈玛特韦的生物利用度。正因为利托那韦对CYP3A的抑制作用,即使是短期治疗,也会和很多药物发生严重的药物相互作用[11]。肺移植患者需要长期服用TAC,其主要通过CYP3A4和CYP3A5代谢,治疗窗窄,个体差异大,剂量不足可导致器官的急性排斥反应,剂量过大则会导致不良反应发生率增加。Paxlovid会通过抑制CYP3A4的代谢,从而升高TAC的血药浓度,甚至发生急性肾损伤等严重不良反应[12]。因此,Hiremath等[13]建议在Paxlovid治疗期间停止使用TAC,并在治疗完成2~3 d后再重新开始免疫抑制治疗。本研究中有4例患者均在停止使用Paxlovid 2~3 d后再次启用TAC。
本研究发现,在Paxlovid治疗期间,5例患者中有3例TAC谷浓度基本维持在正常浓度范围,而另外2例则出现了TAC谷浓度明显上升,患者4甚至上升了将近一倍,Dewey等[14]也曾报道过类似的情况。这是因为Paxlovid和TAC之间存在很强的药物相互作用,即使已经在Paxlovid治疗期间停用TAC,Paxlovid依然通过抑制CYP3A4酶的作用阻止了体内TAC的代谢[11]。
患者在重新启用TAC前(D6~D7)以及重新启用后(D9~D11)检测TAC谷浓度。其中3例患者在重新启用TAC后谷浓度上升,但在相同的剂量下,之后TAC谷浓度又逐渐下降。结果表明,虽然已经停止使用Paxlovid,但其对CYP3A4酶的抑制作用并没有消失,而是一直持续到Paxlovid停药后第6天(D6~D11),停药6 d之后酶的活性才基本恢复。因此,在相同的TAC给药剂量下,TAC谷浓度会出现先上升后下降的变化,C/D也显示出了同样的趋势。其余2例患者TAC谷浓度在D6~D7(Paxlovid停药后1~2 d)时逐渐下降,此时CYP3A4酶活性应已逐渐恢复。研究表明,在利托那韦的作用下,CYP3A4酶活性在停用Paxlovid后2~5 d可恢复80%[15],本研究与上述结论基本一致。CYP3A4酶活性的恢复存在个体差异性[8],但由于该5例患者未做基因检测,本研究未能进一步评估代谢酶的基因多态性。关于TAC浓度个体差异化的原因还需要更大样本、更深入的前瞻性的研究。5例患者不同的TAC谷浓度变化趋势表明,当TAC与Paxlovid联合使用时,务必进行治疗药物监测,实现个体化给药[16]。
本研究中,5例患者均未使用对TAC浓度造成较大影响的药物,如CYP3A强抑制剂唑类药物、抗逆转录病毒药物,CYP3A强诱导剂卡马西平、利福平等[17]。糖皮质激素和质子泵抑制剂(PPI)类药物是CYP3A的弱效/中效的诱导剂或抑制剂。移植后的患者常使用TAC联合霉酚酸、糖皮质激素作为三联抗排异方案。霉酚酸类药物对TAC的浓度几乎没有影响[18-19]。研究表明,高剂量的糖皮质激素对TAC没有明显影响,而低剂量的糖皮质激素(<30 mg/d)可能会使TAC浓度下降[20],但相关研究较少,证据不足。该5例患者在肺移植术后一直使用TAC+吗替麦考酚酯(500~750 mg/d)+醋酸泼尼松片(5~10 mg/d)作为三联抗排异方案,并且此次入院前TAC已达稳态浓度,因此暂不考虑糖皮质激素对TAC的影响。危重症患者常使用PPI预防应激性溃疡。PPI类药物由CYP2C19、CYP3A4、CYP3A5代谢,可通过CYP3A4竞争性抑制TAC的代谢,使TAC浓度升高,尤其是奥美拉唑[21],而泮托拉唑与雷贝拉唑对TAC的影响较小[22-24]。本研究中,患者1、患者3和患者5使用了雷贝拉唑,患者2未使用PPI类药物,患者4使用了泮托拉唑,上述药物对TAC浓度的影响均较小。
关于重新启用TAC的时间与剂量,目前仍未达成共识。有研究者建议应以25%~75%的基线剂量重新开始[14,25],Hiremath等[13]不建议在Paxlovid停药后2~3 d内开始使用TAC。本研究中,有4例患者在Paxlovid停药后2~3 d内开始重新使用TAC,起始剂量超过75%的基线剂量,且有2例直接以基线剂量开始启用,但TAC谷浓度均未超过正常范围上限。患者3因感染严重延迟了TAC的启用时间并减少了给药剂量,降低TAC的谷浓度以免加重感染。另外,患者4是一名出院带药患者,D7(Paxlovid停药后第2天)测得TAC谷浓度为11.5 ng/ml,可能由于沟通不充分而未及时更改TAC剂量,仍按照出院医嘱剂量继续服用。虽然该患者在超过其目标谷浓度范围上限时启用TAC,但是之后检测的TAC谷浓度是逐渐下降的,并且患者的肌酐并没有受到较大影响,也没有因TAC浓度过高而引起急性肾损伤等不良反应[12]。5例患者在治疗期间肝肾功能均在正常范围内,没有出现肝肾损害。综上,对于肺移植患者,可以通过监测TAC谷浓度,调整TAC剂量(给予高于75%基线剂量或基线剂量)。
4 总结
本研究通过回顾性分析5例肺移植术后COVID-19患者使用Paxlovid后TAC的血药浓度变化,发现Paxlovid会对TAC血药浓度产生影响,此影响甚至持续至停药后6 d内。另外,对于这类患者,在使用Paxlovid期间以及之后,需考虑不同患者CYP3A4酶活性恢复的差异性,严密监测TAC血药浓度,根据血药浓度实行个体化TAC给药方案,并且在TAC血药浓度监测的基础上,患者可以基线剂量重启TAC。但本研究是回顾性、个例的研究,样本量较少,缺乏普遍性,没有评估代谢酶的基因多态性,还有待进一步研究验证。

