APP/PS1 转基因小鼠脑组织环状RNA的差异表达谱及相关ceRNA构建
马琳秋,侯明亮,李金平,杨红岩,廖旗荣,李小雄,洪文娟,周华东,2
(1.蚌埠医科大学第一附属医院 神经内科,安徽 蚌埠 233004;2.陆军特色医学中心 神经内科,重庆400020)
阿尔茨海默病(Alzheimer′s disease,AD)是老年人痴呆的最常见原因。它是一种中枢神经系统退行性疾病,主要病理特征为β-淀粉样蛋白(Aβ)沉积和高度磷酸化的tau蛋白形成的神经纤维缠结[1-2]。由于该疾病的复杂性,其病理生理机制尚不完全清楚。尽管全球AD病人的数量在不断增加,但目前尚无针对 AD 的有效治疗方法。近年来人们发现非编码 RNA可以通过多种不同机制控制基因表达程序来调节细胞功能。其中环状RNA (circRNA)是一类具有完整闭环结构的非编码RNA,在哺乳动物的神经元中非常丰富[3]。研究[4-5]表明,一些circRNA在神经炎症、氧化应激和自噬以及Aβ的产生和降解中发挥重要的调节作用。因此,进一步研究circRNA在基因调控中的作用有利于增进对AD发病机制的研究,并通过寻找潜在的治疗靶点为AD诊断和治疗提供新策略。本研究使用APP/PS1转基因小鼠模型,采用基因芯片技术筛选出差异表达的circRNA,预测并构建circRNA-miRNA-mRNA调控网络,探讨差异表达circRNA在AD发病机制中的潜在作用。
1 材料与方法
1.1 实验动物
选取3只10月龄APP/PS1转基因雄性小鼠,作为AD组,同窝10月龄C57BL小鼠3只作为空白对照组。实验动物均购自南京君科生物工程有限公司,动物许可证号:SCXK(苏)2020-0009。通过颈椎脱位法分别处死2组小鼠,将获得的脑组织保存在液氮中备用。实验过程中遵循实验动物伦理规定。
1.2 仪器和试剂
NanoDrop ND-1000型分光光度仪购自美国NanoDrop公司,Agilent DNA微阵列扫描仪、Agilent Feature Extraction v11.0.1.1软件和GeiieSpring GX v12.1软件购自美国Agilent公司,9700型PCR仪购自美国 Applied Biosystems公司。Arraystar小鼠circRNA V4.0芯片、Arraystar表达谱芯片配套试剂盒及2×PCR master mix试剂盒购自美国Arraystar公司,Trizol试剂和SuperScriptTMⅢ RT master mix 试剂盒购自美国Invitrogen公司,RNeasy Mini Kit试剂盒购自美国Qiagen公司。
1.3 RNA 提取和芯片杂交
用RNA提取试剂盒Trizol从小鼠脑组织中提取总RNA。采用ND-1000紫外分光光度计测定 RNA的浓度并评估纯度。RNA完整性通过标准变性凝胶电泳进行评估。使用Arraystar小鼠circRNA V 4.0 芯片和Arraystar表达谱芯片配套试剂盒进行基因芯片杂交,并应用Agilent Feature Extraction软件获得芯片信号强度图和原始数据,对杂交图像进行差异数据分析。
1.4 实时荧光定量PCR反应(quantitative real-time PCR,qRT-PCR)
在差异表达的circRNA中随机选择 5个circRNA进行qRT-PCR验证。按照SuperscriptTMⅢ RT转录试剂盒说明书步骤,反转录为互补DNA (complementary DNA,cDNA)。反转录条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环。引物由上海数谱生物科技有限公司合成,各引物序列见表1。将所得 cDNA 按照2×PCR master mix试剂盒说明进行操作,反应条件为:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 60 s,40 个循环。以GAPDH作为内参,由反应曲线得出阈值循环参数,应用QuantStudioTM5 real-time PCR仪分析荧光阈值(cycle threshold,Ct)。采用 2-△△Ct法计算相对表达量。

表1 目的基因引物序列
1.5 基因本体(gene ontology,GO)功能分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
将差异表达的circRNA母源基因通过GO数据库(http://www.geneontology.org)进行 GO 功能富集分析,通过 KEGG 数据库(http://www.genome.jp/kegg)对差异表达的基因进行KEGG通路富集分析。
1.6 circRNA-miRNA-mRNA 网络的构建
差异表达的circRNA通过错误发现率(FDR)≤0.001及差异倍数筛选,利用TargetScan数据库和miRanda的miRNA靶标预测软件预测circRNA-miRNA和miRNA-mRNA之间的结合关系,应用Cytoscape3.4.0构建circRNA-miRNA-mRNA调控网络,对circRNA竞争性网络靶向mRNA进行GO和KEGG通路富集分析。
1.7 统计学方法
采用t检验。
2 结果
2.1 circRNA差异表达分析
AD组与对照组比较,通过circRNA芯片鉴定,定义差异倍数>1.5且P<0.05的circRNA具有差异表达,共筛选出52个差异有统计学意义的circRNA,其中28个上调,24个下调。根据差异表达的circRNA绘制热图(见图1)和火山图(见图2),差异表达前10位的circRNA基本信息见表2。


表2 差异表达前10位的circRNA的基本信息
2.2 差异表达circRNA的qRT-PCR验证结果
芯片结果存在假阳性,为保证研究可靠性,采用qRT-PCR验证基因芯片的结果。结果显示,选取的5个circRNA中,3个上调(mmu_circRNA_24012,mmu_circRNA_41461,mmu_circRNA_40341),2个下调(mmu_circRNA_29978,mmu_circRNA_35922)。除了mmu_circRNA_41461有上调趋势但差异无统计学意义,其余4个circRNA变化趋势与基因芯片结果一致,差异有统计学意义(P<0.05~P<0.01)(见表3)。
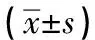
表3 2组小鼠脑组织目的基因的相对表达量
2.3 差异表达circRNA的GO功能富集分析
对差异表达circRNA的母源基因进行GO功能富集分析,发现上调的差异表达circRNA主要富集的生物过程为定位和神经系统发育,细胞组成为细胞投射和神经元投射,分子功能为蛋白质结合和 Rho GTPase蛋白结合;下调的差异表达circRNA主要富集的生物过程为细胞成分的组装和突触组织,细胞组成为质膜外侧的锚定成分和突触膜,分子功能为结合和蛋白质结合(见图3A、3B)。KEGG通路富集分析结果提示,上调的差异表达的circRNA的亲本基因主要富集于调控干细胞多能性的信号通路和Hippo信号通路等;下调的差异表达的circRNA的亲本基因主要富集于RNA运输,肌醇磷酸盐代谢和催产素信号通路等(见图4)。

2.4 竞争性内源RNA (competing endogenous RNA,ceRNA)网络构建及生物信息学分析
为了进一步阐明差异circRNA的生物学功能,使用miRanda和TargetScan数据库预测得到具有结合位点的circRNA-miRNA 和 miRNA-mRNA 关系对,构建circRNA-miRNA-mRNA 三元转录网(见图5)。对ceRNA网络mRNA进行GO功能富集及KEGG通路富集分析发现,GO富集的分子功能主要为蛋白质结合、催化活性、小分子结合;细胞成分主要为浆膜、浆膜约束的细胞投射、神经元投射;生物过程主要为对运输的正向调节、定位、对定位的调节。根据KEGG通路富集分析提示其主要富集于cAMP信号通路、Rap1信号传导途径、C型凝集素受体信号通路、HIF-1信号传导途径等信号通路(见图6、7)。
3 讨论
AD是一种与年龄相关的破坏性神经退行性疾病,主要症状包括记忆力减退和学习能力下降。AD的发生发展涉及多种因素,其病理机制尚不完全清楚。作为非编码RNA,circRNA虽然不能直接编码翻译蛋白质,但是能够充当“miRNA海绵”,参与转录后调控。circRNA通过与miRNA反应原件结合,降低 miRNA 与下游靶向 mRNA 的结合,从而减少miRNA介导的基因抑制表达,影响靶基因的表达,即ceRNA调控机制[6-7]。许多研究已经证明circRNA可以参与多种疾病的病理过程,例如,XU等[8]发现circCCAC1 通过靶向 YY1 的 miR-514a-5p 促进胆管癌肿瘤发生;张兵等[9]报道可通过干扰circPTPRA来上调miR-140-5p的表达而抑制类风湿关节炎滑膜成纤维细胞增殖和迁移。

circRNA是一类在神经系统中高度表达的非编码RNA,研究表明circRNA在神经元发育和衰老过程中是动态调节的,它们在突触水平上富集,并在突触可塑性中发挥重要作用,突触可塑性是学习和记忆的基础[10],可能参与了AD 和其他神经退行性疾病的发生发展。例如,散发型AD病人海马CA1区circRNA CDR1as/ciRS-7的表达被下调[11]。由于降低了ciRS-7“海绵”效应,miR-7活性增加,可以下调AD相关靶标,包括泛素蛋白连接酶UBE2A,这是AD中清除淀粉样肽所必需的蛋白。此外,在SH-SY5Y细胞中,最近发现ciRS-7以NF-κB依赖性方式促进APP和BACE1的降解[12]。WU等[13]报道circ-LPAR1在AD病人中高表达,通过靶向CHP-212和IMR-32细胞中的miR-212-3p,提高Aβ刺激的神经元凋亡、炎症和氧化应激。CHEN等[14]报道circ-NF1-419通过结合AD样小鼠的Adaptor protein 2b1和Dynamin-1来调节老年痴呆。LI等[15]报道circ-AXL可促进AD细胞模型神经元损伤和炎症反应,通过靶向miR-328介导BACE1加速AD的进展。

为了探讨circRNA在AD中的潜在作用,本研究利用circRNA的基因芯片分析AD小鼠模型存在的差异表达circRNA。结果表明,与对照组相比,AD小鼠模型脑组织中共筛查出52个差异表达的circRNA,其中表达上调有28个,表达下调有24个。我们对差异表达circRNA的母源基因进行了GO和KEGG分析。GO功能富集分析发现上调的差异表达circRNA主要富集的生物过程为定位和神经系统发育,细胞组成为细胞投射和神经元投射,分子功能为蛋白质结合和 Rho GTPase蛋白结合;下调的差异表达circRNA主要富集的生物过程为细胞成分的组装和突触组织;细胞组成为质膜外侧的锚定成分和突出膜;分子功能为结合和蛋白质结合。在KEGG分析中发现差异表达的circRNA的亲本基因主要富集于调控干细胞多能性的信号通路、Hippo信号通路、RNA运输磷脂酰肌醇信号传导通路等。Hippo信号通路在细胞功能中发挥着重要作用。Hippo信号传导的激活诱导细胞死亡,而Hippo信号传导的失活则引发细胞增殖[16]。最近的研究[17]表明,Hippo途径在AD的发病机制中起着重要作用,Hippo信号的过度激活可以导致Aβ42毒性增强,并影响Aβ42介导的神经退行性,而下调Hippo信号通路可以挽救Aβ42介导的神经退行性。提示差异circRNA可能参与AD的多个调控机制。
目前,circRNA-miRNA-mRNA竞争系统已被发现是AD中一个重要的表观遗传调控环[18]。为此,本研究通过miRanda等数据库预测与差异circRNA存在结合位点的miRNA和miRNA-mRNA关系对构建ceRNA调控网络。本研究中预测的mmu_circRNA_ 35922是通过靶向 miR-346-3p调节钙/钙调蛋白依赖性蛋白激酶Ⅱ a(CaMKⅡa)。CaMKⅡa是一种多功能蛋白激酶,是钙信号传导的关键参与者,在记忆处理,学习和神经可塑性中起着至关重要的作用[19]。CaMKⅡa失调也是AD发展的关键和早期信号。淀粉样蛋白前体蛋白和tau蛋白可被过度活跃的CaMKⅡa磷酸化,导致Aβ和神经原纤维缠结形成[20-21]。这些结果表明差异表达的circRNA相关ceRNA网络可以为AD提供新的见解,从而为该疾病提出新的治疗方法。
综上所述,本研究筛选出AD小鼠脑组织中多种差异表达的circRNA,如表达上调的 mmu_circRNA_24012、 mmu_circRNA_40341,表达下调的 mmu_circRNA_29978、mmu_circRNA_35922,这些差异基因可能通过circRNA-miRNA-mRNA调节网络参与AD发生的分子调控。本研究有望为 AD的诊疗及发生发展提供新的研究靶点和方向。而关于circRNA如何通过ceRNA网络具体参与AD的发病机制尚不清楚,后续可通过细胞和动物实验作更深入的研究。

