NLRP3和白细胞介素6受体与房颤相关性研究
刘晨阳,杨海晨,耿嘉逸,李浩宇,雷思思,康品方,唐 碧
(1.蚌埠医科大学第一附属医院 心血管科,安徽 蚌埠 233004;蚌埠医科大学 2.心脑血管病研究中心,3.公共卫生学院2020级预防医学4班,安徽 蚌埠 233030;4.安徽医科大学 临床医学院公共事业管理,安徽 合肥 230000)
心房颤动(AF)目前已成为临床上最常见的心律失常之一,在整个世界范围内的发病率呈现日益增长的趋势,它不仅增加了脑卒中和恶化性心力衰竭的风险[1],同时AF还能让心力衰竭的患病率扩大3倍,并且加剧心力衰竭的临床症状[2]。在心房重构引起的AF的病理生理过程中,经常可以观察到炎症反应的增强[3-4]。
炎症小体是免疫细胞和其他细胞胞质中的高分子量蛋白质复合物,在固有免疫系统对细胞应激反应起着关键作用。NLRP3炎症小体是特征性最显著且被广泛研究的炎症小体,它是由NLRP3、胱冬肽酶-1(caspase-1)及凋亡相关微粒蛋白(ASC)组成的一种蛋白复合物[5]。研究[6]已证实了NLRP3炎症小体在缺血性和非缺血性心肌病小鼠模型中的中心作用。白细胞介素6(IL-6)是一种具有多种效能的细胞因子,其循环水平已被确定为不同心血管疾病(如AF和冠心病)的发生及预后标志[7]。在血浆中,IL-6受体的可溶部分(sIL6R)与可溶性gp130相结合形成复合物(sgp130/sIL6ST),这是一种IL-6的抑制复合物[8],血浆中的sIL-6R作为诱饵受体,负调节IL-6信号。研究[9]发现,AF病人外周血中IL-6水平高于正常人,并且推测因为AF病人血清中的NLRP3炎症小体的异常激活导致下游转导途径开启,使IL-6表达上调,从而加剧部分或整个心脏的炎性活动,促进对心房电重构与结构重构的形成,进而促进AF的发生发展以及维持。一项全基因组关联研究发现了一种有针对性的方法可以识别出IL-6R位点中具有显著性的基因变体名为rs4845625的变异体,它位于IL-6R基因的内含子中,与AF紧密相关[10]。本研究旨在探讨通过血清NLRP3和IL-6R表达水平以及进行两者与左心房内径的相关性,分析NLRP3、IL-6R与AF之间的关系。现作报道。
1 资料与方法
1.1 研究对象
选择我院2019年7月至2020年7月收住的AF病例150例作为观察组,入院检查均有12导联心电图和/或24 h动态心电图所记录的AF波形,根据相关检查分为阵发性AF组(PAF)84例和非阵发性AF组(nPAF)66例。纳入标准:临床相关病例资料完整以及根据我国AF最新指南对AF分类,PAF:持续时间≤7 d(常≤48 h),能自行终止;nPAF:发作之后持续时间超过7 d的AF,nPAF包括持续性AF、长期持续性AF和永久性AF。持续性AF:持续时间>7 d,非自限性;长期持续性AF:持续时间≥1年,病人有转复愿望;永久性AF:持续时间>1年,不能终止或终止后又复发。排除标准:(1)罹患各种急性或慢性炎症性感染性疾病(比如真菌、病毒、细菌等);(2)既往有较为严重的肝肾功能不全及肿瘤病人;(3)合并有各种影响炎症的一些疾病如:心肌炎、甲状腺疾病等疾病病人;(4)近期内有手术史、近3 d内服用抗炎类药物;(5)自身免疫类疾病如:类风湿关节炎、系统性红斑狼疮、痛风等疾病;(6)心血管类疾病及器质性心脏病:如冠心病、瓣膜性心脏病、先天性心脏病、扩张型心肌病、缺血型心肌病、雷诺综合征等。本研究另外选择同一时期至我院排除AF的健康体检者120名作为对照组,并且均无心血管疾病。所有的研究对象均获取知情同意,同时签字确认且符合人体试验伦理标准。研究前获得我院伦理委员会准可。
1.2 实验方法
采集并分析研究对象的临床资料,包括性别、年龄、肝肾功能、血压、白细胞、吸烟史与红细胞及脑卒中病史、糖尿病病史等各种指标。在所有的AF病人在入院后、治疗前和无AF的健康体检者体检时均在早晨7点空腹时抽取外周静脉血10 mL,离心后(3 000 r/min,4 min,半径16 cm)取上层血清装入1.5 mL EP离心管中于-80 ℃超低温冰箱中保存,借助ELISA法,测定NLRP3、IL-6R血清含量,所用试剂盒皆源于上海羽朵公司;借助全自动生化分析仪(西门子,Dimension○REXLTMwith LM)检测生化指标,相关试剂盒源于上海罗氏。以上各项操作皆规范,参照试剂所附说明书开展。
1.3 统计学方法
采用χ2检验、方差分析、q检验、相关分析和logistic回归分析。
2 结果
2.1 3组临床基线资料比较
3组年龄差异有统计学意义(P<0.01);性别、高血压、糖尿病、吸烟史及其他相关实验室检查差异均无统计学意义(P>0.05)(见表1)。

表1 3组一般资料比较[n;百分率(%)]
2.2 3组心脏彩超指标结果比较
对照组LAD较PAF组及nPAF组差异有统计学意义(P<0.05),且在nPAF组与PAF组之间差异亦有统计学意义(P<0.05);3组左室射血分数差异均无统计学意义(P>0.05);3组左室舒张末期内径差异均无统计学意义(P>0.05)(见表2)。
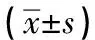
表2 3组研究对象心脏彩超指标结果比较
2.3 3组血清中NLRP3、IL-6R水平比较
与对照组相比,PAF组、nPAF组的IL-6R水平均增高(P<0.05),且两两之间比较差异均有统计学意义(P<0.05)。与对照组相比,PAF组、nPAF组的NLRP3水平均增高(P<0.05),且两两之间比较差异均有统计学意义(P<0.05)(见表3)。

表3 3组血清中NLRP3及IL-6R水平比较
2.4 NLRP3、IL-6R与LAD的相关性分析
观察组中NLRP3水平与LAD呈正相关关系(r=0.771,P<0.05);IL-6R水平与LAD呈正相关关系(r=0.682,P<0.05);观察组中NLRP3水平与IL-6R水平大小呈正相关关系(r=0.680,P<0.05),提示在AF中二者作用性质相同。
2.5 logistic多因素回归分析
采用logistic多因素回归分析,将是否为AF作为因变量,把年龄、NLRP3、IL-6R、LAD作为自变量,结果表明NLRP3及IL-6R血清学水平、LAD、年龄是AF的危险因素(P<0.05)(见表4)。

表4 二元logistic回归分析结果
3 讨论
当前临床中AF此类心律失常的发生率最高,达0.4%~1.0%,此数据在年龄增长下呈不断上涨趋势。近年研究[11]发现对于AF的发生和发展,免疫炎性活动可能起到了重要的参与作用。炎症小体是免疫细胞和其他细胞胞质中的高分子量蛋白质复合物,在固有免疫系统对细胞应激的反应中起着关键作用。炎症小体同时也是一个多蛋白信号转导平台,通常涉及3种蛋白质:NODlike受体(NLR)、含有CARD(ASC)的衔接蛋白样凋亡相关斑点蛋白和半胱氨酸蛋白酶,如caspase-1或caspase-5[12]。
迄今为止,最可能导致AF的炎症细胞类型为“含蛋白3的NACHT、LRR和PYD结构域”(NLRP3)炎症细胞[13],它可以介导caspase-1从前caspase-1的成熟(激活),导致细胞因子(如IL-1β、IL-6)的成熟和释放,并介导炎症性程序性细胞死亡,此种死亡称为热休克[14],为了进一步探讨炎症小体NLRP3对于AF的形成与发展是否具有促进作用,我们对AF病人与非AF病人的NLRP3血清表达量进行检测,结果显示就NLRP3水平而言,相较于对照组,PAF组与nPAF组水平均呈明显偏高(P<0.05),另外nPAF组大于PAF组,说明NLRP3炎症小体与AF的发生关系密切,可能提示AF持续时间越长炎症反应就越剧烈。有研究[14]证实NLRP3炎性小体可以被缺血所诱导,从而在心肌损伤的过程中产生多种信号激活,死亡的心肌细胞释放dsDNA、RNA和ATP,dsDNA和RNA可激活TLR-NFkB信号通路,促进NLRP3和pro-IL1β的启动,ATP可以激活心肌细胞(CMs)中的P2X嘌呤受体7(P2X7R),增强K+流出,促进NLRP3炎症复合物的组装,从而促进caspase-1的自身催化及活化[14]。成熟的caspase-1通过两种机制进一步维持心肌重塑[9],一方面,成熟的caspase-1可以通过将其前体蛋白切割成成熟的IL-1β和IL-18,IL-1β和IL-18的增加将扩散和放大局部炎症并促进纤维化,这是导致心肌结构重塑的主要因素[15]。另一方面,成熟的caspase-1裂解了NLRP3炎症小体的另一个关键成分GSDMD,导致GSDMD的N端蛋白水解片段的形成,该片段可促进炎症细胞死亡,称为“热下垂”[16]。PAF及nPAF病人的CMs中NLRP3炎症小体的活性增加[17],CMs中NLRP3炎症小体的组成性激活可通过在小鼠中产生异位(触发)活性和促进电重构的再进入而增加AF易感性[18]。
IL-6为细胞毒性T细胞(CTL)和成纤维细胞所产生的的一类具备多效性的细胞因子[18],可导致白细胞、中性粒细胞等浸润从而引发全身炎症的活化,而这些炎症介质又可导致血管及内皮的损伤进而通过影响心肌细胞的功能从而诱发AF、心衰等心血管事件[19-22]。AULIN等[23]认为,在AF病人中IL-6高水平与血栓栓塞和大出血的高风险相关,是血栓栓塞事件的独立危险因素。已有研究证实在人体内中IL-6水平与IL-6R水平呈明显直线相关,而IL-6R主要在免疫细胞及干细胞中表达[24],绝大部分的sIL-6R是由选择性剪接这条途径生成的[25],IL-6R通过与IL-6结合,激活JAK/STAT等多条信号转导通路,产生大量终末攻击复合物,造成血管内皮受损从而导致各种心血管事件[26]。IL-6R中广泛存在的(欧洲群体30%~40%)Rs2228145此非同义变体被视作因果变体,其显著正相关于sIL-6R的循环水平[27-28],而血浆中的sIL6R作为诱饵受体,负调节IL6信号,但是在组织水平上,细胞膜蛋白复合物中IL-6R的表达可以促进IL-6信号传导[29]。细胞中IL-6信号转导经由IL-6/膜与自身受体(mIL-6R)结合,或结合自身可溶性受体(sIL-6R),此反应的启动由2个糖蛋白130,即gp130负责[30],上述2类受体介导的为经典的IL-6信号途径即为:IL-6、IL-6R、gp130组成复合物后通过激活丝裂原活化蛋白激酶途径和Janus激酶/信号转导和转录激活因子途径诱导靶基因的表达,从而发挥出其生物学效应[31]。
此外,通过对logistic回归分析发现LAD、年龄对于AF病人来说都是危险因素。LAD作为代表心脏左心房大小及结构形态的重要结构,已证实与AF的发生有关:LAD越大,AF持续的时间就会越长,经早期经射频消融术,术后再次复发的概率就会越高,LAD增大与AF发生和发展可能有着密切联系,可以将左房内径增大作为AF发生的独立危险因素[32-33],故在本研究中我们发现AF病人血清中NLRP3与IL-6R的水平与LAD呈正相关关系(r=0.776、r=0.682,P<0.05),同时结合3组LAD数值来看,我们会发现AF病人随着AF持续时间的不同,LAD数值有差异,持续时间越长,病人的LAD越大。nPAF组LAD大于PAF组、PAF组LAD大于对照组(P<0.05)。LAD增大,说明AF持续时间增加,左心房结构重构加重,而炎症是导致结构重构的重要原因,从而进一步证实了炎症与AF存在密不可分的联系。AF病人NLRP3、IL-6R水平分别与左房内径成正相关,说明炎症越重,左心房重构越明显,就更容易诱发AF并且可能使得AF持续存在。对于年龄我们可以推测:随着年龄的增加正常健康人的心脏功能会逐渐降低,同样心房肌细胞的功能也会慢慢弱化,此时如果伴随着如NLRP3、IL-6R等炎症小体异常激活,心房肌细胞发生结构和/或电生理重构,AF发生的概率会大大增加。但是目前,NLRP3与其下游因子及IL-6R水平在年龄增长下的水平有所提高与否还未明确,尚需通过更为深入的研究来验证。
根据本研究我们得出以下结论:(1)PAF组及nPAF组的病人血清中NLRP3、IL-6R水平的表达高于对照组,提示AF的发生与IL-6R、NLRP3炎症小体紧密相关,其在AF的发生、进展方面可能发挥着关键性作用,在治疗AF方面可能会给予更多有效可行的临床思路。(2)进一步表示AF显著相关于炎性活动。(3)AF病人的LAD和NLRP3、IL-6R表达同样具有相关性,推测其可能是由于IL-6R与IL-6结合引起的炎性活动与炎症小体NLRP3下游的相关炎性介质介导炎性活动的协同刺激下,由此使得心脏电重构与结构重塑使得LAD增大,导致AF的发生。
综上所述,AF病人血清内炎症小体NLRP3与其下游因子表达量增多及IL-6R上调皆显著与AF相关,此成为AF治疗靶点的概率很高。然而本研究样本量有限,同时在其他因素影响下,包括对象选择、各类数据测定方法、组间对比等,还有水平限制,故提供的数据存在不足,尚需通过多中心、大样本研究来更为深入探讨NLRP3、IL-6R同AF的关系。

