miR-199a-5p通过靶向TGF-β2参与调节肝纤维化进程
郭 晖,李 竟,张英杰,曹 通,耿 建
(1.蚌埠医科大学第一附属医院 检验科,安徽 蚌埠 233004;2.蚌埠医科大学 检验医学院,安徽 蚌埠 233030)
肝纤维化是由慢性炎性导致肝损伤而引起的病理过程。肝脏受到损伤后,肝星状细胞(HSCs)被过度激活,产生大量细胞外基质[1-2]。肝纤维化长期持续最终发展为肝硬化,肝硬化是所有慢性肝脏损伤的最终病理阶段。慢性病毒性肝炎如乙肝、丙肝以及饮酒过度等都是肝硬化的主要诱因[3-4]。miRNA是一种长度约为22 nt的单链非编码RNA,通过与mRNA的3′或5′UTR相结合,在转录水平调控基因的表达[5]。研究表明,miR-29[6]、miR-34[7]、miR-122[8]的异常表达均与肝纤维化及肝硬化相关。miR-199家族是在肝癌中研究广泛的miRNA之一,且其表达水平与肝癌分期、高复发率以及差预后相关[9]。此外,在肺部组织受到损伤后,miR-199a-5p在肺纤维化过程中表达上调,并通过调控Caveolin-1介导生长转化因子-β(TGF-β)诱导的肺纤维化反应[10]。这表明miR-199a-5p在组织纤维化进程和肝癌症发生发展中发挥了重要的调控作用。TFG-β在慢性肝病中是一个重要的调控因子。TGF-β家族有TGF-β1、TGF-β2和TGF-β3三个亚型,其中TGF-β1在肝脏纤维化中研究最为广泛,TGF-β1在组织纤维化过程中起促进细胞外基质(ECM)组分生成与聚集,同时抑制基质金属蛋白酶(MMP)表达的作用[11-13]。本文旨在研究miR-199a-5p如何通过靶向TGF-β2参与调节肝纤维化的进程,以期为临床认识肝硬化的发生机制、寻找新的调控靶点提供参考。
1 材料与方法
1.1 细胞系及培养
Lx-2细胞由本实验室保存。细胞培养条件:细胞置于37 ℃、5%CO2培养箱中,利用含有10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的DMEM培养基培养。试剂由赛默飞世尔科技有限公司提供。
1.2 方法
1.2.1 RNA提取及荧光定量PCR 用Trizol(Thermo,USA)提取Lx-2细胞总RNA。总RNA cDNA合成采用逆转录试剂盒(天根生化科技有限公司,北京),反应条件:37 ℃15 min;85 ℃5 s。miRNA cDNA逆转录反应采用miRNA逆转录试剂盒(天根生化科技有限公司,北京),反应条件:42 ℃60 min;95 ℃3 min。采用Takara荧光定量PCR试剂盒检测基因表达,miRNA和mRNA的内参分别为U6和β-actin。每个反应设3个复孔。倍数变化采用2-△△Ct方法计算[14]。
1.2.2 RNA寡核糖核苷酸序列及质粒构建 本研究所用的miR-199a-5p mimics和miR-199a-5p inhibitor由上海吉玛制药技术有限公司设计并合成。以Lx-2 cDNA为模板,分别利用TGF-β2 3′UTR野生型引物序列与miR-199a潜在结合位点突变引物序列进行PCR扩增,获得野生型TGF-β2 3′UTR序列和突变型TGF-β2 3′UTR序列。PCR反应条件为:98 ℃ 10 min;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 60 s,5个循环;98 ℃ 10 s,65 ℃ 30 s,72 ℃ 60 s,25个循环;72 ℃ 2 min。将PCR产物进行琼脂糖凝胶电泳,通过胶回收试剂盒对PCR片段进行回收。采用In-Fusion®HD Cloning Kit将PCR片段与pmiRGLO载体进行重组连接,反应条件为50 ℃ 15 min。TGF-β2 3′UTR区野生型引物序列见表1。
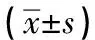
表1 转染miR-199a mimics不同时点2组Lx-2细胞增殖活力比较

表1 TGF-β2 3′UTR区野生型引物序列
1.2.3 CCK8检测 取对数生长期细胞,按每孔5×103细胞接种于96孔板中培养过夜。第2天,根据LipofectamineTMRNAiMAX试剂说明书,将miR-199a-5p的mimics和inhibitor转染到Lx-2细胞中,同时对照组转染等量NC(negative control试剂盒中提供)。在转染后的第0、8、12、24 h分别加入10 μL CCK8到每个孔中孵育1 h,每次3个复孔。孵育1 h后,在450 nm测定吸光度。
1.2.4 5EdU细胞增殖检测 取对数生长期细胞,按每孔5×104细胞接种于24孔板中,培养过夜。第2天,根据LipofectamineTMRNAiMAX试剂说明书,将miR-199a-5p的mimics和inhibitor转染到Lx-2细胞中,同时对照组转染等量NC(negative control试剂盒中提供)。转染24 h后向培养基中加入等体积2×EdU工作液,继续培养细胞2 h。EdU标记完成后,弃去培养液,PBS洗1遍;再加入200 μL固定液,室温固定15 min;每孔用200 μL洗涤液洗涤细胞3次,去除洗涤液,用通透液室温孵育10~15 min;洗涤细胞2~3次,用Hoechst 33342进行细胞核染色,用荧光显微镜检测EdU荧光比例。
1.2.5 Western blotting 对Lx-2细胞转染NC作为对照组,转染miR-199a-5p mimics或miR-199a-5p inhibitor作为实验组,转染完成继续培养24 h后,弃去培养基,用PBS洗涤1遍。加入200 μL RIPA细胞裂解液,冰上裂解2~10 min。用BCA法检测蛋白浓度。在562 nm处检测吸光度。调整蛋白浓度,将蛋白样品进行SDS-PAGE电泳,之后将蛋白条带转到PVDF膜上。用含有5%脱脂奶粉的TBST buffer进行PVDF膜封闭2 h;之后分别加入不同一抗,4 ℃孵育过夜;用TBST洗涤PVDF膜3次后,用HRP结合的二抗室温孵育2 h;用TBST洗涤PVDF膜3次后,用ECL(Millipore)进行显影;用image J软件进行灰度扫描,分析各条带灰度值。
1.2.6 双荧光素酶实验 取对数生长期细胞,按每孔5×103细胞接种于96孔板中,培养过夜。第2天,根据LipofectamineTM2000试剂说明书,将pmiR-h-TGF-β2 UTR-WT和pmiR-h-TGF-β2 UTR-MUT分别转染到Lx2细胞中作为实验组,对照组同时转染等量NC(negative control试剂盒中提供)。转染48 h后,弃去培养基,每孔加入120 μL细胞裂解液,室温裂解1~2 min;充分裂解后,10 000~15 000 g离心3~5 min,取上清100 μL加入1×萤火虫荧光素酶检测试剂,混合均匀后测定相对光单位(relative light unit RLU)值;之后再加入100 μL Renilla荧光素酶检测试剂,混合均匀后测定RLU值。在以Renilla荧光素酶为内参的情况下,用萤火虫荧光素酶测定得到的RLU值除以Renilla荧光素酶测定得到的RLU值。根据得到的比值,比较不同样品间目的报告基因的激活程度。
1.3 统计学方法
采用t检验、方差分析和q检验。
2 结果
2.1 miR-199a-5p促进肝星状细胞系Lx-2增殖
CCK8实验结果显示,Lx-2细胞转染miR-199a-5p mimics后不同时点,细胞活性均较对照组增加(P<0.05~P<0.01),且细胞活性随时间增加而提高(P<0.05)(见表1)。转染miR-199a-5p inhibitor后不同时点,Lx-2细胞活力均低于对照组(P<0.05~P<0.01),且随时间延长而降低(P<0.05)(见表2)。EdU染色检测结果显示,转染miR-199a-5p inhibitor 24 h后,Edu染色阳性细胞较对照组明显减少(见图1)。
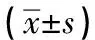
表2 转染miR-199a inhibitor不同时点2组Lx-2细胞增殖活力比较
2.2 过表达miR-199a-5p促进Lx-2细胞激活
光学显微镜下观察显示,miR-199a-5p mimics 转染后,细胞的形态发生明显改变,直径变大,长度增加(见图2)。Western blotting结果显示,转染miR-199a-5p mimics后,α-SMA蛋白表达水平(0.905±0.030)较对照组(0.579±0.036)提高(t=17.89,P<0.05);而转染miR-199a inhibitor后,Lx-2中α-SMA表达水平(0.614±0.046)较对照组(1.126±0.052)降低(t=12.77,P<0.05)(见图3)。

2.3 TGF-β2为miR-199a-5p的下游作用靶点
通过miRNA 靶基因数据库Target ScanVert(http://www.targetscan.org)、miRDB(http://www.mirdb.org),对miR-199a-5p靶基因进行预测分析,结果显示,Has-miR-199a-5p可靶向TGF-β2的3′UTR区(靶向分数Target Score=95)。miR-199a-5p结合位点及序列见图4。将包含miR-199a-5p结合位点的TGF-β2的3′UTR序列构建到双荧光素酶报告系统中,结果显示,与对照组相比,转染miR-199a-5p mimics可明显降低包含野生型TGF-β2 3′UTR序列的荧光素酶表达(P<0.01),而包含miR-199a-5p结合位点突变序列的荧光素酶表达则无明显变化(P>0.05)(见表3)。进一步在Lx-2细胞系中检测miR-199a-5p对TGF-β2表达的影响,Western blotting检测发现,转染miR-199a-5p模拟剂,过表达miR-199a-5p明显抑制TGF-β2表达;反之,转染miR-199a-5p抑制剂,抑制miR-199a-5p明显上调TGF-β2表达(见图5)。

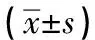
表3 双荧光素酶试验检测转染miR-199a-5p mimics后荧光素酶表达情况
3 讨论
miRNAs种类繁多,参与了包括细胞增殖、凋亡、组织发育在内的多个生物学过程[15-18]。此外,miRNA还在如肿瘤、自身免疫性疾病等的发生发展过程中起重要的调控作用[19-23]。研究[24]表明,miRNA在慢性肝病及肝癌中也发挥重要调控作用,miRNA作为一种疾病检测指标也得到了广泛应用。miR-199a-5p在多种组织纤维化中起到重要调控作用,研究[10]显示,miR-199a-5p通过靶向调节caveolin-1激活肺纤维原细胞。有研究[25]发现,在肝纤维化进程中,miR-199和miR-200家族表达均明显上调,过表达miR-199a-5p可显著促进TIMP1、a-procollagen以及MMP13等纤维化相关基因的表达,该上调预示慢性肝损伤向肝纤维化和晚期肝硬化转化。但miR-199a-5p在肝纤维化和肝硬化中的作用机制并不清晰。本文通过体外研究实验证实,过表达miR-199a-5p可以显著促进Lx-2细胞增殖及细胞活力;同时Western blotting结果显示,miR-199a-5p可以激活肝星状细胞Lx-2,促进HSC激活标志物α-SMA表达,从而诱导肝星状细胞(HSC)的纤维化反应,反之,抑制miR-199a-5p的表达会显著抑制Lx-2增殖,并抑制α-SMA的表达。以上结果显示,miR-199a-5p在体外可以通过激活HSC细胞并促进其增殖促进肝纤维化进程。

此外,miR-199a-5p也在其他疾病中发挥重要调控作用。研究发现,在肝脏损伤初期,AP-1/miR-199a-5p通过持续抵抗内质网应激反应保护肝脏细胞[25];在膀胱尿路上皮癌、软组织肉瘤、肝癌病人中,miR-199a-5p低表达水平与预后差呈正相关关系[27-29];在乳腺癌中,miR-199a-5p通过调控β1整合素抑制肿瘤细胞侵袭[30]。而其在另外一些癌症如胃癌、骨肉瘤中高表达,体外研究[31-32]证明,miR-199a-5p高表达可促进肿瘤细胞的迁移与侵袭。提示miR-199a-5p作为一个可以行使双向调节功能的miRNA,在不同组织、疾病以及不同的疾病进展期中行使不同的正向或者负向调控作用。
本研究通过序列预测发现,miR-199a-5p种子区序列与TGF-β2 3′UTR区282-289位碱基互补,这说明TGF-β2可能为miR-199a-5p的潜在作用靶点。双荧光报告实验证明,miR-199a-5p可以通过与3′UTR区相互作用,调节TGF-β2表达。Western blotting实验也证实,过表达miR-199a-5p可以抑制Lx-2细胞中TGF-β2表达,反之则促进该基因的表达。TGF-β信号通路是肝纤维化和肝硬化过程中重要的调控通路。在长期慢性肝损伤情况下,TGF-β持续高表达,诱导肝星状细胞激活为成肌纤维细胞并诱导大量肝细胞死亡,从而促进了肝纤维化和后期的肝硬化[11]。
TGF-β信号通路参与从初始肝损伤到炎症反应和纤维化再到肝硬化和肝癌的各个发展阶段[33-34]。作为TGF-β信号通路中主要的调控因子之一,TGF-β1在肝脏相关疾病中研究最为广泛,而TGF-β2在肝脏纤维化及肝硬化中的作用并不清晰。有研究[35-36]表明,TGF-β2在EMT形成过程中也起重要作用,在纤维化的肝脏中参与间充质细胞的激活和基质产生。研究[37]显示,在慢性乙肝及晚期纤维化病人体内,TGF-β2表达与Smad2表达呈正相关关系,TGF-β1和TGF-β2均可诱导NRK52E细胞向EMT及纤维化转化,而过表达miR-200a可以通过与TGF-β2 3′UTR区结合直接调控TGF-β2的表达。在胆管性肝病动物模型[35]中,胆管纤维化引起的TGF-β1和TGF-β2表达上调具有明显的时间差异性,TGF-β1在胆管结扎早期出现明显升高,并且之后保持在较高的表达水平,而TGF-β2表达在胆管结扎第2天才出现明显提高,并在之后的14 d内持续上调表达,该研究同时检测了细胞纤维化的多个标志物的表达,结果显示这些基因的表达上调与TGF-β2表达具有相关性。以上结果表明,在组织纤维化进程中,TGF-β1在短时间内表达升高、激活下游目的基因表达。因此,TGF-β2很可能也是TGF-β1的下游调控基因[35]。另有研究[38]表明,在中枢神经系统中,TGF-β2可以抑制急性和慢性神经炎症反应。根据以上研究数据推测,TGF-β1、TGF-β2均参与肝纤维化反应,并发挥重要作用。TGF-β1作为纤维化进程的主要调控因子,在细胞损伤初期上调表达,TGF-β1通过调控其下游基因和miRNA如miR-199a、miR-200a等miRNA家族表达,促进正常肝组织向纤维化发展。随着纤维化展,miR-199a在TGF-β1的调控下持续上调表达,进而调控下游TGF-β2的表达。通过进一步促进HSC细胞增殖、激活表达多种细胞外基质蛋白以及其他促纤维化蛋白,使肝纤维化逐步向肝硬化发展。
综上所述,miR-199a-5p在肝硬化病人中表达显著上调,上调miR-199a-5p表达可以促进HSC细胞系Lx-2的增殖,反之会抑制Lx-2细胞增殖并抑制细胞增殖的活力。同时,miR-199a过表达可以促进细胞基质蛋白α-SMA表达,激活Lx-2向纤维化方向发展。进一步生物信息学靶点预测显示,miR-199a-5p可与TGF-β2的3′UTR相结合,是TGF-β2的潜在调控miRNA之一。转染miR-199a-5p mimics会抑制TGF-β2的表达,而抑制miR-199a-5p则会促进TGF-β2的表达。miR-199a-5p在肝硬化进程中起促进肝纤维化和肝硬化的作用。TGF-β1作为肝纤维化的主要调控因子之一,从上游调控miR-199a-5p的表达,促进miR-199a-5p的持续高表达。而miR-199a-5p通过调控下游TGF-β2的表达,实现对肝纤维化和肝硬化的促进作用。本文对miR-199a-5p在肝纤维化和肝硬化的分子调控机制进行了阐述,对临床认识肝硬化的发生机制、寻找新的调控靶点具有参考意义。

