miR-223-3p通过靶向TGFBR3促进LncRNA ADAMTS9-AS2表达上调抑制肺癌细胞的增殖和迁移作用
陈 平,张 鹤,李少军
(解放军总医院第四医学中心 胸外科,北京 100048)
肺癌是恶性程度较高的肿瘤疾病,其发病率近年来有所升高,虽然其相关治疗方法取得了较大进展,但5年生存率仍较低,部分研究中甚至仅为约10%,预后情况仍不够理想[1-2]。肺癌迁移是影响影响其预后的重要因素[3]。因此,明确肺癌增殖和迁移机制,寻找有效措施抑制肺癌细胞增殖和迁移可能为改善肺癌疗效和预后的有效途径之一。miR-223-3p、长链非编码RNA(LncRNA)ADAMTS9-AS2均为抑癌基因,与多种癌症密切相关,且miR-223-3p可调控LncRNA ADAMTS9-AS2、转化生长因子-βⅢ型受体(TGFBR3)影响癌症发展[4-6]。本研究通过体外实验,探讨miR-223-3p通过靶向TGFBR3促进LncRNA ADAMTS9-AS2表达上调抑制肺癌细胞增殖和迁移的作用及可能机制。
1 材料与方法
1 材料
人非小细胞肺癌(NSCLC)细胞株H1299购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。RPMI 1640培养基、DMEM培养基、胎牛血清等购自美国Hyclone公司。RNA提取试剂盒购自德国Qiagen公司。逆转录试剂盒购自美国Promega公司。RIPA蛋白裂解液、空载体质粒、LipofectamineTM3000试剂盒购自美国Invitrogen公司。miR-223-3p模拟物、抑制剂、siRAC1以及U6、β-actin、miR-223-3p和 TGFBR3引物序列均由上海吉玛制药有限公司合成。细胞计数试剂盒CCK-8、BCA试剂盒购自碧云天生物科技公司。SYBR Premix EX Taq和PCR试剂盒购自日本Takara公司。采用德国艾本德公司的Centrifuge 5920R离心机和微量移液器。采用山东青岛海尔集团有限公司的低温冰箱。采用美国ABI公司的7900HT型实时荧光定量PCR仪。采用北京六一仪器厂的电泳仪。采用日本Olympus公司的SPOT INSIGHT GOLO照相系统。
1.2 方法
1.2.1 细胞培养 细胞株H1299于37 ℃水浴箱融化复苏,将复苏后的细胞株H1299于含10%胎牛血清的RPMI 1640培养基和37 ℃、5% CO2恒温箱培养,每2 d进行一次培养液更换。取对数生长期的第2~5代细胞进行实验。
1.2.2 RT-PCR检测H1299细胞中miR-223-3p和TGFBR3 mRNA表达水平 取对数生长期H1299细胞,常规进行总RNA的提取和测定,根据试剂盒说明书进行逆转录,cDNA于-20 ℃低温冰箱中冷藏待测。各样本均设置6个复孔,miR-223-3pmRNA表达水平检测采用U6为内参,TGFBR3 mRNA表达水平检测采用β-actin为内参。各引物序列如下:U6,F 5′-GTG CTC GCT TCG GCA GCA CAT ATA C-3′,R 5′-AAA AAT ATG GAA CGC TCA CGA ATT TG-3′;β-actin,F 5′-AAA GAC CTG TAC GCC AAC AC-3′,R 5′-GTC ATA CTC CTG CTT GCT GAT-3′;miR-223-3p,F 5′-GGG GTG TCA GTT TGT CAA-3′,R 5′-TGC GTG TCG TGG AGT C-3′;TGFBR3,F 5′-CCT AAG TGT GTG CCT CCT GA-3′,R 5′-CAA TGC CCA TCA CGG TTA GG-3′。采用20 μL PCR反应体系,TaqMan MicroRNA Assay(20×)1 μL、正义链引物1 μL、反义链引物1 μL,逆转录反应产物1.33 μL,TaqMan 2×Universal PCR Master Mix Ⅱ 10 μL,加DEPC水至20 μL。PCR反应条件:90 ℃预变性30 s、95 ℃变性2 min、60 ℃退火40 s、72 ℃延伸60 s,共进行40个循环,其后72 ℃延伸10 min。PCR反应产物进行琼脂凝胶电泳,采用2-ΔΔCt法计算相对表达量。
1.2.3 Western blotting检测 H1299细胞中TGFBR3蛋白表达水平 取对数生长期H1299细胞,经RIPA蛋白裂解液冰上裂解,裂解液以10 000 r/min转速、3 cm半径在4 ℃离心10 min,取上清进行后续检测。进行蛋白质定量后分装并加缓冲液,在99 ℃加热10 min使蛋白变性,进行聚丙烯酰胺凝胶电泳和PVDF膜转膜,经脱脂奶粉封闭60 min后加入相应稀释抗体(1∶1 000),并于4 ℃恒温箱中孵育过夜。TBST洗膜,加入稀释二抗(1∶5 000),以β-actin(1∶5 000)为内参,进行灰度值扫描并分析蛋白相对含量。
1.2.4 RT-qPCR检测H1299细胞中LncRNA ADAMTS9-AS2表达水平 取对数生长期H1299细胞,常规进行总RNA的提取和逆转录操作,cDNA于-20 ℃低温冰箱中冷藏待测。各样本均设置6个复孔,采用U6为内参,LncRNA ADAMTS9-AS2引物序列:F 5′-TCT GTT GCC CAT TTC CTA CC-3′,R 5′-CCC TTC CAT CCT GTC TAC TCT A-3′。U6引物序列、PCR反应条件同1.2.2。
1.2.5 CCK-8实验检测细胞增殖能力 取对数生长期H1299细胞,调整为1×105个/毫升的单细胞悬液,将100 μL单细胞悬液接种于96孔板中,37 ℃、5% CO2恒温箱培养72 h,每孔加200 μL CCK-8试剂溶液,37 ℃、5% CO2恒温箱培养2 h,通过酶标仪在450 nm处测吸光度值,计算细胞增殖倍数。
1.2.6 细胞迁移能力检测 Transwell细胞迁移实验:取对数生长期H1299细胞,0.25%胰酶消化调整为1×105个/毫升单细胞悬液,将200 μL细胞悬液接种于Transwell上层小室,下层加入含10% 胎牛血清的DMEM培养基,37 ℃、5% CO2恒温箱培养24 h,棉签擦去上层细胞,采用4 %多聚甲醛固定15 min,滴加吉姆萨染液染色10 min,蒸馏水洗后显微镜下随机选取5个视野进行观察和拍照,每个样本均设置6个复孔。划痕实验:取对数生长期H1299细胞接种在24孔板中,细胞密度达到90%时,采用10 μL枪尖垂直于底部划5条平行的直线,采用PBS缓冲液洗细胞碎片和悬浮的细胞,显微镜下观察拍照并计算划痕面积(面积1)。添加无血清DMEM培养基37 ℃、5% CO2恒温箱培养24 h,再次进行显微镜下观察拍照并计算划痕面积(面积2),计算划痕闭合率,划痕闭合率=(面积1-面积2)/面积1×100%。
1.2.7 转染实验 脂质体转染miR-223-3p模拟物(过表达组)、抑制剂(抑制组)、对照质粒(对照组)于细胞株H1299。取对数生长期H1299细胞,0.25%胰酶消化调整为1×105个/毫升单细胞悬液,将100 μL单细胞悬液接种于6孔板,37 ℃、5% CO2恒温箱培养24 h,确认细胞融合均达80%以上,进行转染实验。换为无血清DMEM培养基培养1 h,根据LipofectamineTM3000试剂盒说明书指导,将miR-223-3p模拟物、抑制剂、对照质粒转染入相应组别H1299细胞中,转染6 h后更换为含10%胎牛血清的DMEM培养液,37 ℃、5% CO2恒温箱培养48 h后检测转染效率。转染72 h后,检测H1299细胞中miR-223-3p、TGFBR3、LncRNA ADAMTS9-AS2表达水平、细胞增殖能力、细胞迁移能力。
1.3 统计学方法
采用t检验、方差分析和q检验。
2 结果
2.1 3组转染前后TGFBR3蛋白表达水平比较
与转染前比较,过表达组转染后的H1299细胞中TGFBR3蛋白表达水平明显降低(P<0.01);抑制组转染后的H1299细胞中TGFBR3蛋白表达水平明显升高(P<0.01)。转染72 h后,过表达组、对照组、抑制组H1299细胞中TGFBR3蛋白表达水平:抑制组>对照组>过表达组(P<0.01)(见图1~2、表1)。
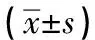
表1 3组转染前后TGFBR3蛋白表达水平比较

2.2 3组转染前后LncRNA ADAMTS9-AS2、miR-223-3p和TGFBR3 mRNA表达水平比较
与转染前比较,过表达组转染后的H1299细胞中miR-223-3p和LncRNA ADAMTS9-AS2表达水平均升高(P<0.05),TGFBR3 mRNA表达水平降低(P<0.05);抑制组转染后的H1299细胞中miR-223-3p和LncRNA ADAMTS9-AS2表达水平均降低(P<0.05),TGFBR3 mRNA表达水平升高(P<0.05)。转染72 h后,H1299细胞中miR-223-3p、LncRNA ADAMTS9-AS2 mRNA表达水平:抑制组>对照组>过表达组(P<0.01),TGFBR3 mRNA表达水平:抑制组>对照组>过表达组(P<0.01)(见表2)。
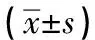
表2 3组转染前后LncRNA ADAMTS9-AS2、miR-223-3p和 TGFBR3 mRNA相对表达量比较
2.3 3组细胞增殖和迁移能力比较
与转染前比较,过表达组转染后的H1299细胞增殖和迁移能力下降(P<0.05);抑制组转染后的H1299细胞增殖和迁移能力增加(P<0.05)。转染72 h后,过表达组、对照组、抑制组H1299细胞增殖和迁移能力逐渐升高(P<0.01)(见表3)。
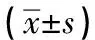
表3 3组细胞增殖和迁移能力比较
3 讨论
肺癌为全球范围内高发的高死亡率恶性肿瘤疾病,其中有85%为NSCLC,相对于其他类型的肺癌,NSCLC具有更强的化疗耐受和侵袭迁移能力,其治疗困难,迁移率高,病人的预后情况较差[7-10]。细胞增殖异常和凋亡被抑制为恶性肿瘤细胞无限增殖以及肿瘤进展的重要原因[11-12]。因此,有效抑制肺癌尤其是NSCLC细胞的增殖及其侵袭迁移为改善肺癌病情和预后的重要途径,也是目前亟待解决的医疗难题。肺癌的发生发展涉及多个病理生理过程和相关基因,而通过相关基因分析和研究,明确肺癌增殖和迁移机制,从而指导临床采取有效措施进行抑制肺癌细胞增殖和迁移为改善肺癌疗效和预后的有效途径之一。
近年来,miRNA相关研究不断深入,不同miRNA在癌症疾病中有不同作用,有些为致癌因子而有些为抑癌因子,多数与恶性肿瘤进展密切相关[13-14]。miR-223-3p是抑癌因子,在肿瘤细胞中常呈现低表达,是细胞周期和凋亡密切相关的miRNA,与多种癌细胞的增殖和凋亡密切相关,且有研究表明其可影响癌细胞迁移从而影响肿瘤进展[15-17]。LncRNA ADAMTS9-AS2亦是抑癌基因,其参与多种类型肿瘤细胞的生物进程,LncRNA ADAMTS9-AS2在肺癌组织中的表达亦较低,且可通过miR-223-3p及其靶基因作用影响癌细胞的增殖、凋亡以及迁移[18-20]。TGFBR3为miR-223-3p作用靶基因,miR-223-3p可在转录水平抑制TGFBR3而发挥其在肿瘤疾病中的作用[5,21-24]。因此,miR-223-3p、LncRNA ADAMTS9-AS2、TGFBR3均可能影响肺癌增殖和迁移,但目前相关研究仍较少。本研究通过脂质体转染miR-223-3p模拟物(过表达组)、抑制剂(抑制组)、对照质粒(对照组)于NSCLC细胞株H1299,探讨miR-223-3p通过靶向TGFBR3促进LncRNA ADAMTS9-AS2表达上调在肺癌细胞的增殖和迁移中的发挥抑制作用的可能性,旨在为肺癌细胞的增殖和迁移的靶向干预和有效治疗从而改善肺癌疗效和预后提供依据。
本研究结果显示,过表达组转染后的H1299细胞中miR-223-3p m和LncRNA ADAMTS9-AS2表达水平升高而TGFBR3蛋白表达水平明显降低,抑制组转染后的H1299细胞中miR-223-3p和LncRNA ADAMTS9-AS2表达水平降低而TGFBR3蛋白表达水平明显升高性,提示miR-223-3p可能调节肺癌细胞中TGFBR3和LncRNA ADAMTS9-AS2表达,结合LIU等[5]研究中肺癌中miR-223-3p直接与TGFBR3、LncRNA ADAMTS9-AS2结合以及miR-223-3p通过靶向TGFBR3促进肺癌细胞的增殖、迁移和侵袭,推测miR-223-3p可能通过靶向TGFBR3、促进LncRNA ADAMTS9-AS2表达影响肺癌发生发展。本研究中过表达组转染后H1299细胞的细胞增殖倍数、侵袭细胞数及细胞划痕闭合率降低,而抑制组转染后的H1299细胞的细胞增殖倍数、侵袭细胞数及细胞划痕闭合率升高,过表达miR-223-3p可抑制肺癌细胞增殖和迁移能力,而miR-223-3p抑制则导致H1299细胞增殖和迁移能力增强,提示miR-223-3p可能为肺癌治疗靶基因,miR-223-3p可通过靶向TGFBR3、促进LncRNA ADAMTS9-AS2表达等途径抑制肺癌增殖和迁移,上调miR-223-3p和LncRNA ADAMTS9-AS2表达及下调TGFBR3表达可能为肺癌治疗的有效途径之一,通过miR-223-3p靶向干预可能有效抑制肺癌的增殖和迁移,抑制肺癌病情进展,改善疗效和预后,但仍需进一步实验和临床研究证实。
综上所述,miR-223-3p对H1299细胞的增殖和迁移均具有抑制作用,其机制可能为miR-223-3p靶向下调TGFBR3和上调LncRNA ADAMTS9-AS2表达从而抑制肺癌细胞增殖和迁移。

